Orenburg State Medical University of the Ministry of Healthcare of Russia
Abstract. The aim of the study was to identify the features of changes in the processes of lipid peroxidation (LPO), antioxidant system condition and to fix their correlation with indexes of the strength of the respiratory muscles in patients with type 2 diabetes mellitus (DM).
Material and methods. In 19 patients with type 2 diabetes were assessed: strength of the respiratory muscles – by indexes of the maximal inspiratory pressure and the maximal expiratory pressure at the level of the oral cavity; activity of LPO processes – by determining malondialdehyde (MDA) and diene conjugates in blood serum; activity of the antioxidant system – by changing the activity of superoxide dismutase (SOD) and catalase (CAT) in erythrocytic hemolysate.
Results. The strength of the inspiratory muscles in patients with DM was lower than in the comparison group by 21,6%. They had an increase in MDA content by 51,3% and a decrease in SOD activity by 17,2% comparatively with patients without carbohydrate metabolism disorders. An average level of positive correlation relationship was found between the indicator of maximum inspiratory pressure and the level of CAT activity (r=0,35; p ≤0,05).
Conclusion. Patients with type 2 diabetes mellitus have reduced strength of the inspiratory respiratory muscles, the state of the prooxidant-antioxidant system in them is characterized by an increase of MDA level and a decrease in SOD activity. A positive correlation was found between the change in the strength of the inspiratory muscles and the activity of CAT in erythrocytic hemolysate.
type 2 diabetes mellitus
strength of respiratory muscles
lipid peroxidation
Сахарный диабет 2 типа (СД) является одним из наиболее распространенных и значимых неинфекционных заболеваний [1]. Ведущим патогенетическим механизмом СД выступает гипергликемия, на фоне которой развивается оксидативный стресс с продукцией активных форм кислорода (АФК) [2, 3]. Избыток последних приводит к активации перекисного окисления липидов (ПОЛ), продукты которого относятся к токсичным метаболитам, оказывающим повреждающее действие на липопротеиды, белки, ферменты и нуклеиновые кислоты скелетной мускулатуры, в том числе дыхательных мышц [2, 4]. Установлено, что для больных СД характерно снижение силы дыхательных мышц [5]. В то же время в литературе недостаточно данных о взаимосвязи изменений свободно-радикальных процессов и функционального состояния дыхательной мускулатуры при СД.
Цель исследования – выявить особенности изменения процессов ПОЛ, состояния антиоксидантной системы и установить их взаимосвязь с показателями силы дыхательных мышц у больных СД 2 типа.
МАТЕРИАЛ И МЕТОДЫ
Исследование было одобрено локальным этическим комитетом ФГБОУ ВО «Оренбургский государственный медицинский университет» Минздрава России. Согласно критериям включения, были обследованы 48 мужчин, подписавших информированное добровольное согласие, в возрасте от 45 до 65 лет, которые были разделены на 2 группы:
- основная группа – 19 пациентов с СД со средней длительностью заболевания 4,8 лет;
- группа сравнения (рандомизированная с основной по возрасту) – 29 больных без нарушений углеводного обмена.
Критериями исключения из исследования были отказ от участия в исследовании; заболевания органов дыхания; сердечная недостаточность; дыхательная недостаточность, почечная недостаточность, перенесенный инфаркт миокарда; острое нарушение мозгового кровообращения в анамнезе; ожирение 3 степени; цирроз печени; злокачественные опухоли; аутоиммунные заболевания; острые и хронические заболевания в стадии обострения.
Диагноз СД устанавливался согласно Алгоритмам специализированной медицинской помощи больным сахарным диабетом (9-й выпуск, 2019 г.).
Сила дыхательной мускулатуры оценивалась по показателям максимального инспираторного давления (MIP) и максимального экспираторного давления (MEP) на уровне ротовой полости с помощью прибора MicroRPM (MicroMedicalLtd., Великобритания). Осуществлялось не менее трех маневров максимального вдоха и максимального выдоха до получения трех значений с разницей не более 20% с регистрацией лучшего результата. Должными считались значения МIP и MEP ≥80 см вод.ст.
Оценка процессов ПОЛ проводилась с помощью определения малонового диальдегида (МДА) и диеновых конъюгат (ДК) в сыворотке крови обследуемых. Концентрация МДА определялась методом Ohkawa H. et al. [6], содержание ДК – на основании классического метода Placer Z. [7]. Состояние антиоксидантной системы оценивалось по изменению активности супероксиддисмутазы (СОД) [8] и каталазы (КАТ) [9] в гемолизате эритроцитов.
Статистический анализ материала осуществлялся с использованием непараметрических методов в пакете прикладных программ STATISTICA 10.0 (StatSoft, Russia), достоверными считались показатели при р <0,05. Данные представлены в виде Me (Q1; Q3). Для оценки достоверности различий между группами применялся критерий Манна–Уитни, корреляционный анализ проводился с помощью коэффициента корреляции Спирмена (r).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Обследованные пациенты относились к средней возрастной группе. Сопутствующая терапевтическая патология была представлена пропорционально в обеих группах артериальной гипертонией (АГ) 2 степени. Показатель индекса массы тела (ИМТ) свидетельствовал о наличии ожирения у всех обследованных пациентов с превышением этого показателя у больных СД относительно группы сравнения на 7,3% (табл.).
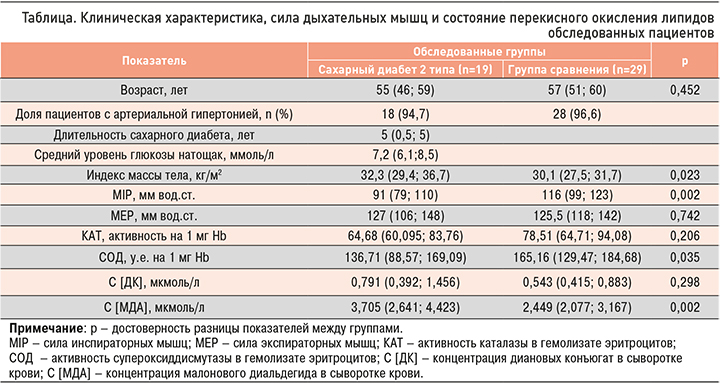
Сила инспираторных мышц (MIP) у больных СД была ниже по сравнению с пациентами без нарушений углеводного обмена на 21,6%. Сила экспираторных мышц (MEP) у пациентов обеих групп находилась на одном уровне. У больных диабетом был выявлен достоверно более высокий относительно группы сравнения уровень содержания МДА (продукта ПОЛ) – на 51,3%. Активация процессов ПОЛ сопровождалась у больных СД снижением активности антиоксидантной системы крови, что выражалось в более низких значениях СОД в основной группе – на 17,2% меньше, чем в группе сравнения. Установлено, что длительность заболевания не оказывает влияния на активность ПОЛ и антиоксидантной системы крови.
При выполнении корреляционного анализа был установлен средний уровень положительной связи между показателем MIP и уровнем активности КАТ (r=0,35, р ≤0,05) у обследованных пациентов в обеих группах.
Таким образом, у больных СД имеет место более высокая активность процессов ПОЛ, характеризующаяся высокой концентрацией МДА при одновременном снижении активности СОД. Другими словами, полученные данные свидетельствуют о наличии дисбаланса между прооксидантной и антиоксидантной системами у больных СД, установленного ранее [10, 11]. Предполагается, что в основе снижения силы дыхательных мышц при СД лежат не только микроциркуляторные и нейропатические изменения, но и метаболические нарушения. Выявленная корреляционная связь между силой инспираторных мышц и уровнем активности КАТ указывает на наличие взаимосвязи между функциональным состоянием дыхательной мускулатуры и процессами ПОЛ, а также о возможном влиянии дисбаланса про- и антиоксидантной системы на развитие слабости дыхательных мышц при СД.
ЗАКЛЮЧЕНИЕ
1. У больных СД 2 типа снижена сила инспираторных дыхательных мышц.
2. Состояние прооксидантно-антиоксидантой системы у больных СД 2 типа характеризуется увеличением уровня МДА и снижением активности СОД.
3. Выявлена положительная взаимосвязь между изменением силы инспираторных мышц и активностью КАТ в гемолизате эритроцитов.f Healthcare of Russia. Address: 460014, Orenburg, 6 Sovetskaya Str. Tel.: +7 (912) 355-56-55. E-mail: k_normphys@orgma.ru
- Дедов И.И., Шестакова М.В., Викулова О.К. Эпидемиология сахарного диабета в Российской Федерации: клинико-статистический анализ по данным Федерального регистра сахарного диабета. Сахарный диабет. 2017; 1: 13–41. [Dedov I.I., Shestakova M.V., Vikulova O.K. Epidemiology of diabetes mellitus in Russian Federation: clinical and statistical report according to the federal diabetes registry. Sakharnyy diabet = Diabetes Mellitus. 2017; 1: 13–41 (In Russ.)]. doi: https://doi.org/10.14341/DM8664.
- Балаболкин М.И., Клебанова Е.М. Роль окислительного стресса в патогенезе сосудистых осложнений диабета. Проблемы эндокринологии. 2000; 6: 29–34. [Balabolkin M.I., Klebanova E.M. The role of oxidative stress in the pathogenesis of vascular complications of diabetes. Problemy endokrinologii = The Problems of Endocrinology. 2000; 6: 29–34 (In Russ.)].
- Fatani S.H., Babakr A.T., Nour Eldin E.M., Almarzouki A.A. Lipid peroxidation is associated with poor control of type-2 diabetes mellitus. Diabetes Metab Syndr. 2016; 10(2 Suppl 1): 64–67. doi: 10.1016/j.dsx.2016.01.028.
- Калинина Е.П., Гельцер Б.И., Дей А.А. с соавт. Оценка взаимосвязей индикаторов оксидантно-антиоксидантной системы и силы дыхательных мышц при внебольничной пневмонии. Туберкулез и болезни легких. 2020; 3: 45–51. [Kalinina E.P., Geltser B.I., Dey А.А. et al. Evaluation of relationships between indicators of the oxidative-antioxidative system and force of respiratory muscles in the case of community-acquired pneumonia. Tuberkulez i bolezni legkikh = Tuberculosis and Lung Diseases. 2020; 3: 45–51 (In Russ.)]. doi: https://doi.org/10.21292/2075-1230-2020-98-3-45-51.
- Сивожелезова О.К., Иванов К.М., Мирошниченко И.В., Кунарбаева А.К. Особенности изменения силы дыхательных мышц у больных сахарным диабетом 2 типа, осложненным синдромом диабетической стопы. Архивъ внутренней медицины. 2018; 3: 204–208. [Sivozhelezova O.K., Ivanov K.M., Miroshnichenko I.V., Kunarbaeva A.K. Peculiarities of the change in the respiratory muscles strength in patients with 2 type of diabetes mellitus complicated by the diabetic foot syndrome. Arkhiv vnutrenney meditsiny = The Archives of Internal Medicine. 2018; 3: 204–208 (In Russ.)]. doi: https://dx.doi.org/10.20514/2226-6704-2018-8-3-204-208.
- Ohkawa H., Ohishi N., Yagi K. Assay for lipid peroxidesin animal tissues by thiobarbituric acid reaction. Anal Biochem. 1979; 2: 351–58. doi: 10.1016/0003-2697(79)90738-3.
- Placer Z. Lipperoxidation systeme im biologischen material. Nahrung. 1968; 12: 679.
- Cирота Т.В. Новый подход в исследовании процесса аутоокисления адреналина и использование его для измерения активности супероксиддисмутазы. Вопросы медицинской химии. 1999; 3: 263–272. [Sirota T.V. A new approach to the study of the process of autooxidation of adrenaline and its use to measure the activity of superoxidedismutase. Voprosy meditsinskoy khimii = Medicinal Chemistry Issues. 1999; 3: 263–272 (In Russ.)].
- Zuck H. Catalase. Methods of enzymatic analysis. Pergamon Press. 1963: 885–94.
- Likidlilid A., Patchanans N., Peerapatdit T., Sriratanasathavorn C. Lipid peroxidation and antioxidant enzyme activities in erythrocytes of type 2 diabetic patients. J Med Assoc Thai. 2010; 93(6): 682–93.
- Чернышева Е.Н. Возможность коррекции про- и антиоксидантной систем у пациентов с сахарным диабетом 2-го типа при метаболическом синдроме. Астраханский медицинский журнал. 2015. 4: 96–101. [Chernysheva E.N. The possibility of correction of pro- and antioxidant systems in patients with type 2 diabetes with metabolic syndrome. Astrakhanskiy meditsinskiy zhurnal = Astrakhan Medical Journal. 2015. 4: 96–101 (In Russ.)].
Adel K. Kunarbaeva, postgraduate student of the Department of propedeutics of internal diseases, Orenburg State Medical University of the Ministry of Healthcare of Russia. Address: 460022, Orenburg, 8/1 Narodnaya Str. Tel.: +7 (922) 809-75-99. E-mail:
kunarbaeva.adel@yandex.ru
Konstantin M. Ivanov, MD, professor, head of the Department of propedeutics of internal diseases, Orenburg State Medical University of the Ministry of Healthcare of Russia. Address: 460022, Orenburg, 8/1 Narodnaya Str. Tel.: +7 (987) 340-39-94. E-mail:
kmiwanov@mail.ru
Alena A. Petrova, assistant of the Department of chemistry, Orenburg State Medical University of the Ministry of Healthcare of Russia. Address: 460000, Orenburg, 7 Parkovy Avenue. Tel.: +7 (922) 625-01-46. E-mail:
k_chemistry@orgma.ru
Sergey I. Krasikov, MD, professor, head of the Department of chemistry, Orenburg State Medical University of the Ministry of Healthcare of Russia. Address: 460000,Orenburg, 7 Parkovy Avenue. Tel.: +7 (922) 625-01-46. E-mail:
k_chemistry@orgma.ru
Igor V. Miroshnichenko, MD, professor, head of the Department of normal physiology, Orenburg State Medical University of the Ministry of Healthcare of Russia. Address: 460014, Orenburg, 6 Sovetskaya Str. Tel.: +7 (912) 355-56-55. E-mail:
k_normphys@orgma.ru



