Abstract. Underestimation of depressive and eating disorders in patients with type 2 diabetes mellitus (T2 DM) can affect the compensation of carbohydrate metabolism, the occurrence of complications, and affect the patient’s subjective sense of health.
The aim: to analyze the relationship between eating disorders, depressive disorders, and quality of life in women with complicated T2 DM.
Material and methods. 382 women with T2 DM and microvascular complications were studied. The control group consisted of patients without diabetes (n=121). A clinical examination of the selected contingent was carried out. The work used DEBQ and MOS SF-36 questionnaires and V. Tsung’s technique.
Results. At the time of the study, 21,9% of patients with T2 DM suffered from depression. The rate of depressive disorders in patients with diabetes was significantly higher than in the control group. Depressive disorders in women with T2 DM increased with age (r=+0,9, p=0,0001). A relationship was found between the degree of depressive disorders and BMI (r=+0.5; p=0.02), waist circumference (r=+0,89; p=0,0001). The presence of a negative correlation of depressive disorders with indicators of carbohydrate metabolism and external type of eating behavior has been established. Disorders in the emotional sphere significantly reduced the scores of the main characteristics of quality of life.
Conclusion. Depressive disorders in women with T2 DM were registered more often than in the control group and correlated with age, metabolic disorders, and subjective feelings of health. The results obtained significantly actualize the problem of controllability of depressive disorders and eating behavior in patients with T2 DM, the solution of which is impossible without an interdisciplinary approach.
АКТУАЛЬНОСТЬ
Значительное число исследований указывает на связь пищевых и депрессивных расстройств [1]. Нарушения пищевого поведения сопровождаются развитием депрессии в 50–75% случаев [2]. Этиопатогенетические аспекты сочетанной патологии неоднозначны и требуют изучения. Известно, что тревожные состояния часто сопровождаются снижением аппетита, но, с другой стороны, в ряде случаев воздействие стрессорного фактора приводит к повышению потребления пищи [3]. Обсуждаемые вопросы актуальны для пациентов с сахарным диабетом 2-го типа (СД 2), так как больным необходимо менять стереотип питания, образ жизни под воздействием стрессогенного фактора, коим является СД. По данным литературы, самый высокий уровень депрессий отмечается в первый год с момента выявления СД, а также на момент обнаружения его осложнений, в среднем спустя около 10 лет от постановки диагноза [4]. Недооценка депрессивных и пищевых расстройств у больных СД 2 напрямую или косвенно может способствовать декомпенсации углеводного обмена, увеличивать риск осложнений диабета [5]. Ухудшение психологического благополучия негативно отражается на качестве жизни пациента.
Цель исследования – проанализировать взаимосвязь пищевых и депрессивных расстройств, качества жизни у женщин с осложненным СД 2.
МАТЕРИАЛ И МЕТОДЫ
Исследование проводилось на базе эндокринологического отделения ГБУЗ ПК «Пермская краевая клиническая больница». Обследовано 382 женщины с СД 2, имеющие микрососудистые осложнения, контрольную группу составили больные без СД (n=121). У 62% пациенток отмечено ожирение и у 24,3% – избыточная масса тела.
Критерии включения в исследование: возраст от 50 до 80 лет, добровольно подписанное информированное согласие на обследование, диагностированный СД 2.
Критерии невключения: злокачественные новообразования, значимые психоневрологические расстройства, острые воспалительные процессы любой этиологии и локализации.
Выполнено клиническое обследование отобранного контингента. Для выявления нарушений пищевого поведения (ПП) использовался опросник DEBQ [6]. Оценка психоэмоциональной сферы, депрессивных состояний осуществлялась с помощью методики В. Цунга (тест адаптирован Т.И. Балашовой в отделении наркологии НИИ им. Бехтерева). [7]. Для исследования качества жизни применялся опросник MOS SF-36 (Medical Outcomes Study Short Form-36) [8].
Статистическая обработка собранной информации проводилась на ПК с использованием программ STATISTICA 6 и Microsoft Excel 7.0 для Windows XP. Статистический анализ выполнялся по методикам, рекомендуемым в медико-биологической статистике [9]. Результаты описательной статистики для количественных признаков были представлены в формате М±SD (средняя величина изучаемого признака ± стандартное отклонение). Для оценки взаимосвязей между признаками применялся коэффициент ранговой корреляции Спирмена (r). Оценка статистической значимости различий групп осуществлялась с использованием t-критерия Стьюдента.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Анализ состояния эмоциональной сферы пациенток с СД 2 по психометрической шкале Цунга показал, что на момент исследования 19,2% из них страдали легкой депрессией, 2,7% – умеренной (значительное снижение настроения), что сопоставимо с данными других исследователей (17%) [10]. Показатель депрессии в группе больных СД 2 составил 46,2±0,7, в группе сравнения – 43,2±1,0 (p <0,05). С возрастом депрессивные расстройства у женщин с СД 2 усиливались (r=+0,9, р=0,000). Отмечена связь между степенью депрессивных расстройств и избыточной массой тела (r=+0,5; р=0,02). Уровень депрессии коррелировал c окружностью талии (r=+0,89; р=0,000). Степень нарушений болевой чувствительности нижних конечностей оказалась прямо пропорциональна степени депрессивных нарушений (r=+0,896, р=0,0001).
Депрессивное расстройство напрямую или опосредованно способно изменять гликемический профиль. Результаты проведенных исследований о влиянии депрессии на уровень гликированного гемоглобина (HbA1c) противоречивы. Ряд авторов в 40,8% случаев установили связь нарушений углеводного обмена с депрессивными эпизодами. Некоторые исследователи доказали, что тревожность способствует росту гликемической вариабельности [12, 13]. В других работах связи между степенью компенсации углеводного обмена и депрессией не обнаружено [14, 15]. Имеются данные о взаимосвязи депрессии и гипогликемии [16, 17]. Наше исследование показало наличие отрицательной корреляции депрессивных расстройств с показателями гликированного гемоглобина (r=-0,5, р=0,02), гликемией натощак (r=-0,898, р=0,000), постпрандиальной гликемией (r=-0,9, р=0,000).
Частые гипогликемические состояния приводят к неблагоприятным последствиям со стороны центральной нервной системы: повреждение митохондрий влечет за собой дефицит АТФ, индуцирует срыв электролитного гомеостаза [18]. Кроме непосредственного влияния гипогликемии на структуру нервной ткани, необходимо принимать во внимание активацию симпатической нервной системы, которая также негативно сказывается на работе нейронов [19]. Широко обсуждаются вопросы, связанные с единым патогенетическим механизмом, лежащим в основе развития СД 2 и депрессии. В качестве одного из патогенетических звеньев предлагается цитокиновая гипотеза [20]. Имеются данные о молекулярной взаимосвязи между СД 2 и депрессией.
Нарушения и тип пищевого поведения тесно ассоциированы с психоэмоциональными расстройствами. В нашем исследовании по мере увеличения депрессивных расстройств снижались показатели экстернального типа ПП: r=-0,356; р=0,046. Чем более была выражена степень депрессии, тем в меньшей степени на прием пищи оказывали влияние внешние раздражители. Что касается полученных данных в отношении обратной связи экстренального типа ПП и депрессии, то можно предположить, что желание что-то съесть в ответ на неприятные переживания может присутствовать, но не реализуется при наличии достаточного самоконтроля у больных СД, о чем свидетельствовало наличие сочетания ограничительного типа ПП и экстренального в 14,6% случаев. Ограничительное ПП встречалось у 21% респондентов, изолированное ПП по экстернальному типу – у 13%. Установлено, что ограничительный тип ПП имеет непоследовательный характер, например, может приводить к развитию «диетической депрессии». Самоограничение связано с чувством вины, в данном случае – с употреблением пищи. Исследования Figlewicz D.P. (2003) показывают наличие рецепторов к инсулину в лимбической системе, ответственной за формирование мотиваций, стимулов, поведенческих реакций. Рецепторы найдены в черной субстанции, в среднем мозге и на транспортере обратного захвата дофамина. Нейроны дофамина принимают участие в формировании чувства удовольствия. Инсулин способен повышать активность транспортера обратного захвата дофамина, что, в свою очередь, проявляется уменьшением значимости пищи как вознаграждающего стимула [21]. Гипотезу о регуляции инсулином дофаминергического ответа подтверждает наличие корреляции между экспрессией белков, связанных с дофаминергической системой и передачей сигналов инсулина у пациентов с депрессией [22].
Депрессивные расстройства часто сопряжены с потерей аппетита. Однако существует подтип депрессии, который, напротив, сопровождается повышенным аппетитом. Эмоциогенное пищевое поведение считается маркером этого подтипа депрессии [23]. Результаты нашего исследования продемонстрировали, что у 14,3% пациенток эмоциогенный тип ПП сочетался с экстернальны, а у 6,2% – с ограничительным типом ПП.
Депрессивные расстройства влияют на качество жизни пациентов с СД 2. Качество жизни при диабете снижается не только в связи с ухудшением состояния здоровья из-за наличия тяжелых осложнений, но и вследствие психопатологических состояний [24–28]. СД ‒ заболевание, которое заставляет больного менять образ жизни и, как следствие, становится причиной эмоциональных расстройств, среди которых часто встречается депрессия. В ходе исследования было обнаружено, что у больных СД 2 расстройства в эмоциональной сфере, проявляющиеся наличием депрессии, достоверно снижали баллы основных характеристик качества жизни. Выявлена обратная корреляция между уровнем депрессивных расстройств и показателями по шкалам физического функционирования (PF), общего состояния здоровья (GH), жизненной активности (VT), ментального (психического) здоровья (MH). Полученные данные представлены в таблице.
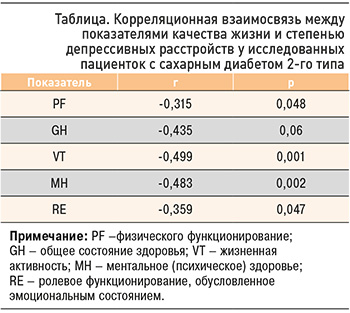
Уровень депрессивных расстройств отражался на субъективной оценке состояния здоровья больных: у них снижались жизненный тонус и физическая активность. Ряд исследователей указывали на нарушение трудоспособности, продуктивности у пациентов с СД при наличии у них тревожных расстройств [29, 30].
ЗАКЛЮЧЕНИЕ
Таким образом, депрессивные расстройства у женщин с СД 2 регистрировались чаще по сравнению с группой контроля, коррелировали с возрастом, метаболическими нарушениями. О снижении качества жизни при депрессивных состояниях свидетельствовала обратная связь с показателями по шкалам физического функционирования, общего состояния здоровья, жизненной активности, ментального здоровья. Полученные результаты в значительной степени актуализируют проблему управляемости депрессивными нарушениями и пищевым поведением при СД 2, решение которой невозможно без междисциплинарного подхода.
1. Buhren K., Schwarte R., Fluck F. Comorbid psychiatric disorders in female adolescents with first-onset anorexia nervosa. Eur Eat Disord Rev. 2014; 22(1): 39–44. http://dx.doi.org/10.1002/erv.2254.
2. Practice guideline for the treatment of patients with eating disorders (revision). Am J Psychiatry. 2000; 157(1 Suppl): 1–39.
3. Мазо Г.Э., Рукавишников Г.В, Кибитов А.О. с соавт. Нарушения пищевого поведения у пациентов с депрессивным расстройством: патофизиологические механизмы коморбидности. Успехи физиологических наук. 2019; 50(2): 31–41. [Mazo G.E., Rukavishnikov G.V., Kibitov A.O. et al. Eating disorders in patients with depressive disorder: Pathophysiological mechanisms of comorbidity. Uspekhi fiziologicheskikh nauk = Advances in the Physiological Sciences. 2019; 50(2): 31–41 (In Russ.)].http://dx.doi.org/10.1134/S0301179819020073. EDN: WLUXQB.
4. Katon W., Russo J., Lin E.H.B. Diabetes and poor disease control: Is comorbid depression associated with poor medication adherence or lack of treatment intensification? Psychosom Med. 2009; 71(9): 965–72. http://dx.doi.org/10.1097/PSY.0b013e3181bd8f55.
5. Вербовой А.Ф., Шаронова Л.А. Анализ нарушений пищевого поведения, депрессивных и тревожных расстройств у женщин с сахарным диабетом. Эндокринология. Новости. Мнения. Обучение. 2018; 7(2): 60–66. [Verbovoi A.F., Sharonova L.A. Analysis of eating disorders, depressive and anxiety disorders in women with diabetes mellitus. Endokrinologiya. Novosti. Mneniya. Obucheniye = Endocrinology. News. Opinions. Education. 2018; 7(2): 60–66 (In Russ.)].http://dx.doi.org/10.24411/2304-9529-2018-12006. EDN: XXSEJV.
6. Van Strien, T., Frijters, J.E.R., Bergers, G.P.A., Defares, P.B. The Dutch Eating Behavior Questionnaire (DEBQ) for assessment of restrained, emotional, and external eating behavior. Int J Eat Disord. 1986; 5: 295–315.http://dx.doi.org/10.1002/1098-108X(198602)5:2<295::AID-EAT2260050209>3.0.CO;2-T.
7. Zung W.W.K. The depression status inventory: An adjunct to the self-rating depression scale. J Clin Psychol. 1972; 28(4): 539–43. https://dx.doi.org/10.1002/1097-4679(197210)28:4<539::aid-jclp2270280427>3.0.co;2-s.
8. Новик А.А., Ионова Т.И. Руководство по исследованию качества жизни в медицине. М.: Олма-Медиа-групп. 2007; 320 с. [Novikov A.A., Ionova T.I. Guidelines for the study of quality of life in medicine. Moscow: Olma-Media-group. 2007; 320 pp. (In Russ.)]. ISBN: 978-5-373-01011-5.
9. Решетников В.А. Основы статистического анализа в медицине. Учебное пособие. М.: Медицинская информатика и статистика, телемедицина. 2020; 176 с. [Reshetnikov V.A. Fundamentals of statistical analysis in medicine. A tutorial. Moscow: Medical Informatics and Statistics, Telemedicine. 2020; 176 pp. (In Russ)]. ISBN: 978-5-9986-0382-2.
10. Бобров А.Е., Старостина Е.Г., Агамамедова И.Н. с соавт. Психические расстройства при сахарном диабете 2-го типа. Журнал неврологии и психиатрии им. С.С. Корсакова. 2021; 121(7): 22–30. [Bobrov A.E., Starostina E.G., Agamamedova I.N. et al. Mental disorders in type 2 diabetes. Zhurnal nevrologii i psikhiatrii imeni S.S. Korsakova = S.S. Korsakov Journal of Neurology and Psychiatry. 2021; 121(7): 22–30 (In Russ.)]. https://dx.doi.org/10.17116/jnevro202112107122. EDN: TXIPKK.
11. Tzeng W.C. Gender differences in metabolic syndrome risk factors among patients with serious mental illness. Int J Ment Health Nurs. 2020; 29(2): 254–65. https://dx.doi.org/10.1111/inm.12670.
12. Biggers A. Relationship between depression, sleep quality, and hypoglycemia among persons with type 2 diabetes. J Clin Transl Endocrinol. 2019: 15: 62–64. https://dx.doi.org/10.1016/j.jcte.2018.12.007.
13. Reis D. J., Ilardi S.S., Namekata M.S. et al. The depressogenic potential of added dietary sugars. Med Hypotheses. 2020; 134: 109421. https://dx.doi.org/10.1016/j.mehy.2019.109421.
14. Fisher L., Glasgow R.E., Strycker L.A. The relationship between diabetes distress and clinical depression with glycemic control among patients with type 2 diabetes. Diabetes Care. 2010; 33(5): 1034–103. https://dx.doi.org/10.2337/dc09-2175.
15. Ismail K., Winkley K, Stahl D. A cohort study of people with diabetes and their first foot ulcer: The role of depression on mortality. Diabetes Care. 2007; 30(6): 1473–79. https://dx.doi.org/10.2337/dc06-2313.
16. Honkasalo M.T., Elonheimo О.М., Sane Т. Severe hypoglycemia in drug-treated diabetic patients needs attention: A population-based study. Scand J Prim Health Care. 2011; 29(3): 165–70. https://dx.doi.org/10.3109/02813432.2011.580090.
17. Katon W.J., Young B., Russo J. Association of depression with increased risk of severe hypoglycemic episodes in patients with diabetes. Ann Fam Med. 2013; 11(3): 245–50. https://dx.doi.org/10.1370/afm.1501.
18. Mohseni S. Neurologic damage in hypoglycemia. Handb Clin Neurol. 2014; 126: 513–32.https://dx.doi.org/10.1016/B978-0-444-53480-4.00036-9.
19. Smith L., Chakraborty D., Smith L., Bhattacharya P. Exposure to hypoglycemia and risk of stroke. Ann NY Acad Sci. 2018; 1431(1): 25–34. https://dx.doi.org/10.1111/nyas.13872.
20. Farooq R.K. Role of inflammatory cytokines in depression: Focus on interleukin-1β. Biomed Rep. 2017; 6(1): 15–20.https://dx.doi.org/10.3892/br.2016.807.
21. Mansur R.B., Fries G.R., Subramaniapillai M. Expression of dopamine signaling genes in the post-ortem brain of individuals with mental illnesses is moderated by body mass index and mediated by insulin signaling genes. J Psychiatr Res. 2018; 107: 128–35. https://dx.doi.org/10.1016/j.jpsychires.2018.10.020.
22. Nash A.I. Crosstalk between insulin and dopamine signaling: A basis for the metabolic effects of antipsychotic drugs. J Chem Neuroanat. 2017: 83–84: 59–68. https://dx.doi.org/10.1016/j.jchemneu.2016.07.010.
23. Мищенкова Т.В., Звенигородская Л.А., Варванина Г.Г. с соавт. Роль гормонов и типов пищевого поведения в развитии метаболического синдрома. Экспериментальная и клиническая гастроэнтерология. 2010; (7): 12–19. [Mishchenkova T.V., Zvenigorodskaya L.A., Varvanina G.G. et al. The role of hormones and types of eating behavior in the development of metabolic syndrome. Eksperimental’naya i klinicheskaya gastroenterologiya = Experimental and Clinical Gastroenterology. 2010; (7): 12–19 (In Russ.)]. EDN: MVAJRZ.
24. Гречка П.С., Белобородова А.В., Гуменюк Л.Н. Взаимосвязь депрессии и сахарного диабета 2 типа. Международный научно-исследовательский журнал. 2020; (7–2): 75–80. [Grechka P.S., Beloborodova A.V., Gumenyuk L.N. The relationship between depression and type 2 diabetes. Mezhdunarodnyy nauchno-issledovatel’skiy zhurnal = International Research Journal. 2020; (7–2): 75–80 (In Russ.)]. https://dx.doi.org/10.23670/IRJ.2020.97.7.048. EDN: ZFSJVB.
25. Сорокина Ю.А., Занозин А.В., Занозина О.В. Сонливость, депрессия и ожирение у пациентов с сахарным диабетом 2-го типа разного пола как мишень для фармакологической коррекции. Медицинский совет. 2020; (7): 79–83. [Sorokina Yu.A., Zanozin A.V., Zanozina O.V. Drowsiness, depression and obesity in patients with type 2 diabetes mellitus of different sex as a target for pharmacological correction. Meditsinskiy sovet = Medical Council. 2020; (7): 79–83 (In Russ.)].https://dx.doi.org/10.21518/2079-701X-2020-7-80-84. EDN: ODEMHX.
26. Старостина Е.Г., Володина М.Н., Старостин И.В., Бобров А.Е. Депрессия и сахарный диабет как коморбидные заболевания. РМЖ. 2017; 25(22): 1613–1620. [Starostina E.G., Volodina M.N., Starostin I.V., Bobrov A.E. Depression and diabetes mellitus as comorbid diseases. Russkiy meditsinskiy zhurnal = Russian Medical Journal. 2017; 25(22): 1613–1620 (In Russ.)]. EDN: YLAYET.
27. Kan C. Genetic overlap between type 2 diabetes and depression in a Sri Lankan population twin sample. Psychosom Med. 2020; 82(2): 247. https://dx.doi.org/10.1097/PSY.0000000000000771.
28. Victoria G.M., Dampil O.A. Prevalence of depression among patients with type 2 diabetes mellitus and its associated clinical factors. J ASEAN Fed Endocr Soc. 2019; 34(2): 197–203. https://dx.doi.org/10.15605/jafes.034.02.11.
29. Egede L.E. Effects of depression on work loss and disability bed days in individuals with diabetes. Diabetes Care. 2004; 27(7): 1751–53. https://dx.doi.org/10.2337/diacare.27.7.1751.
30. Rustad J.K., Musselman D.L., Nemeroff C.B. The relationship of depression and diabetes: Pathophysiological and treatment implications. Psychoneuroendocrinology. 2011; 36(9): 1276–86. https://dx.doi.org/10.1016/j.psyneuen.2011.03.005.
Tatyana P. Demicheva, PhD in Medical Sciences, associate professor of the Department of endocrinology and clinical pharmacology, Academician E.A. Wagner Perm State Medical University of the Ministry of Healthcare of Russia. Address: 614990, Perm, 26 Petropavlovskaya St.
ORCID: https://orcid.org/0000-0002-5422-8700. eLibrary SPIN: 3743-3914




