Антифосфолипидный синдром (АФС) является генетически детерминированной аутоиммунной тромбофилией, характеризующейся развитием артериальных и венозных тромбозов в сосудах любого калибра и акушерской патологии на фоне длительной персистенции аутоантител к фосфолипид-связывающим белкам крови (аФЛ) [1, 2]. Частота выявлений аФЛ в общей популяции составляет 1–5%, однако диагноз АФС может быть установлен только при наличии известных диагностических критериев, последний пересмотр которых состоялся в 2006 г. [3] (табл. 1).

Для постановки диагноза АФС необходимо сочетание как минимум одного клинического и одного лабораторного критерия. Кроме того, учитывая мультифакториальность тромбоза, необходимо указать в диагнозе наличие таких дополнительных факторов риска, как возраст (мужчины – старше 55 лет, женщины – 65 лет), индекс массы тела (ИМТ) более 30 кг/м2, факторы риска сердечно-сосудистых заболеваний, хирургические вмешательства, злокачественные новообразования, длительная иммобилизация, прием комбинированных оральных контрацептивов, нефротический синдром, генетическая тромбофилия.
Следует отметить, что в диагностических критериях учитывается персистенция аФЛ более 12 нед, а также титр ≥40 GPL/MPL, низкопозитивным считается диапазон от 10 до 40 GPL/MPL. В 2014 г. Sciascia S. и Bertolaccini M.L. [4] для улучшения стратификации риска у пациентов с наличием аФЛ была предложена шкала Global APS Score (GAPSS), учитывающая не только наличие определенных типов аФЛ, но и клинических факторов – артериальной гипертензии и дислипидемии (табл. 2).

Риск рецидива тромбоза возрастал в 18 раз при сумме ≥11 баллов (OR 18,27; 95% ДИ 3,74–114,5).
В последующем с учетом сложности определения не критериальных антител к протромбину/фосфатидилсерину в рутинной клинической практике теми же авторами была предложена упрощенная шкала – adjusted GAPSS (аGAPSS), исключающая этот пункт. В настоящее время накапливаются данные об информативности и прогностической значимости этой модификации оценки риска в различных популяциях аФЛ-позитивных пациентов [5].
Цель исследования – оценить силу связи персистенции аФЛ более 12 нед у женщин с исходной бальной оценкой по шкале аGAPSS, фактом «двойной» и «тройной» позитивности при первом определении, а также с наличием тромботических и акушерских осложнений в анамнезе.
МАТЕРИАЛ И МЕТОДЫ
Тип исследования: «случай–контроль». «Случаи» – пациентки с персистенцией антифосфолипидных антител (АФА) ≥12 нед, «контроль» – пациентки с транзиторной циркуляцией АФА менее 12 нед.
Исследуемая популяция: женщины, наблюдавшиеся в городском отделе патологии гемостаза Челябинска в период с 2012 по 2017 г.
Критерии включения: возраст ≥18 лет, женский пол, наличие критериальных АФА в титрах IgG >10 GPL/мл и IgM >10 MPL (норма для данной лаборатории) для аCL и аβ2GPI и/или положительной пробы на волчаночный антикоагулянт (ВА).
Критерии исключения: системные заболевания соединительной ткани, злокачественные новообразования, хронические специфические инфекционные процессы (туберкулез, сифилис), беременность.
Метод выборки: сплошной.
Анализируемые характеристики: возраст, артериальные и венозные тромбозы в анамнезе, структура соматической и акушерско-гинекологической патологии, тип аФЛ, уровень позитивности, наличие «двойной»/«тройной» позитивности, исходная (на момент первого выявления аФЛ) оценка по шкале aGAPSS.
Всем женщинам во время первого визита проводился клинический осмотр со сбором соматического и акушерского анамнеза по специально разработанной форме. Антитела к кардиолипинам IgG/IgM и антитела к β2 гликопротеину 1 IgG/IgM выявлялись методом твердофазного иммуноферментного анализа (ELISA) с использованием коммерческих наборов (Orgentec, Германия). ВА определялся коагуляционным методом (реактивы «Люпус-тест»; «Технология стандарт», Россия). Повторное исследование проводилось как минимум двукратно, с интервалом ≥12 нед. Дислипидемия устанавливалась при наличии как минимум одного критерия: уровень общего холестерина (ОХС) ≥5 ммоль/л, уровень холестерина липопротеинов низкой плотности (ХС ЛНП) ≥3 ммоль/л, уровень триглицеридов (ТГ) >1,7 ммоль/л; уровень холестерина липопротеинов высокой плотности (ХС ЛВП) <1,2 ммоль/л.
Статистическая обработка данных осуществлялась с помощью статистической программы Epi-info (версия 5.16). Данные в тексте после проверки на нормальность распределения и равенство дисперсий представлены в виде средней арифметической и ее среднеквадратичного отклонения (M±SD). Применялись критерии Стьюдента, хи-квадрат Пирсона (χ2) с поправкой Йейтса, Фишера в зависимости от типа данных. Проводился расчет отношения шансов (ОШ) c 95% ДИ. Для всех видов анализа статистически достоверными считались значения p <0,05.
РЕЗУЛЬТАТЫ
В исследование были включены 117 пациенток, средний возраст 30,9±4,8 лет. В группу «Случаи» были отнесены пациентки с персистенцией ≥1 типа аФЛ в течение ≥12 нед (n=44), в группу «Контроль» – с транзиторной циркуляцией аФЛ <12 нед (n=73).
Характеристика клинических проявлений, имеющих возможную связь с наличием аФЛ, в исследуемых группах представлена в таблице 3.
При анализе сопутствующей патологии в группе «Случаи» значимо чаще отмечались тромбозы в анамнезе и нефропатия. В структуре тромбозов в группе «Случаи» отмечались 7 тромбозов глубоких вен (ТГВ), в 2 случаях осложненные тромбоэмболией легочной артерии (ТЭЛА). Кроме того, в этой группе у 3 женщин в анамнезе были цереброваскулярные события: 2 ишемических инсульта и в одном случае тромбоз церебрального венозного синуса на фоне приема комбинированных оральных контрацептивов. В группе «Контроль» встречались только венозные тромбозы: 3 случая ТГВ и варикотромбофлебит. При персистенции АФА ≥12 нед ОШ наличия тромбоза в анамнезе составило 5,1; 95% ДИ 3,3–64,4; р=0,005. Нефропатия была установлена с учетом наличия мочевого синдрома, преимущественно протеинурии, которая в большинстве случаев расценивалась в медицинской документации как латентная форма хронического пиелонефрита. Частота других клинических проявлений также была выше в группе «Случаи» без достижения статистических различий. Дислипидемия тоже чаще встречалась среди женщин со стойкой персистенцией аФЛ: 12 женщин (27%) vs 13 (17,8%) женщин в контроле; р >0,05.
Характеристика акушерского анамнеза представлена в таблице 4.
В группе «Случаи» частота бесплодия с возможными предымплантационными потерями и таких плацента-ассоциированных осложнений, как привычное невынашивание беременности, преэклампсия, плацентарная недостаточность, встречались значительно чаще, чем у женщин в контрольной группе. ОШ иметь привычное невынашивание беременности при стойкой циркуляции аФЛ в сравнении с транзиторной циркуляцией составило 1,5; 95% ДИ 0,6–3,5; р=0,005.
 При анализе лабораторного профиля при первом исследовании на аФЛ для группы «Случаи» установлена более высокая частота встречаемости волчаночного антикоагулянта – 30 пациенток vs 4 пациентки в контроле (ОШ 13,8; 95% ДИ 5,1–38,9; p=0,001). «Двойная» и «тройная» позитивность при первом исследовании на аФЛ была выявлена у половины женщин в группе «Случаи» (22) при отсутствии таковых в группе «Контроль». Только в группе «Случаи» встречались пациентки с титром аCL и/или аβ2GPI ≥40 GPL, MPL (7 из 44 пациенток). В целом число женщин, имеющих названные типы аФЛ в титре≥20 GPL, MPL, более чем в 5 раз превышало этот показатель в контрольной группе (10 человек (22,7%) vs 3 человека (4,1%); p <0,05).
При анализе лабораторного профиля при первом исследовании на аФЛ для группы «Случаи» установлена более высокая частота встречаемости волчаночного антикоагулянта – 30 пациенток vs 4 пациентки в контроле (ОШ 13,8; 95% ДИ 5,1–38,9; p=0,001). «Двойная» и «тройная» позитивность при первом исследовании на аФЛ была выявлена у половины женщин в группе «Случаи» (22) при отсутствии таковых в группе «Контроль». Только в группе «Случаи» встречались пациентки с титром аCL и/или аβ2GPI ≥40 GPL, MPL (7 из 44 пациенток). В целом число женщин, имеющих названные типы аФЛ в титре≥20 GPL, MPL, более чем в 5 раз превышало этот показатель в контрольной группе (10 человек (22,7%) vs 3 человека (4,1%); p <0,05).
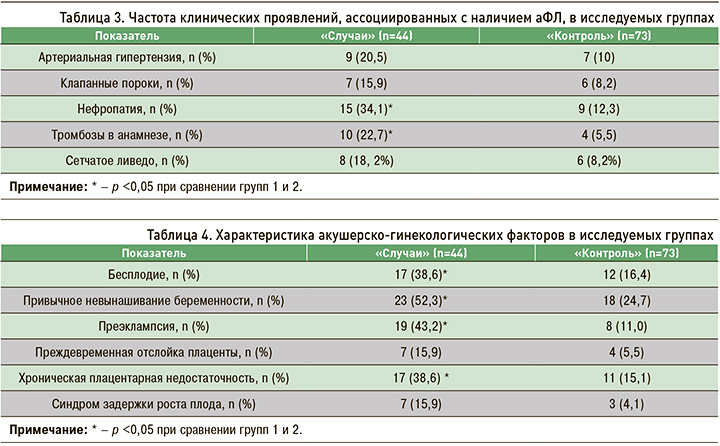
Исходная оценка по шкале aGAPSS в группе «Случаи» оказалась выше и составила 7,3±3,5 баллов, тогда как в группе «Контроль» – 4,8±0,6 баллов, p <0,05 (рис. 1).
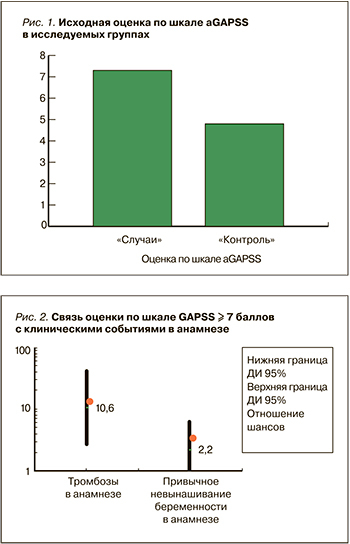
Нами также проведен расчет ОШ для наличия тромбозов и привычного невынашивания беременности в анамнезе при сумме баллов по шкале аGAPSS ≥7 баллов. Данная разделительная точка была взята с учетом точки cut-off 10 баллов для шкалы GAPSS и отсутствия определения антител к протромбину/фосфатидилсерину, наличие которых оценивается в 3 балла по шкале аGAPSS (рис. 2).
При сумме баллов по шкале аGAPSS ≥7 баллов вероятность наличия тромбозов в анамнезе оказалась в 10 раз выше (ОШ 10,6; 95% ДИ 2,8–41,4; p=0,0001), а привычного невынашивания беременности – в 2 раза выше (ОШ 2,2; 95% ДИ 0,8–6,1; p=0,1).
ОБСУЖДЕНИЕ
Заболеваемость АФС составляет около 5 новых случаев на 100 000 в год, распространенность – 40–50 случаев на 100 000 [1, 4]. В то же время с учетом клинических проявлений этой патологии, большая часть из которых является жизнеугрожающими и социально значимыми, их частой реализации в молодом возрасте, изучение данной аутоиммунной тромбофилии – актуальная междисциплинарная проблема. С учетом необходимости активной антитромботической тактики критерии диагноза АФС стали более строгими. Это привело к тому, что только 50% пациентов, имеющих саппоровские критерии, принятые в 1999 г., стали удовлетворять пересмотренным сиднеевским критериям (2006) [1, 4]. Вместе с тем в клинической практике встречаются пациенты с неполным соответствием диагностическим критериям, но уже перенесшие тромботические события или акушерские осложнения. Сложности возникают и при внеплановом наступлении беременности у женщины с аФЛ-позитивностью и отягощенным акушерским анамнезом, в этом случае в течение необходимых 12 нед для подтверждения диагноза может вновь развиться неблагоприятный исход [6].
Установление наиболее значимых связей наличия ВА, комбинаций различных типов аФЛ, их титров и персистенции с тромбозами и акушерскими осложнениями, необходимость ранней стратификации профилактической и лечебной тактики привело к выделению понятия «аФЛ-профиль риска» [7–11]. В соответствии с рекомендациями Европейской лиги ревматологов к компонентам аФЛ-профиля высокого риска относят наличие ВА (при ≥2-кратном определении ISTH стандартизованным коагуляционным методом с интервалом в 12 нед) или «двойную»/»тройную» аФЛ-позитивность (любая комбинация критериальных антител) или длительную персистенцию аФЛ ≥12 нед в диагностических титрах. Наличие только антител к кардиолипинам (аCL) или антител к β2-гликопротеину-1 (аβ2GPI) в низкопозитивных титрах, а также транзиторную их циркуляцию относят к факторам аФЛ-профиля низкого риска. Профиль риска, согласно современным рекомендациям Европейской ревматологической лиги (EULAR, 2019), может играть существенную роль при выборе профилактической и лечебной антитромботической стратегии [12].
В нашем исследовании уже при первом осмотре и сборе анамнеза у женщин с последующей подтвержденной длительной персистенцией аФЛ ≥12 нед в сравнении с их транзиторной циркуляцией установлена более высокая частота венозных и артериальных тромбозов (последние встречались только в группе «Случаи»), нефропатии, характерной для АФС. В этой же группе в анамнезе было значимо больше репродуктивных потерь, включая привычное невынашивание беременности и плацента-ассоциированных осложнений. Клинические проявления при установленной в дальнейшем длительной персистенции соответствовали высокому профилю риска по лабораторным данным уже на первом визите: «двойная» и «тройная» позитивность; наличие волчаночного антикоагулянта, более высокие титры антител к кардиолипинам и β2-гликопротеину 1.
Рутинное исследование других «некритериальных» типов аФЛ (антитела к протромбину, аннексину V, фактору Xa, к домену I, IV и V β2GPI) в настоящее время признано нецелесообразным.
В то же время предпринимаются попытки совершенствования стратификации риска с использованием спектра лабораторных маркеров и включением ряда известных клинических факторов, способствующих развитию тромбозов в артериальном и венозном русле. Примером такой попытки является разработка и внедрение шкалы GAPSS, включающей, помимо лабораторных характеристик, артериальную гипертензию и дислипидемию.
Эта шкала была первоначально валидизирована для больных с наличием аФЛ на фоне системной красной волчанки, а в дальнейшем и для аФЛ-позитивных пациентов без системной патологии. Высокий балл при оценке по данной шкале был ассоциирован не только с наличием перенесенных тромбозов, но и позволял прогнозировать их риск в будущем. Так, при динамическом наблюдении в течение 33±12 мес увеличение суммы по шкале GAPSS на 3 балла ассоциировалось с возрастанием риска тромботических событий в 48 раз (ОШ 48,0; 95% ДИ 6,90–333,85; p=0,0001) [13]. Широкое внедрение шкалы GAPSS затрудняла необходимость определения некритериальных антител к протромбину/фосфатидилсерину IgG/IgM. Информативность упрощенной модели шкалы аGAPSS без данной позиции в настоящее время широко изучается на различных популяциях пациентах [5]. Так, в исследовании Carmo A. et al (2018), включавшем 50 пациентов, из которых 23 удовлетворяли диагностическим критериям АФС, а 27 имели разный уровень позитивности аФЛ, пациенты с наличием одного класса аФЛ имели оценку 7,2±1,2 балла (М ± SD), а с тройной позитивностью – 14,8±1,4 балла; p <0,01. В исследовании Radin M. et al. (2019) по типу «поперечный срез» проводилась оценка по шкале аGAPSS с использованием международной базы данных APS ACTION у пациентов с рецидивирующими тромбозами. В целом суммарный балл был значительно выше у больных с рецидивами артериальных и венозных тромбозов в сравнении с безрецидивным течением (7,8±3,3 vs 6,0±3,9; p <0,05). При этом наиболее высокий балл имели пациенты с повторными артериальными тромбозами. В нашем исследовании у женщин, имеющих отягощенный тромботический и акушерский анамнез, при подтверждении персистенции аФЛ через 12 нед уже при первом визите исходная оценка по шкале aGAPSS составила 7,3±3,5 баллов, тогда как в группе с транзиторной циркуляцией аФЛ – 4,8±0,6 баллов (p <0,05). Следует отметить, что суммарный балл по шкале аGAPSS ≥7 баллов был ассоциирован с более высокой частотой артериальных и венозных тромбозов в анамнезе (ОШ 10,6; 95% ДИ 2,8–41,4; p=0,0001). Шанс иметь привычное невынашивание беременности в анамнезе при оценке ≥7 баллов был в 2,2 раза выше, чем при более низких значениях, но без достижения статистической достоверности.
ЗАКЛЮЧЕНИЕ
Таким образом, при исходном обследовании женщин с подтвержденной в последующем персистенцией АФА ≥12 нед в сравнении с их транзиторной циркуляцией, выявлены:
- более высокая частота артериальных и венозных тромбозов в анамнезе и нефропатии;
- привычного невынашивания беременности и других плацента-ассоциированных акушерских осложнений в анамнезе;
- большая частота встречаемости высокого лабораторного профиля риска («двойная» и «тройная» позитивность; наличие волчаночного антикоагулянта, более высокий титр антител к кардиолипинам и β2-гликопротеину 1);
- более высокая балльная оценка по шкале аGAPSS, четко ассоциированная с тромботическими событиями в анамнезе.
Шкала аGAPSS представляет доступный в клинической практике дополнительный инструмент для уточнения профиля риска у пациентов с циркуляцией аФЛ для выбора адекватной антитромботической тактики. Необходимы дальнейшие проспективные исследования для оценки информативности шкалы и определения точек cut-off для прогнозирования тромбозов и акушерских осложнений.



