ВВЕДЕНИЕ
Новая коронавирусная инфекция (НКИ) COVID-19 чревата не только развитием дыхательной недостаточности вследствие вирусного поражения легких, но и ковид-ассоциированной коагулопатии, характеризующейся как тромботическими, так и геморрагическими событиями [1].
Одним из важных патогенетических компонентов терапии НКИ в соответствии со множеством международных руководств по ведению таких больных является применение антикоагулянтной терапии [2, 3]. Однако авторы рекомендаций в большинстве своем предпочитают использование профилактического режима антитромботической терапии, уточняя, что лечебный режим может быть избран по решению лечащего врача, а также при наличии у пациента сопутствующей или осложняющей течение НКИ патологии, требующей назначения высоких доз антикоагулянтов. Между тем в большинстве согласительных документов нет четких указаний на то, чем руководствоваться лечащему врачу в прочих ситуациях.
В отсутствие надежных научных данных об оптимальной тактике антикоагулянтной терапии у больных COVID-19 при принятии решения в клинике наиболее прагматичным представляется оценка соотношения риска тромботических и геморрагических событий у конкретного пациента [4]. Для этих целей удобно использовать соответствующие шкалы [5, 6].
В то же время встречаются лишь единичные сообщения об информативности традиционных шкал риска тромбозов и кровотечений у больных НКИ при наличии ковид-ассоциированной коагулопатии. Столь же малочисленны и попытки исследователей представить собственные шкалы такого рода. Поиск решения этих задач и стал предметом настоящего исследования.
Цель исследования – оценить предиктивную способность общепринятых шкал прогнозирования тромбозов и кровотечений на когорте больных НКИ COVID-19, госпитализированных в стационар, разработать собственную предиктивную шкалу тромбозов.
МАТЕРИАЛ И МЕТОДЫ
Работа выполнена на базе Центра для лечения пациентов с новой коронавирусной инфекцией (COVID-19) ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. академика И.П. Павлова» Минздрава России: ретроспективно были проанализированы медицинские карты 945 пациентов, госпитализированных в Центр с 1 ноября 2020 г. по 5 марта 2021 г. (табл. 1).
В первую очередь были верифицированы случаи госпитализации, сопровождавшиеся тромботическими и геморрагическими событиями. Далее для определения эффективности прогнозирования развития этих осложнений до их возникновения все обследованные на момент поступления были оценены по общеизвестным шкалам вероятности тромбозов и кровотечения, валидированных на других нозологических группах пациентов.
С целью оценки эффективности прогнозирования тромботических событий были проанализированы следующие шкалы: CHA2DS2VASc [7], WELLS [8], GENEVA [9], PADUA [10], IMPROVEDD [11]. В рамках прогнозирования геморрагических событий анализировались шкалы ATRIA [12], Glasgow-Blatchford Scale [13], HAS-BLED [14], HEMORR2HAGES [15] и ORBIT [16].
Одной из задач работы было создание собственных шкал оценки риска тромботических или геморрагических осложнений у больных НКИ. Для этого дополнительно к клиническим данным, учитывающим сопутствующую патологию, у всех больных были определены следующие лабораторные показатели: клинический анализ крови, коагулограмма (активированное парциальное тромбопластиновое время, протромбиновое время, протромбиновый индекс, международное нормализованное отношение, фибриноген), Д-димер, биохимические параметры (аланинаминотрансфераза, аспартатаминотрасфераза, фракции билирубина, общий белок, калий, натрий, креатинин, мочевина, глюкоза), маркеры воспалительного ответа (С-реактивный белок, ферритин, лактатдегидрогеназа, прокальцитонин). Всем участникам исследования выполнялась компьютерная томография (КТ) органов грудной клетки при поступлении в стационар, а далее при изменении клинической ситуации (усугублении дыхательной недостаточности, подозрении на тромбоэмболию легочной артерии, присоединении бактериального или микотического компонента пневмонии).
Градации степени тяжести НКИ COVID-19 представлены в таблице 2 и соответствуют действовавшим на тот момент временным методическим рекомендациям (ВМР) «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)», версия 9 (26.10.2020) [17].
Распространенность патологического процесса в легких, вызванного инфекцией SARS-CoV-2, оценивалась по данным КТ органов грудной клетки (табл. 3) и также соответствовала действующим на тот момент ВМР.
С учетом значительной вариабельности различных режимов антицитокиновой терапии, включающих применение глюкокортикостероидов, ингибиторов янус-киназы и интерлейкина 6, которые назначаются как по отдельности, так и в комбинациях, для выполнения корреляционного и регрессионного анализа была также использована градация этих режимов терапии (табл. 4).
В качестве антикоагулянтной терапии применялся низкомолекулярный гепарин эноксапарин как минимум в профилактических дозах (0,5 мг/кг 1–2 раза/сут, 43,2% случаев), а при наличии показаний (например, фибрилляции предсердий или тромбоэмболии легочной артерии давностью до 3 мес) и у больных тяжелого течения – в лечебных дозах (1 мг/кг/сут подкожно 2 раза/сут, 56,8%).
Для статистических расчетов использовалась программа StatPlus Pro Build 7.6.1.0. При оценке диагностических возможностей той или иной шкалы использовали ROC-анализ. Поскольку выборки носили несбалансированный характер, для оценки чувствительности и специфичности был применен метод Precision-Recall с дальнейшим сравнением площади под кривой (AUC) каждой шкалы.
С целью разработки собственной шкалы оценки риска развития тромботических событий при НКИ COVID-19 был выполнен корреляционный анализ по Кендаллу с верификацией наиболее значимых параметров, ассоциированных с прогнозируемым событием. Далее на их основе методом множественной регрессии в варианте best subsets была сформирована формула расчета прогностической шкалы тромбозов при НКИ COVID-19. Как и в случае других шкал, ее диагностическая точность была рассчитана методами ROC-анализа и Precision-Recall.
РЕЗУЛЬТАТЫ
У 945 больных, получавших лечение по поводу НКИ COVID-19 в стенах ФГБОУ ВО «ПСПбГМУ им. И.П. Павлова» Минздрава России, было выявлено 27 тромботических и 44 геморрагических события. Их распределение отображено на рисунках 1 и 2. Важно отметить, что все эти события встречались исключительно у пациентов с тяжелым течением инфекции, при этом все больные получали антикоагулянтную терапию как минимум в профилактической дозе.
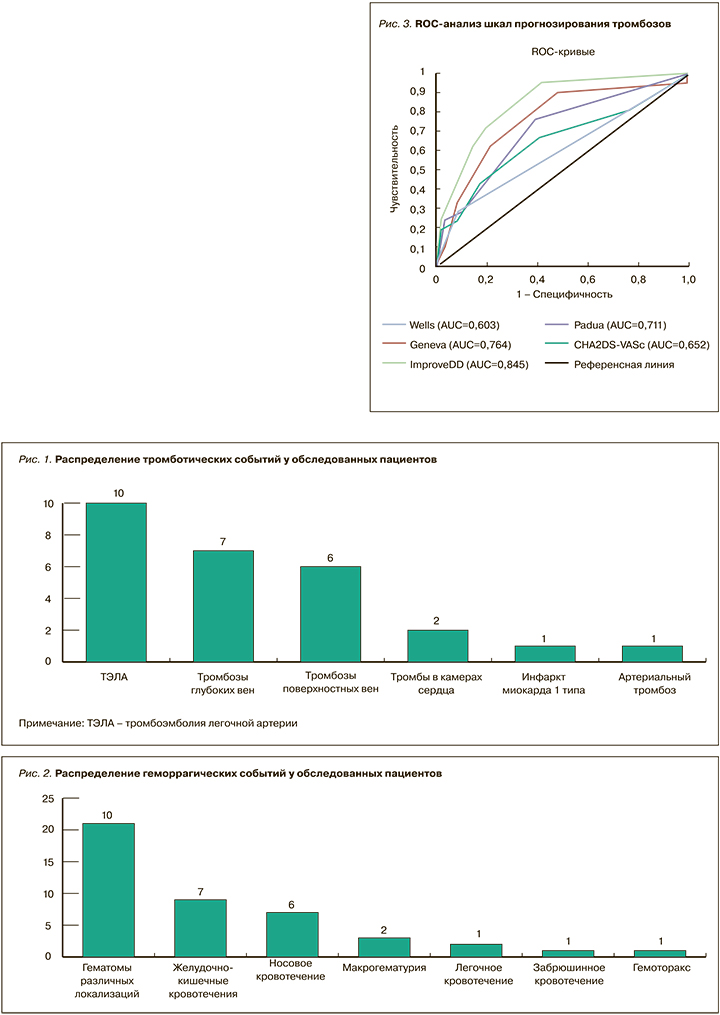
По итогам анализа точности и полноты прогнозирования тромбозов у больных с НКИ COVID- 19 (табл. 5, рис. 3) наиболее предпочтительной выглядела шкала IMPROVEDD (AUC 0,83), в то время как шкала WELLS представлялась наименее точной (AUC 0,65).
Это подтвердилось при попарном сравнении эффективности шкал, где преимущество IMPROVEDD перед другими шкалами в прогнозировании тромботических событий у больных НКИ COVID-19 оказалось статистически значимым (табл. 6).
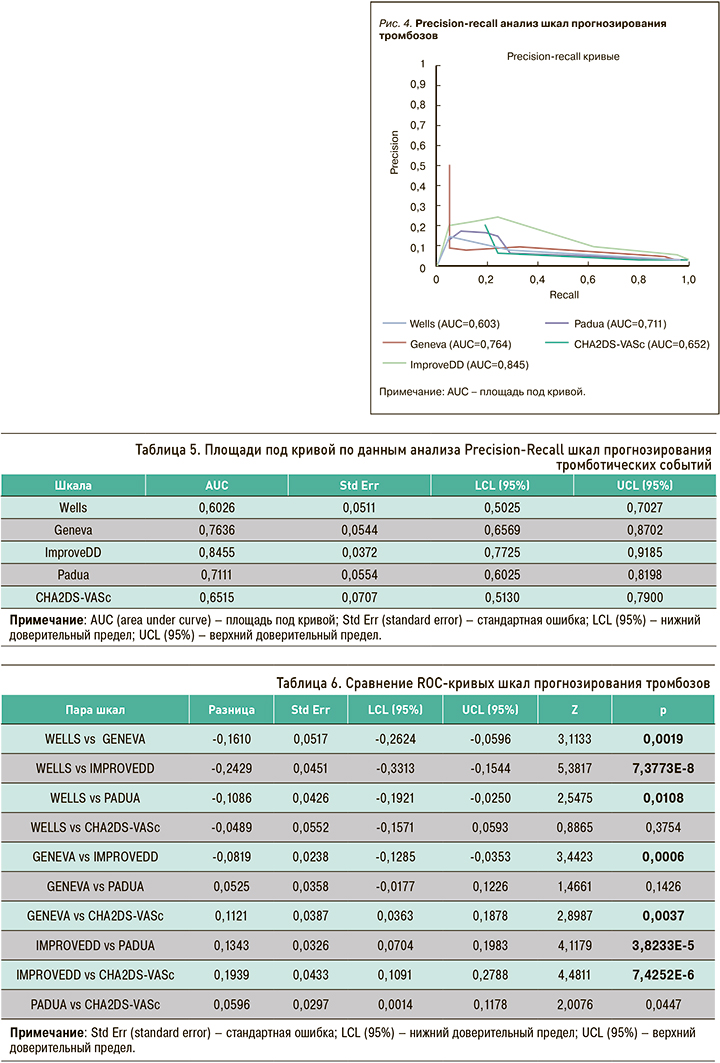
С учетом несбалансированного характера выборки (24 пациента с тромбозами среди 945 обследованных), кроме ROC-анализа, был применен анализ точности и полноты (Precision-Recall), также подтвердивший преимущество шкалы IMPROVEDD (рис. 4).
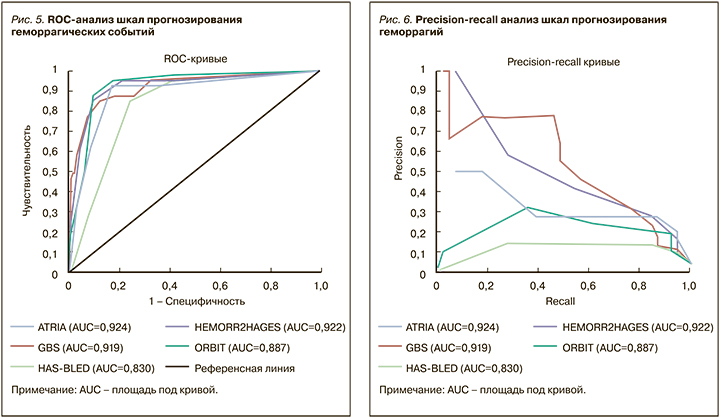
Данные оценки диагностической точности различных шкал прогнозирования геморрагических событий у больных с НКИ COVID-19 представлены в таблице 7 и на рисунке 5.

Следует отметить высокую надежность всех шкал кровоточивости. Однако наибольшая площадь под кривой (AUC) была выявлена у шкалы ATRIA (0,92), которую в стандартной практике используют для оценки риска возникновения кровотечений на фоне антитромботической терапии у больных с фибрилляцией предсердий. Чуть меньшие значения получены у шкал GBS и HEMORR2HAGES (0,91 и 0,92 соответственно). Преимущества этих шкал прогнозирования геморрагий, по сравнению с HAS-BLED и ORBIT, также подтвердились при попарном сравнении (табл. 8).
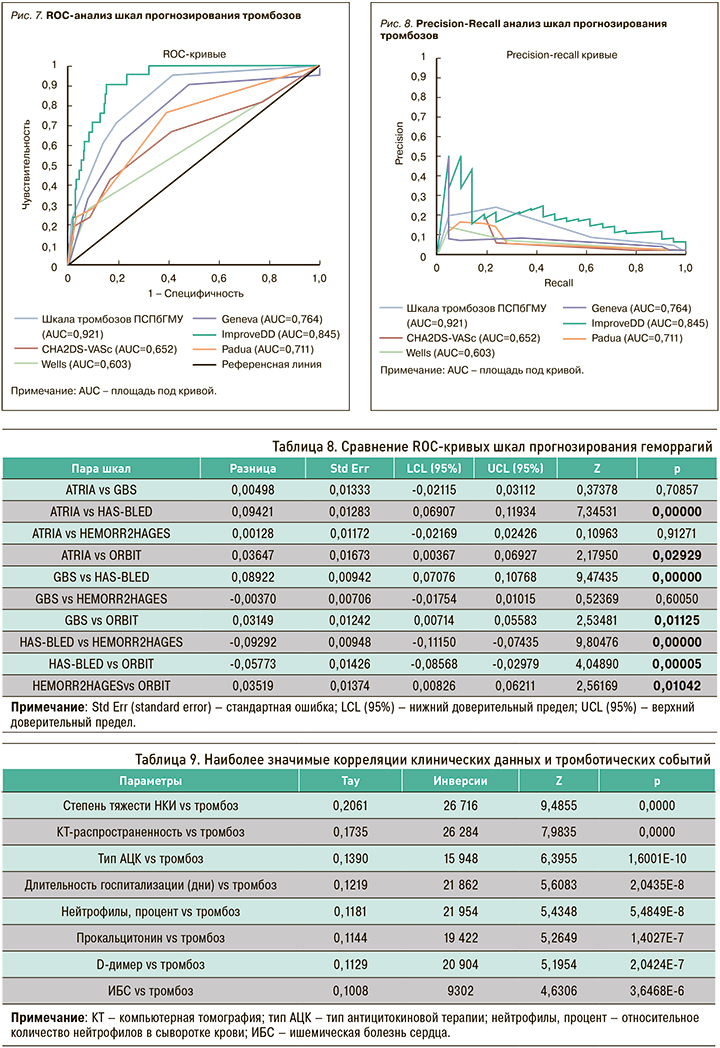
Аналогично выборке обследованных больных с тромбозами, выборка больных с кровотечениями имела несбалансированный характер, из-за чего, помимо ROC-анализа, был выполнен анализ полноты и точности (Precision-Recall), по итогам которого наибольшее соотношение полноты и точности показали шкалы ATRIA и GBS (рис. 6).
Ввиду отсутствия эффективной шкалы прогнозирования тромботических событий у больных с НКИ COVID-19 была предпринята попытка разработки подобной шкалы на собственной выборке.
При расчете рангового коэффициента корреляции Кендалла были выявлены наиболее значимые параметры, ассоциированные с тромботическими событиями (табл. 9).
С помощью метода множественной логистической регрессии наилучших подмножеств были оценены параметры с коэффициентом корреляции Кендалла более 0,1 и менее -0,1 (табл. 10).
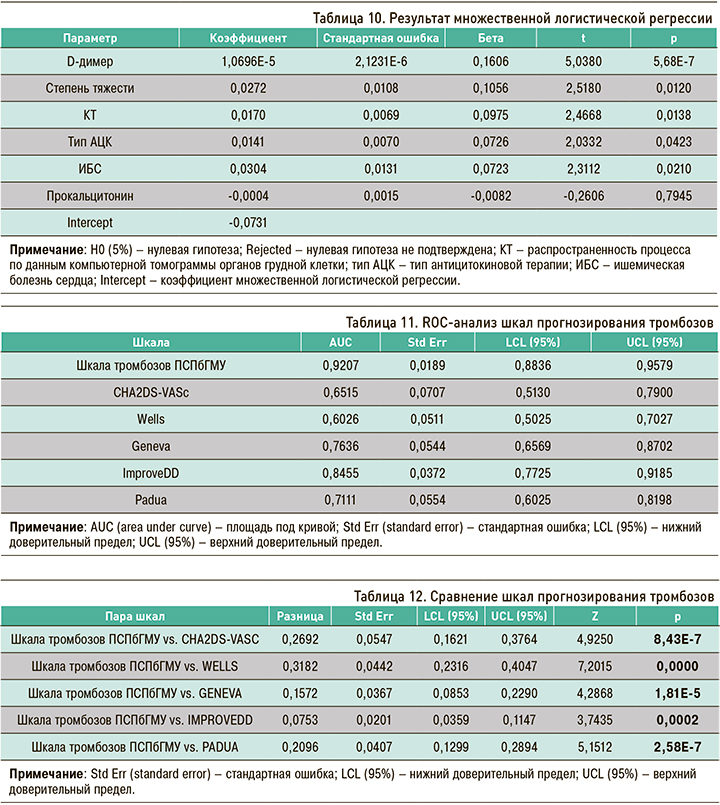
Полученные регрессионные коэффициенты были использованы в формуле для подсчета баллов по разработанной нами шкале прогнозирования тромбозов ПСПбГМУ. Далее было выполнено сравнение разработанной шкалы тромбозов с общеизвестными шкалами. Как видно из таблицы 11, а также из рисунков 7 и 8, площадь под кривой (AUC) у предложенной нами шкалы больше по сравнению с остальными (0,92).
При попарном сравнении шкал преимущество разработанной шкалы подтверждено статистически (табл. 12).
ОБСУЖДЕНИЕ
Осознание того, что тяжелое течение НКИ COVID-19 сопровождается специфической коагулопатией и тромботическими осложнениями, стало причиной для широкого эмпирического назначения антикоагулянтов при этом заболевании. Между тем отсутствие данных рандомизированных клинических исследований в самом начале пандемии НКИ COVID-19, а также специально разработанных шкал прогнозирования тех или иных событий делало назначение антикоагулянтной терапии вопросом факультативным как в смысле оснований для применения, так и в плане режима дозирования.
Представляется очевидным, что наибольшую пользу от антикоагулянтной терапии получат лица с наиболее высоким риском тромбоза и наименьшим риском кровотечений. С этих позиций приобретают смысл попытки исследовать эффективность общепринятых предиктивных шкал тромботических и геморрагических событий, а также создание новых, если первые недостаточно хороши у больных с НКИ COVID-19.
Так, Rindi L.V. et al. (2022) провели метаанализ результатов исследований, в которых была проанализирована диагностическая точность пяти общепринятых шкал прогнозирования легочной эмболии (WELLS, GENEVA, CHADS2/CHA2DS2VASc/M-CHA2DS2VASc, CHOD, PADUA) у госпитализированных больных с НКИ COVID-19 [18]. Наименьшей максимальной AUC (0,54) обладала шкала WELLS, что очень близко к результатам, полученным в нашей выборке пациентов (AUC=0,57). AUC шкалы GENEVA составила 0,72 по итогам метаанализа, а по нашим расчетам – 0,74; в свою очередь, AUC для шкалы CHA2DS2-VASc составила 0,54 против 0,65 в нашей выборке обследуемых. Характерно, что предиктивная способность CHA2DS2-VASc оказалась одной из худших как по данным метаанализа, так и по результатам собственных исследований. Впрочем, не следует забывать, что эта шкала была разработана для артериальных эмболий при фибрилляции предсердий, а не для венозных эмболий, которые преобладали в структуре тромботических событий у больных НКИ COVID-19.
Mestre Gomez B. et al. (2021) предприняли попытку прогнозирования развития тромбоэмболии легочной артерии у больных с НКИ при помощи уточнения так называемого cut-off value для Д-димера в сочетании с наличием в анамнезе у пациента указаний на дислипидемию, поскольку авторами были выявлены протективные свойства этого состояния в отношении развития легочной эмболии [19]. Созданная ими модель прогноза, учитывающая повышение уровня Д-димера выше 5000 мг/дл, при проведении ROC-анализа имела AUC 0,75, что определяется как умеренная предсказательная точность.
Другая шкала, предполагающая использование величины Д-димера для прогноза венозных эмболий – IMPROVEDD, по нашим данным, обладала наибольшей среди всех исследованных предиктивной способностью (AUC 0,83), которую, впрочем, также следует рассматривать как умеренную.
В 2021 г. Garcia Ortega A. et al. опубликовали специально разработанную для прогнозирования легочной эмболии при НКИ COVID-19 шкалу CHOD, созданную на основе логистической регрессии и включившую такие параметры, как уровень С-реактивного белка, частоту сердечных сокращений, уровень сатурации при дыхании атмосферным кислородом и уровень Д-димера [20]. Значение AUC по данным ROC-анализа этой модели составило 0,86, что, впрочем, не слишком превосходит значение, полученное нами для IMPROVEDD (0,83).
Таким образом, известные нам существующие и недавно разработанные шкалы прогнозирования тромботических событий обладают умеренной предсказательной силой по отношению к пациентам с НКИ COVID-19. Следовательно, проблема остается актуальной и требует своего более эффективного решения в будущем.
В настоящей статье предложена собственная шкала прогнозирования тромботических событий, разработанная специально для больных с НКИ COVID- 19. Она включила такие параметры, как уровень Д-димера, прокальцитонина, оценку степени тяжести заболевания, оценку распространенности специфических изменений в легких по данным КТ органов грудной клетки, наличие ишемической болезни сердца в анамнезе, а также режим назначенной антицитокиновой терапии во время госпитализации.
Как и в случае тромботических состояний неинфекционного генеза, уровень Д-димера имеет высокую чувствительность (67–100%), но вариабельную специфичность (29–89%) при прогнозировании тромботических событий при НКИ COVID-19 [21]. В то же время высокие уровни этого биомаркера ассоциированы с более тяжелым течением инфекции и повышением летальности.
Уровень прокальцитонина, используемый в обычной практике как биомаркер септического процесса, позволяющий в том числе оценить эффективность проводимой антимикробной терапии, является важным инструментом в диагностике и лечении больных с НКИ COVID-19, в первую очередь с точки зрения прогноза вероятности развития критического состояния и соответственно перевода в ОРИТ и летального исхода [22]. Высокие уровни прокальцитонина характерны для НКИ с более выраженным воспалительным процессом, а значит, и более значимой эндотелиальной дисфункцией, в свою очередь, ведущей к развитию тромботических состояний [23].
Закономерно, что клиническая степень тяжести течения инфекционного процесса, вызванного SARS-CoV-2, а также распространенность специфичных для инфекции изменений в легких по данным КТ органов грудной клетки положительно коррелирует с развитием тромботических событий. Так, по данным метаанализа Roncon L. et al. (2020), тромбоэмболии легочной артерии чаще встречались у пациентов, госпитализированных в ОРИТ, что соответствует описанным выше данным [24].
Ишемическая болезнь сердца, возникающая вследствие атеросклероза коронарных сосудов, в свою очередь, также относится к нозологиям, тесно связанным с эндотелиальной дисфункцией [25]. Инфицирование вирусом SARS-CoV-2 через рецепторы АПФ 2 на эндотелиальных клетках приводит к ухудшению течения уже имеющейся атеросклеротической болезни сосудов, в том числе коронарных, и формированию еще более серьезного протромботического состояния.
Найденная положительная корреляционная связь между применением антицитокиновой терапии и тромбозами при НКИ может быть обусловлена двумя факторами. В первую очередь следует учитывать, что такое лечение получала когорта наиболее тяжелых больных, а, как было показано ранее, тромботические события возникали именно у пациентов с тяжелыми формами НКИ COVID- 19. Во-вторых, в литературе встречаются описания побочных эффектов от использования ингибиторов интерлейкина 6 в виде развития эмболий и тромбозов различных локализаций, а протромботический потенциал глюкокортикостероидов широко известен [26–28].
Таким образом, факторы, предложенные в предиктивной модели тромбозов, представляются закономерными и важными с позиций сегодняшних представлений о патогенезе COVID-19, а инструмент прогнозирования на их основе достаточно точным и полным. Между тем наша шкала была разработана на основе ретроспективного анализа данных в несбалансированной выборке больных, что диктует необходимость ее валидации на более широкой когорте пациентов с учетом вариации штаммов вируса SARS-CoV-2.
Проблема предсказания геморрагических событий у больных НКИ COVID-19, по нашим данным, представляется менее острой. Общеизвестные шкалы риска кровотечений, разработанные на других когортах пациентов (ATRIA и HEMORR2HAGES при фибрилляции предсердий, GBS при желудочно-кишечных кровотечениях), обладают высокой информативностью и у больных с НКИ. Среди лучших – ATRIA и GBS. Нам встретились лишь единичные работы по этой проблеме. Так, Aciksari G. et al. была предпринята попытка оценить эффективность модифицированной шкалы ATRIA, но не для прогноза геморрагических осложнений, а для оценки летальности 29]. В рамках такой задачи AUC модифицированной шкалы ATRIA при ROC-анализе составила лишь 0,74.
ЗАКЛЮЧЕНИЕ
Известные шкалы прогнозирования тромботических событий (WELLS, GENEVA, CHA2DS2-VASc, PADUA, IMPROVEDD) имеют недостаточную предиктивную точность у больных НКИ COVID-19, что делает актуальной задачу разработки специальной шкалы тромбозов. Среди вышеприведенных шкал наибольшей AUC при анализе полноты и точности обладает шкала IMROVEDD. Предложенная нами шкала тромбозов превосходит ее по этим характеристикам, однако требует проспективной валидации на широкой выборке госпитализированных пациентов с НКИ COVID-19.
Общепринятые шкалы прогнозирования геморрагических событий показали высокую эффективность у нашей когорты пациентов, при этом наиболее полезными представляются шкалы ATRIA и GBS.



