ВВЕДЕНИЕ
Пандемия коронавирусной болезни 2019 г. (COVID-19) обрушилась на мир более чем 4 млрд случаев заболевания и почти 6 млн смертей (по состоянию на 1 апреля 2022 г.) [1]. Возбудитель COVID-19, SARS-CoV-2, является высококонтагиозным вирусом, вызывающим значительную заболеваемость и смертность. Исходы после заражения COVID-19 значительно различаются, но пожилой возраст, мужской пол, ранее существовавшие сопутствующие заболевания, иммунологические нарушения и иммуносупрессия выступают постоянными факторами риска, связанными с неблагоприятным прогнозом [2, 3].
Лица с сопутствующими аутоиммунными заболеваниями считаются крайне уязвимыми перед этой инфекцией, поскольку иммунный ответ является важной детерминантой вирусных инфекций, включая COVID-19, не только в противовирусной защите, но также в прогрессировании и тяжести клинических проявлениях заболевания. У пациентов с системной красной волчанкой (СКВ) аберрантный иммунный ответ характеризуется наличием циркулирующих аутоантител, лимфопенией, нарушением функционирования Т-клеток и гиперпродукцией провоспалительных цитокинов, наряду с дефектными регуляторными механизмами, приводящими к иммуноопосредованному повреждению тканей. Провоспалительные цитокины, выступающие ключевыми медиаторами поздней фазы гипервоспаления, индуцируются чрезмерной активацией врожденного иммунитета из-за задержки или нарушения раннего иммунного ответа.
Система комплемента является звеном врожденного иммунного ответа, реактивный каскад продуктов расщепления которого может координировать воспалительный антимикробный ответ в очагах инфекции. Однако активация комплемента также связана с чрезмерной воспалительной реакцией, наблюдаемой у пациентов с тяжелой формой COVID-19, и наличием синдрома микрососудистого повреждения, опосредованного комплементом. Исходная гипокомплементемия – классический признак СКВ и маркер активности заболевания – рассматривается как фактор риска тяжелого течения COVID-19. При СКВ аутоантитела, продуцируемые В-лимфоцитами, и аберрантные провоспалительные реакции Т-клеток вызывают воспаление и повреждение тканей, обусловливая полиморфную клиническую картину заболевания [3–8].
Окислительный стресс, провоцируемый вирусными инфекциями, усугубляет дефект метилирования ДНК при волчанке, что может привести к дальнейшему снижению метилирования и сверхэкспрессии АПФ 2 (функционального рецептора для спайкового гликопротеина SARS-CoV-2) и усилению виремии. Кроме того, деметилирование генов, регулируемых интерфероном, NFkB и ключевых генов цитокинов у пациентов с СКВ может усилить иммунный ответ на SARS-CoV-2 и увеличить вероятность «цитокинового шторма». Эти аргументы предполагают, что врожденная эпигенетическая дисрегуляция при волчанке может способствовать проникновению вируса, виремии и чрезмерному иммунному ответу на SARS-CoV-2. Кроме того, поддержание ремиссии заболевания у пациентов с СКВ имеет решающее значение для предотвращения порочного круга деметилирования и усиления окислительного стресса, усугубляющих восприимчивость к инфекции SARS-CoV-2 во время текущей пандемии. Эпигенетический контроль гена АПФ 2 может быть мишенью для профилактики и терапии COVID-19 [9].
СКВ является прототипом аутоиммунных заболеваний с широким спектром тяжести и поражения органов [10, 11]. Заражение COVID-19 может спровоцировать появление или обострение СКВ, притом что некоторые клинические диагностические критерии этого аутоиммунного заболевания совпадают с симптомами новой коронавирусной инфекции, имеют много общих катастрофических исходов, включая повреждение легких, почек, сердечно-сосудистой, нервной систем, которые сопровождаются более тяжелыми клиническими состояниями при конкурирующем течении [12–17].
Патология органов дыхания при СКВ, как правило, проявляется плевритом. Значительно реже возникает интерстициальное поражение легких в форме острого волчаночного пневмонита (2–8%), рентгенологически определяемого в виде двусторонних, реже односторонних инфильтративных изменений в легких, диффузного уплотнения легочной ткани по типу «матового стекла», диффузных альвеолярных геморрагий (1–5%). При длительном течении заболевания в легких обнаруживаются бронхоэктазы, утолщения бронхиальной стенки и плевры. Осложнения СКВ, такие как острый волчаночный пневмонит, трудно отличить от тяжелых случаев поражения легких при COVID-19 из-за их клинического сходства. Интерстициальное и паренхиматозное повреждение легких и повреждение почек характерно не только для пациентов с СКВ, но и для новой коронавирусной инфекции, что значительно усложняет процесс дифференциальной диагностики между клиническими проявлениями СКВ и зачастую фатального инфекционного процесса COVID-19 [11, 18–20].
Существует тесная взаимосвязь между повышенной восприимчивостью к инфекциям, являющимся потенциальными триггерами вспышки болезни, и смертностью пациентов с СКВ [21, 22]. С появлением COVID-19 возникла ощутимая обеспокоенность по поводу риска тяжелого течения инфекции и развития постинфекционных последствий у пациентов с СКВ, вторичных по отношению к основной иммунной дисрегуляции. Наряду с частым использованием иммуносупрессивных препаратов, истощающих В-клетки, это может приводить к дальнейшему подавлению иммунитета и создавать предпосылки к более высокому риску заражения, более тяжелым осложнениям и худшим исходам COVID-19 [23, 24]. В нескольких исследованиях была выдвинута гипотеза о том, что пациенты с СКВ подвергаются более высокому риску преждевременной смерти и заболеваемости от инфекционных заболеваний; таким образом, можно предположить, что новая коронавирусная инфекция также вызовет серьезные осложнения у этих людей. Некоторые когортные исследования не показали увеличения риска заражения SARS-CoV-2 при СКВ [23, 25, 26], другие небольшие тематические исследования, проведенные в основном на ранней стадии пандемии, напротив, свидетельствуют о повышенном риске заболевания COVID-19 у этой группы пациентов [27–29].
В 2022 г. Mehta P. et al. [30] опубликовали систематический обзор 198 исследований, в которых продемонстрировано, что показатели тяжелой формы COVID-19 и связанных с ней смертей были неодинаковыми из-за разных сроков набора пациентов, дизайна исследований и распространенности новой коронавирусной инфекции в разных странах. Согласно отчету GRA (Глобального ревматологического альянса), тяжелое течение заболевания (13,5%) и смертность (6,5%) среди больных СКВ оказались выше, чем среди населения в целом, и были связаны с более старшим возрастом пациентов с СКВ, мужским полом, отсутствием текущего лечения, сопутствующими заболеваниями (заболевание почек – относительный риск (ОР) 3,51, 95% доверительный интервал (ДИ) 2,42–5,09; сердечно-сосудистые заболевания/артериальная гипертензия – ОР 1,69, 95% ДИ 1,25–2,29) и умеренной или высокой активностью СКВ [31].
СКВ – хроническое неизлечимое заболевание, требующее постоянного контроля активности болезни с целью адекватного применения иммуносупрессивной патогенетической терапии, соблюдения равновесия достаточности и минимизации инфекционных осложнений. Существуют недавние исследования, посвященные влиянию COVID-19 на СКВ, а также различным аспектам лечения и вакцинации пациентов с этим аутоиммунным заболеванием [32, 33].
Ниже представлено клиническое наблюдение, демонстрирующее сочетание двух смертельно опасных заболеваний, – СКВ высокой степени активности и коронавирусной инфекции с развитием тяжелых осложнений в виде геморрагического пульмонита, двусторонней полисегментарной пневмонии (КТ-паттерн 3–4 стадии) и острой дыхательной недостаточности, потребовавших проведения искусственной вентиляции легких (ИВЛ), противовирусной и патогенетической терапии COVID-19, включая использование системных глюкокортикоидов, лечения вторичной бактериальной, грибковой и цитомегаловирусной инфекции, а также проведения заместительной почечной терапии и сеансов высокообъемного плазмообмена в связи с острым повреждением почек.
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
В начале сентября 2021 г. пациентка Н., 33 лет, была госпитализирована в стационар во время пандемии COVID-19 по поводу сухого кашля, одышки, субфебрильной температуры тела, которые появились в конце августа того года. Тест с обратной транскриптазой и полимеразной цепной реакцией (ПЦР) на образце мазка из носоглотки оказался положительным на SARS-CoV-2.
Данные анамнеза: в 14-летнем возрасте в НИИ ревматологии им. В.А. Насоновой пациентке был установлен диагноз СКВ с преимущественным поражением суставов. Назначена базисная иммуносупрессивная терапия метилпреднизолоном в дозе 4 мг/сут внутрь в комбинации с гидроксихлорохином 200 мг/сут. По достижении совершеннолетия пациентка наблюдалась у ревматолога нерегулярно, но продолжала принимать назначенную ей ранее терапию, дозу метилпреднизолона самостоятельно кратковременно увеличивала до 8 мг/сут при появлении артралгий и сыпи. Контроль серологических маркеров заболевания регулярно не проводила. В августе 2021 г. у нее появились и стали нарастать отеки голеней и стоп, которые постепенно увеличивались и приняли характер анасарки.
При лабораторном исследовании были выявлены протеинурия нефротического уровня до 10 г/сут в сочетании с гипопротеинемией (общий белок – 51 г/л) и гипоальбуминемией (25,0 г/л), активный «мочевой осадок» (микрогематурия до 370 кл в мкр/л), а также повышение уровня креатинина в сыворотке крови максимально до 364 мкмоль/л и мочевины до 17 ммоль/л. Кроме того, была зафиксирована анемия легкой степени тяжести (гемоглобин – 96 г/л), повышение уровня С-реактивного белка (СРБ) до 81 г/л, снижение компонентов комплемента С3 до 34 мг/дл и С4 до 8 мг/дл.
При инструментальном обследовании были обнаружены признаки полисерозита и анасарки: наличие жидкости в перикарде до 300 мл, брюшной и грудной полостях (в левой плевральной полости – 300 мл, в правой – 250 мл). Индекс активности SELENA SLEDAI составил 25, что соответствует высокой степени активности СКВ.
Пациентке была продолжена патогенетическая терапия СКВ метилпреднизолоном в дозе 8 мг/ сут внутрь и гидроксихлорохином 200 мг/сут. Проводилась диуретическая терапия (фуросемид 80 мг внутривенно, альбумин 100 мл внутривенно) без эффекта.
На третьи сутки госпитализации в связи с фебрильной лихорадкой до 38,8 °С была выполнена мультиспиральная компьютерная томография (МСКТ) органов грудной клетки, по результатам которой выявлена двусторонняя полисегментарная инфильтрация в легких (рис. 1) с высокой степенью вероятности вирусного генеза. Наличие геморрагического компонента не позволяло исключить геморрагический волчаночный пневмонит.
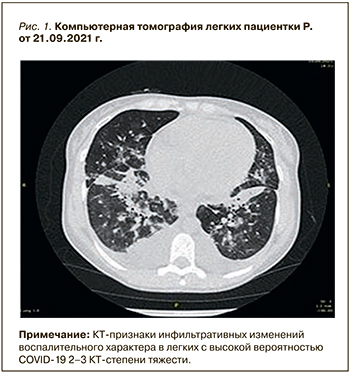
В связи с нарастанием острой дыхательной недостаточности (ОДН) и почечной недостаточности пациентка была переведена в нефрореанимационное отделение ГКБ № 52, работающего как ковидный госпиталь. В отделении реанимации зафиксирована отрицательная динамика со стороны лабораторных показателей: нарастание суточной протеинурии с 10 до 15 г, прогрессирование гипопротеинемии с 51 до 45 г/л, гипоальбуминемии с 25 до 21 г/л при сохранении прежних значений уровня креатинина в сыворотке (355 мкмоль/л). Обращала на себя внимание выраженность синдрома системной воспалительной реакции: фебрильная лихорадка до 39,0 °С; СРБ – 101 мг/л; прокальцитонин (ПКТ) – 3,8 нг/ мл; ферритин – 1159 мкг/л; фибриноген – 7,17 г/л; повышение лактатдегидрогеназы (ЛДГ) до 488 ед/л. Эти показатели отражали прогрессирующее легочное повреждение.
По данным серологических исследований, была зарегистрирована высокая иммунологическая активность аутоиммунного процесса: гиперпродукция антител к нативной ДНК – 438 МЕ/л (норма до 100 МЕ/л), положительный АНФ – 2 ед. опт. пл., С3 компонент комплемента – 30 мг/ дл (норма >90 мг/дл), С4 компонент комплемента – 9 мг/дл (норма от 10 мг/дл). Такая картина свидетельствовала о высокой активности СКВ.
При ультразвуковом исследовании (УЗИ) почек и органов брюшной полости были выявлены отек паренхимы почек, паранефральной клетчатки, отек паренхимы печени, стенок желчного пузыря, диффузные изменения поджелудочной железы, свободная жидкость в брюшной полости, полости малого таза, в плевральных полостях до 56 мм, умеренно выраженные признаки пареза кишечника.
Таким образом, тяжесть легочного процесса у пациентки была обусловлена тяжелой вирусной пневмонией, вызванной SARS-CoV-2 в сочетании с волчаночным геморрагическим пневмонитом, а также повышением уровня ПКТ. Не исключался бактериальный компонент легочного повреждения. В связи с этим выбранная стратегия ведения пациентки включала не только стандартную противовирусную и патогенетическую терапию против COVID-19 (ремдесевир и ковидглобулин, левилимаб), но и активную иммуносупрессивную терапию СКВ в виде эскалации дозы преднизолона до 40 мг/сут внутрь, пульс-терапию метилпреднизолоном 500 мг № 3, антибактериальную терапию (пиперациллин/тазобактам 4,5 г 3 раза/ сут, моксифлоксацин 400 мг/сут).
В связи с острой дыхательной недостаточностью на фоне массивного легочного процесса была начата высокопоточная оксигенация увлажнителем со встроенным генератором потока Fisher & Paykel AIRVO™ с потоком 60 л/мин, FiO2 86%. Из-за нарастания показателей азотемии, недостаточной эффективности консервативной диуретической терапии в отношении отечного синдрома, снижения темпа диуреза была инициирована заместительная почечная терапия с раздельной ультрафильтрацией и линейным введением 10% раствора альбумина 200 мл на фоне выраженной гипоальбуминемии. С учетом тяжести поражения легких, картины «цитокинового шторма», проявлявшегося в нарастании уровня СРБ до 160 мг/л, ферритина до 1450 мкг/л, лихорадкой, недостаточным эффектом анти-рИЛ-6 терапии и крайне высокой иммунологической активности СКВ, было принято коллегиальное решение о выполнении по жизненным показаниям процедур высокообъемного плазмообмена с объемом замещения 2,8 л свежезамороженной плазмы (СЗП) на аппарате Plasauto Sigma с внутривенным введением метилпреднизолона в дозировке 125 мг до и после процедуры и последующей цитостатической терапией циклофосфаном в дозировке 400 мг (внутривенно). В качестве антикоагулянтной терапии была выбрана стратегия продленного введения нефракционированного гепарина с поддержанием уровня активированного частичного тромбопластинового времени (АЧТВ) 40–60 с. С целью коррекции гемической гипоксемии пациентке неоднократно проводились гемотрансфузии эритроцитарной взвеси.
На пятые сутки нахождения в ОРИТ по данным МСКТ органов грудной клетки было отмечено увеличение размеров очагов уплотнения легочной ткани по типу «матового стекла», появление новых аналогичных очагов, увеличение размеров консолидации в верхних долях легких (рис. 2).
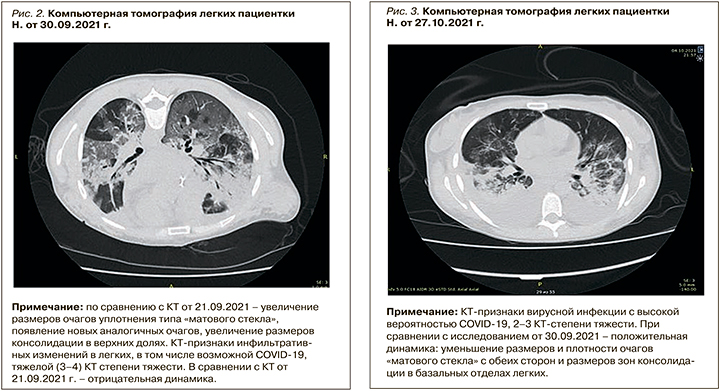
Клинически отмечалась прогрессия дыхательной недостаточности, в связи с чем, постепенно эскалируя дыхательную поддержку путем высокопоточной оксигенации и неинвазивной масочной вентиляции, пациентке выполнили интубацию трахеи с переводом на ИВЛ. На фоне проведения ИВЛ продолжались сеансы плазмообмена с объемом замещения СЗП в дозе 2,0–2,5 л, на третьи сутки инвазивной вентиляции при сохраняющейся активности воспаления была скорректирована антибактериальная терапия с учетом возможных возбудителей. Назначены биопенем, линезолид, продолжена терапия метилпреднизолоном в дозе 24 мг/сут, вено-венозная гемофильтрация с ультрафильтрацией и поддержкой отрицательного водного баланса, что достигалось линейным введением альбумина на фоне выраженной гипоальбуминемии.
Таким образом, суммарно пациентке было введено 800 мг циклофосфамида, 486 мг в/в левилимаба, проведено 7 сеансов высокообъемного плазмообмена с замещением СЗП 2,5–3,0 л. На фоне массивной антимикробной терапии, интенсификации патогенетического лечения была отмечена положительная динамика в виде улучшения дыхательной функции. Вследствие этого пациентка была успешно экстубирована и переведена на инсуфляцию увлажненного кислорода через лицевую маску.
С целью коррекции вторичного иммунодефицита был проведен курс терапии неспецифическим человеческим иммуноглобуллином в суммарной дозе 30 г в виде линейной инфузии. Патогенетическая терапия метилпреднизолоном продолжалась в дозе 24 мг/сут внутрь, выполнялись ежедневные сеансы гемодиализа, активная антигипертензивная терапия с учетом стойкой артериальной гипертензии. В дальнейшем была достигнута положительная динамика по маркерам системного воспалительного ответа. По данным МСКТ органов грудной клетки, было зафиксировано уменьшение размеров и плотности очагов «матового стекла» с обеих сторон и размеров зон консолидации в базальных отделах легких (рис. 3).
После стабилизации состояния для дальнейшего лечения пациентка была переведена в нефрологическое отделение. На момент перевода пациентка уже не нуждалась в кислородной поддержке. По данным МСКТ органов грудной клетки, в динамике сохранялись признаки вирусной инфекции КТ-2 степени тяжести со значительной положительной динамикой в виде уменьшения очагов «матового стекла», уменьшения в размерах консолидатов в легочной ткани (рис. 4, 5).
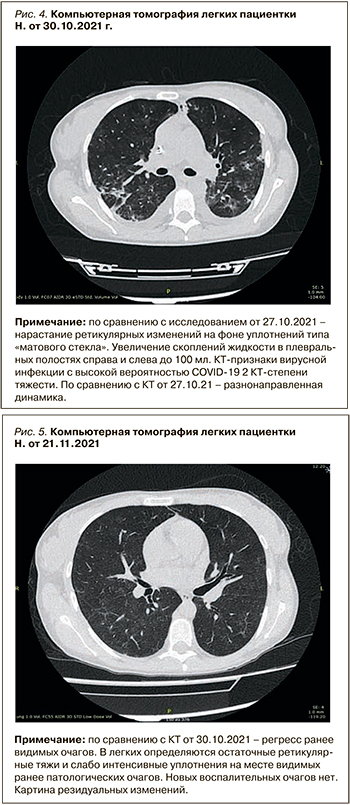
В связи с относительно стабильными показателями азотемии и нарастанием диуреза предпринимались попытки увеличения времени между сеансами гемодиализа, однако у пациентки наблюдалась тенденция к гиперкалиемии и гипергидратации, поэтому с учетом высоких рисков развития катетер-ассоциированной инфекции была сформирована нативная артериовенозная фистула.
Принимая во внимание высокую активность СКВ (активный мочевой синдром со стойкой протеинурией до 8 г/сут, эритроцитурией до 300 кл/ мкл, диализ-потребное острое повреждение почек при сохранных размерах почек и паренхимы, иммунологическая активность, гематологические отклонения в виде анемии, лейкопении, несмотря на проводимую патогенетическую терапию глюкокортикостероидами, цитостатиками и курсы плазмотерапии), противовирусную терапию ганцикловиром и человеческим иммуноглобулином по поводу выявленной цитомегаловирусной (ЦМВ) инфекции, было принято решение о применении белимумаба, лечение которым было инициировано в дозе 400 мг внутривенно капельно однократно в 14 дней. На фоне проводимой терапии отмечалась положительная динамика в виде улучшения показателей крови (повышение уровня гемоглобина, лейкоцитов) и уменьшения протеинурии до 3,2 г /сут, зарегистрирована тенденция к снижению показателей азотемии. После введения белимумаба было начато снижение преднизолона по 0,25 мг в 3 дня, наблюдалось восстановление темпов диуреза, отсутствие витальных показаний к заместительной почечной терапии (ЗПТ); это позволило сначала увеличить междиализные интервалы, а затем полностью прекратить сеансы гемодиализа.
Через неделю после второго введения белимумаба при лабораторном контроле было выявлено нарушение показателей гемограммы в виде лейко- и нейтропении, моноцитоза, снижение количества лейкоцитов до 1,0×109/л, нейтрофилов до 1,3×109/л и повышение моноцитов до 4,1×109/л при нормальном уровне тромбоцитов (209 тыс). Ввиду выраженного моноцитоза в крови пациентка была проконсультирована гематологом с целью исключения гемафагоцитарного синдрома. Выполнена стернальная пункция с цитологическим исследованием, иммунофенотипирование лимфоцитов, а также исключено вирусное поражение: СMV, EBV, HSV1, 2, 6 типа, VZV. В миелограмме данных в пользу миелодиспластического синдрома и вирусного поражения получено не было.
Из-за повышения температуры тела до 38,5 °С, которая была расценена как нейтропеническая лихорадка, был инициирован очередной курс антибактериальной терапии препаратами широкого спектра действия с учетом наиболее вероятных возбудителей нейтропенической лихорадки, сепсиса (Enterobacterales spp., включая CarbR, MRSA, в первую очередь Ps. aeruginosa). С учетом острого повреждения почек и высокой вероятности инвазивного аспергиллеза назначены: дорипенем 750 мг/сут, полимиксин В сульфат с нагрузочной дозой 100 мг, далее по 50 мг внутривенно капельно 3 раза/сут; ванкомицин 1,0 г внутривенно однократно в 4 дня, амфотерицин B [липидный комплекс] 100 мг/сут внутривенно. По данным визуализирующих методов, диагностики явных источников гнойно-септических очагов обнаружено не было. При микробиологическом исследовании крови и мочи данных в пользу роста микроорганизмов не получено. Для исключения грибкового поражения был выполнен анализ крови на галактоманнан, индекс оптической плотности которого был ниже 0,2 (отрицательный результат – менее 0,5).
На фоне проведенной терапии наблюдалась четкая положительная клинико-лабораторная динамика в виде регресса синдрома системной воспалительной реакции, отмечалось дальнейшее снижение уровня азотемии (сывороточные уровни мочевины и креатинина снизились до 14 ммоль/л и 146 мкмоль/л соответственно); калий сыворотки составил 4,0 ммоль/л, диурез достиг 1,5–2,0 л и оставался стабильным.
Пациентка была выписана на амбулаторный этап лечения с рекомендациями продолжить патогенетическую терапию (метилпреднизолон 16 мг/сут, гидроксихлорохин 200 мг/сут, введение белимумаба).
Через 2 мес больная была повторно госпитализирована для планового обследования и коррекции патогенетической терапии. При лабораторном исследовании: гемоглобин – 119 г/л; тромбоциты – 357 тыс; лейкоциты – 5,5 тыс.; мочевина – 21 ммоль/л; креатинин – 197 мкмоль/л (СКФ 28 мл/мин); калий – 4,5 ммоль/л; общий белок – 65 г/л; альбумин – 38 г/л; холестерин – 6,7 ммоль/л. Суточная протеинурия составила 0,29 г при отсутствии в анализах мочи активного мочевого осадка. Таким образом, констатирована ремиссия нефротического синдрома, разрешение острого повреждения почек с частичным восстановлением азотвыделительной функции почек. Оценка активности СКВ по SELENA SLEDAI – 2 балла. С целью решения вопроса о продолжении терапии белимумабом пациентке выполнена биопсия почки: верифицирован IV класс волчаночного нефрита (рис. 6).
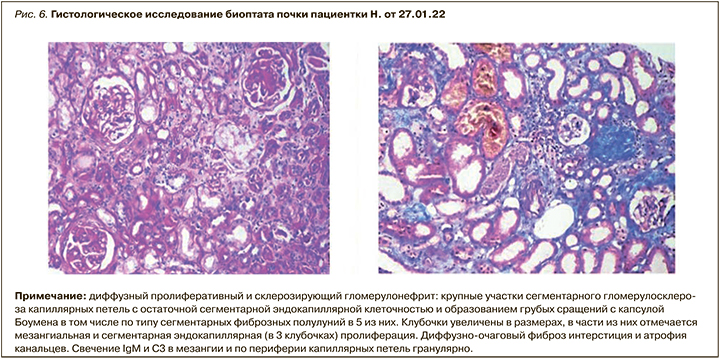
Пациентка была выписана на амбулаторный этап наблюдения и лечение у ревматолога и нефролога с рекомендацией продолжения терапии белимумабом, гидроксихлорохином с последующим снижением дозы метилпреднизолона.
ЗАКЛЮЧЕНИЕ
В целом можно сделать вывод, что несколько иммунных нарушений связаны как с COVID-19, так и с СКВ, которые в некоторых случаях являются общими для обоих заболеваний. Эти нарушения затрагивают почти все части иммунной системы, включая клеточную и врожденную. Более того, поражение почек, дыхательной и сердечно-сосудистой систем у пациентов с СКВ, ограниченная способность вырабатывать эффективный иммунный ответ против вируса, частое использование иммуносупрессивных препаратов и методов лечения, истощающих В-клетки, предрасполагают их к более высокому риску заражения, более тяжелым осложнениям и худшим исходам. Несмотря на многочисленные исследования, все еще остается без ответа много вопросов о роли иммунитета и его нарушении в патогенезе обоих заболеваний и терапевтической стратегии рациональной этиотропной и патогенетической терапии при конкурирующем течении COVID-19 и СКВ с полиорганными осложнениями. Представленное нами клиническое наблюдение демонстрирует крайне затруднительную дифференциальную диагностику конкурирующего течения обоих заболеваний. Лечение пациентки потребовало принятия крайне сложных неординарных решений, которые были возможны только при согласованном обсуждении быстро меняющихся симптомов болезни и крайне тяжелого течения заболевания клиницистами различных профилей.



