ВВЕДЕНИЕ
Открытие препаратов группы агонистов рецепторов глюкагоноподобного пептида-1 (арГПП-1) стало одним из больших достижений современной науки. Высокая эффективность в лечении сахарного диабета 2-го типа (СД 2) и ожирения, а также широкий спектр плейотропных эффектов – весомые причины высокой популярности лекарственных средств этого класса в медицинском сообществе и среди пациентов.
Клинически значимый сахароснижающий эффект и различные органопротективные свойства арГПП-1 позволяют рассматривать их как опцию выбора в комбинации с метформином как на старте лечения, так и при длительном стаже СД 2. При этом в соответствии с алгоритмами специализированной помощи пациентам с диабетом назначение арГПП-1 целесообразно при наличии таких доминирующих сопутствующих состояний/патологий, как высокий риск атеросклеротических сердечно-сосудистых заболеваний (ССЗ), хроническая болезнь почек (ХБП), ожирение или гипогликемии. В целом, учитывая доказанный протективный эффект арГПП-1 в отношении атеросклеротических ССЗ и ХБП у больных СД 2, а также их высокую безопасность и низкий риск гипогликемий, применение этой группы препаратов может быть рассмотрено у пациентов с СД 2 и широким спектром коморбидной патологии.
Возможность использования ряда арГПП-1 в лечении ожирения положила начало новой эре в ведении пациентов с этой патологией, способствовала развитию концепции метаболического здоровья и обоснованному внедрению медикаментозной терапии уже на стадии избыточной массы тела.
ОРГАНОПРОТЕКТИВНЫЕ СВОЙСТВА арГПП-1
Список известных плейотропных эффектов арГПП-1 продолжает активно расширяться. Учитывая высокую частоту встречаемости СД 2, ожирения и большой круг сопутствующих им нарушений и осложнений, наличие у этих препаратов благоприятных плейотропных свойств является несомненным их преимуществом, позволяющим оказывать протективное влияние на различные органы и системы пациента без назначения дополнительных лекарственных средств.
Кардиопротективные свойства
В связи со значительной распространенностью ССЗ у пациентов с метаболическими нарушениями в современной литературе активно освещаются кардиопротективные эффекты арГПП-1. Роль этого класса лекарственных средств в улучшении сердечно-сосудистого прогноза при СД 2 не вызывает сомнений. Так, семаглутид продемонстрировал преимущества по сравнению с плацебо в отношении первичной комбинированной точки (сердечно-сосудистая смертность, нефатальный инфаркт, инсульт) у пациентов с СД 2 в исследовании SUSTAIN-6 [1]. В нем была установлена бóльшая эффективность препарата по сравнению с плацебо в отношении снижения частоты развития кардиоваскулярных осложнений (отношение рисков (ОР) 0,74; 95% доверительный интервал (ДИ): 0,58–0,95; p = 0,02). Смертность от ССЗ (ОР 0,98; 95% ДИ: 0,65–1,48; р = 0,92), частота развития инфаркта миокарда (ОР 0,74; 95% ДИ: 0,51– 1,08; р = 0,12), госпитализаций по поводу сердечной недостаточности (ОР 1,11; 95% ДИ: 0,77–1,61; р = 0,57) и общая смертность (ОР 1,05, 95% ДИ: 0,74–1,5; р = 0,79) в группах исследования достоверно не различались. В то же время частота развития инсульта на фоне применения исследуемого препарата снизилась на 39% (ОР 0,61; 95% ДИ: 0,38–0,99; р = 0,04). Таким образом, в SUSTAIN-6 была доказала более высокая эффективность семаглутида относительно плацебо в отношении частоты возникновения MACE (Major Adverse Cardiovascular Events – основные неблагоприятные сердечно-сосудистые события) [2].
В крупномасштабном клиническом исследовании SELECT было продолжено изучение кардиопротективных свойств семаглутида у пациентов с ожирением или избыточной массой тела (индекс массы тела > 27 кг/м2) без нарушений углеводного обмена, но имеющих хотя бы одно ССЗ в анамнезе. В работу было включено большое количество участников (n = 17 604), среди которых 76,3% перенесли инфаркт миокарда, 23% – инсульт, 8,6% страдали заболеваниями периферических артерий, 24,0% – хронической сердечной недостаточностью (ХСН). Примечательно также, что 64,5% пациентов имели предиабет. Результаты SELECT продемонстрировали, что применение семаглутида привело к уменьшению первичной конечной точки MACE на 20% (ОР 0,80; 95% ДИ: 0,72–0,90; p < 0,001). Кроме того, было зарегистрировано снижение общей смертности на 19% (ОР 0,81; 95% ДИ: 0,71– 0,93; p < 0,001) [3]. Также в этом исследовании оценивалось влияние семаглутида на составную конечную точку по ХСН, включающую смерть от ССЗ или госпитализацию по поводу сердечной недостаточности. Из всей когорты вошедших в исследование больных (n = 17 604) 24% имели ХСН, медиана наблюдения составила 34 нед. В результате было установлено, что лечение семаглутидом ассоциировалось со снижением главной конечной точки по ХСН на 18% (ОР 0,82; 95% ДИ: 0,71– 0,96), хотя статистически значимого снижения сердечно-сосудистой смерти не наблюдалось [3].
Основные хорошо известные кардиопротективные свойства арГПП-1 включают уменьшение артериального давления, проявлений атеросклероза и ишемии сердца, снижение эндотелиальной дисфункции и улучшение функции сердца. Существенный вклад в реализацию суммарных кардиопротективных эффектов этой группы препаратов вносит также их способность уменьшать воспаление, снижать массу тела, улучшать контроль гликемии, благоприятное влияние на липидный профиль и ряд других эффектов, опосредованно воздействующих на состояние сердечно-сосудистой системы (рис. 1).
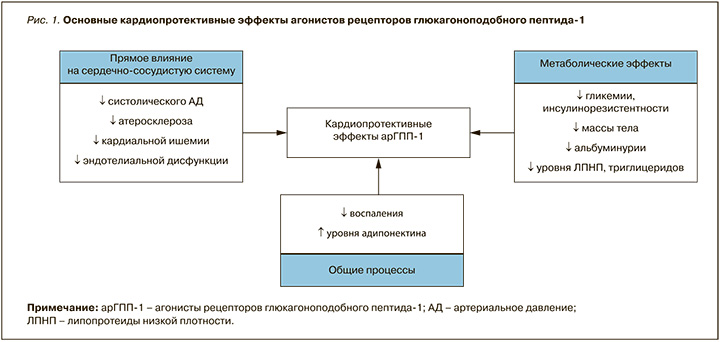
Исследования на животных позволяют обозначить возможные молекулярные механизмы кардиопротекции арГПП-1. Например, в исследовании Withaar С. et al. на мышах, у которых была смоделирована ХСН с сохраненной фракцией выброса, был сделан вывод об улучшении функции эндотелия левого желудочка, а также о повышении активности защитных иммунных реакций в висцеральной жировой ткани [4].
Помимо этого, особый интерес представляет изучение молекулярных механизмов антиатерогенных свойств арГПП-1. Активация аденозинмонофосфат-активируемой протеинкиназы вызывает повышение активности НАД+-зависимой деацетилазы, которая усиливает экспрессию липолитических белков, таких как триацилглицероллипаза. Этот процесс приводит к истощению запасов триглицеридов в белой жировой ткани и, как следствие, к уменьшению накопления жира и увеличению расхода энергии. Интенсивность метаболизма липидов также снижается благодаря подавлению экспрессии рецепторов PPAR при использовании арГПП-1 [5].
Нефропротективные свойства арГПП-1
Выделяют прямые и непрямые нефропротективные эффекты арГПП-1. К прямым относятся такие свойства этих препаратов, как стимуляция натрийуреза в проксимальных канальцах, ингибирование ренин-ангиотензин-альдостероновой системы, ренальная эндотелий-зависимая вазодилатация, снижение ренальной гипоксии и гломерулярного атеросклероза и др. Непрямая нефропротекция на фоне приема арГПП-1 обусловлена улучшением гликемического контроля и контроля артериального давления, снижением массы тела, увеличением чувствительности к инсулину, уменьшением уровня постпрандиального глюкагона и интестинального всасывания липидов, а также повышением активности бурой жировой ткани [6]. Так, в исследовании SUSTAIN было показано положительное влияние семаглутида на снижение частоты возникновения или прогрессирования нефропатии по сравнению с пациентами контрольной группы. Результатом ретроспективного анализа клинических испытаний стало выявление последовательного снижения альбуминурии при применении этого препарата относительно плацебо, причем наибольшее снижение наблюдалось в подгруппах как с микроальбуминурией, так и с макроальбуминурией [7]. В 6 крупных исследованиях арГПП-1 при сопоставлении с плацебо продемонстрировали улучшение почечных исходов: было достигнуто снижение на 21% комплексного почечного исхода, который определялся в широком смысле как развитие впервые возникшей макроальбуминурии, снижение расчетной скорости клубочковой фильтрации (рСКФ) не менее чем на 40%, а также необходимость в заместительной почечной терапии или смерть от заболевания почек. Авторы дополнительно изучили «более тяжелые» последствия для почек, которые определялись как двукратное возрастание уровня креатинина в сыворотке крови или снижение рСКФ по меньшей мере на 40%. Терапия арГПП-1 была ассоциирована с тенденцией к улучшению комплексного показателя на 14%, однако статистической значимости при этом не отмечалось [8].
Одним из важнейших исследований по оценке почечных эффектов семаглутида у пациентов с СД 2 и ХБП стала программа FLOW, которая охватила 3533 пациента, а период наблюдения составил 3,4 года. Первичная конечная точка включала главные почечные события, к которым относятся стойкое снижение рСКФ < 15 мл/ мин. / 1,73 м2 или начало диализа или трансплантацию почки, стойкое снижение рСКФ ≥ 50% или смерть из-за почечных или сердечно-сосудистых причин. Составляющей вторичной конечной точки была оценка изменения рСКФ за год. Результаты FLOW показали снижение риска первичной конечной точки на 24% в группе семаглутида по сравнению с группой плацебо (ОР 0,76; 95% ДИ: 0,66–0,88; p = 0,0003), частоты наступления впервые возникшей нефропатии на 21% (ОР 0,79; 95% ДИ: 0,66–0,94). Согласно данным анализа вторичных конечных точек, семаглутид превосходил плацебо по такому показателю, как замедление снижения рСКФ за год (на 1,16 мл / мин. / 1,73 м2 медленнее; p < 0,001). Кроме того, препарат вызвал более выраженное уменьшение альбумин-креатининового соотношения в моче (на 38% больше по сравнению с плацебо к 104-й неделе исследования) и замедление темпов снижения рСКФ, рассчитанной по уровню цистатина C (3,39 мл / мин. / 1,73 м2).
Гепатопротективные эффекты арГПП-1
Проблеме метаболически ассоциированной жировой болезни печени (МАЖБП) у пациентов с СД 2 и ожирением посвящено большое количество научных работ. По данным мировой литературы, распространенность МАЖБП среди больных СД 2 находится в пределах 50–80% [9]. Известно также, что наличие СД 2 увеличивает риск развития МАЖБП в 55,5% случаев [10]. Поскольку эта патология распространена среди пациентов с СД 2 и ожирением, а в сегодняшних реалиях нет возможности этиотропного лечения МАЖБП, способность арГПП-1 уменьшать ее выраженность особенно актуальна.
Протективный эффект арГПП-1 в отношении печени может достигаться в первую очередь за счет модуляции гликемии и снижения глюкозотоксичности, что клинически проявляется в виде уменьшения уровня показателей цитолиза гепатоцитов (аланинаминотрансферазы и аспартатаминотрансферазы) [11]. В метаанализе Armstrong M.J. et al., объединившем данные о более чем 4000 пациентах, назначение лираглутида в дозировке 1,8 мг привело к существенному снижению уровня аланинаминотрансферазы, что коррелировало со снижением массы тела и уровня триглицеридов [12].
Говоря о косвенном механизме гепатопротективного эффекта арГПП-1, нельзя не упомянуть и об уменьшении липотоксичности за счет центральных механизмов снижения массы тела. В исследованиях даже небольшое снижение массы тела (на 7–10%) вызывало уменьшение выраженности жировой инфильтрации печени [13]. Некоторые ученые установили превосходство арГПП-1 над другими классами сахароснижающих препаратов с точки зрения гепатопротективного эффекта: так, в исследовании Blaslov K. et al. на фоне терапии арГПП-1 отмечалось улучшение в плане накопления липидов в печени, зарегистрированное методом оценки индекса стеатоза печени (Fatty Liver Index, FLI). При этом аналогичного эффекта при использовании других гипогликемических средств зафиксировано не было [14].
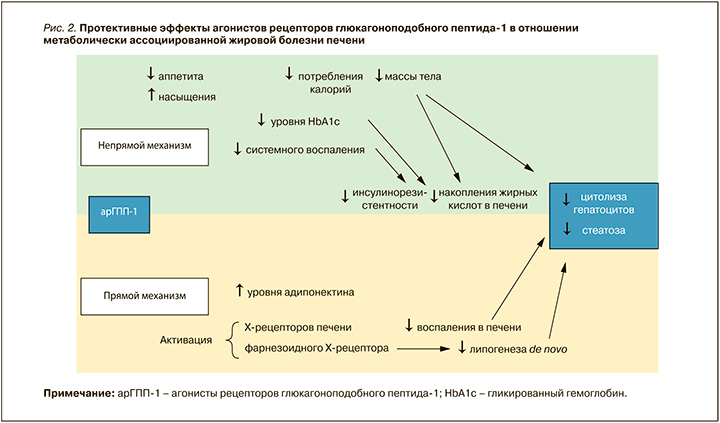
Важно добавить, что ГПП-1 стимулирует активацию в печени фактора роста фибробластов 23, подавляющего липолиз в адипоцитах и повышающего чувствительность гепатоцитов к инсулину. Следовательно, аналогичные эффекты сопровождают и применение арГПП- 1 [15]. Особого внимания заслуживают прямые механизмы влияния арГПП-1 на уменьшение выраженности НАЖБП: активация Х-рецептора печени, служащего регулятором транспорта холестерина в гепатоциты, приводит к уменьшению печеночного воспаления, а активация фарнезоидного рецептора Х – к ингибированию липогенеза de novo (рис. 2). Таким образом, совокупность прямых и непрямых механизмов влияния арГПП-1 на ткань печени обеспечивает значимое улучшение течения МАЖБП у пациентов, получающих терапию препаратами этого класса, что подтверждается большим количеством клинических исследований [16].
Влияние арГПП-1 на кишечную микробиоту
Среди гастроэнтерологических эффектов арГПП-1 особый интерес представляет их влияние на кишечную микробиоту (КМ). Известно, что у пациентов с СД 2 состав КМ и ее метаболическая активность отличаются от таковых у здоровых людей: снижаются общее количество и биоразнообразие микроорганизмов и, как следствие, изменяется общее количество их основных метаболитов – короткоцепочечных жирных кислот (КЦЖК). Таким образом, регуляция КМ под влиянием арГПП-1 может быть рассмотрена в качестве дополнительного механизма действия этой группы лекарственных средств.
В исследовании на мышах было продемонстрировано, что использование арГПП-1 у животных, чей рацион содержал повышенное количество жиров, было ассоциировано с увеличением уровня Lactobacillus reuteri, являющих продуцентами КЦЖК, в особенности масляной кислоты. Еще одним из выводов этого исследования стало снижение уровня церамида, что может свидетельствовать об улучшении показателей липидного профиля, а также повышение активности браунинга жировой ткани [17]. В исследовании in vitro применение арГПП-1 сопровождалось повышением уровня норэпинефрина в просвете кишечника, а дальнейшие работы этой же группы исследователей in vivo показали взаимосвязь между введением арГПП- 1 и активацией симпатической нервной системы, что было ассоциировано с увеличением количества Escherichia coli [18]. В исследовании влияния арГПП-1 на КМ крыс с индуцированным СД было выявлено возрастание числа бактерий-продуцентов КЦЖК, а также увеличение разно-образия КМ. При этом ряд исследований, в которых арГПП-1 назначались в дополнение к терапии другими сахароснижающими препаратами, не обнаружили аналогичных улучшений со стороны КМ [19]. В целом количество работ, посвященных воздействию арГПП-1 на КМ, в настоящее время ограничено, и для формирования структурированных выводов в этом направлении необходимо проведение дальнейших исследований.
Нейропротективные свойства арГПП-1
Одним из основных механизмов нейропротекции арГПП-1 предположительно считается их влияние на астроциты головного мозга, являющиеся наиболее распространенным типом клеток в нервной ткани головного мозга взрослого человека и играющие ключевую роль в гомеостазе глюкозы и энергии в нервной системе. На мембранах астроцитов активно экспрессируются рецепторы ГПП-1. Ряд исследований подтверждает, что снижение количества таких рецепторов связано с нарушением функции митохондрий, ингибированием поглощения глюкозы и β-окисления. Принципиальное понимание роли рецепторов ГПП-1 в контроле углеводного обмена в нервной системе лежит в основе изучения механизмов нейропротекции арГПП-1. В исследованиях на лабораторных животных было зафиксировано положительное влияние этой группы препаратов на нейровоспаление, что способствовало уменьшению болевого синдрома. Введение эксендина-4 крысам с перевязанным спинномозговым нервом для моделирования болевого синдрома и симптоматики когнитивных нарушений было ассоциировано со снижением уровней факторов воспаления, в частности интерлейкина 1β, фактора некроза опухоли-альфа и индуцибельной синтазы оксида азота, и, как следствие, с уменьшением дегенерации дофамин-продуцирующих клеток. Клинически это выражалось в снижении болевой чувствительности [20].
Отдельный предмет исследования нейропротективных свойств арГПП-1 – влияние данной терапии на аддиктивное поведение. Так, применение семаглутида было ассоциировано с уменьшением употребления алкоголя пациентами [21]. Предположительным механизмом коррекции режима потребления алкоголя на фоне применения арГПП-1 считается их влияние на лимбическую систему, а именно прилежащее ядро гипоталамуса, проявляющееся нарушением выброса дофамина, который в норме стимулируется алкоголем. Таким образом, происходит торможение гипоталамической системы вознаграждения в результате приема спиртного, что отражается на снижении его употребления [22].
Нейропротективный эффект арГПП-1 неоднократно подчеркивался исследователями, изучающими влияние лекарственных средств этого класса на течение нейродегенеративных заболеваний. Такое влияние может осуществляться посредством усиления пролиферации клеток, улучшения памяти и синаптической пластичности, уменьшения окислительного стресса, воспаления и β-амилоидных бляшек. В исследовании на животных было установлено, что систематическое введение арГПП-1 мышам с бронхиальной астмой в течение 8 нед. вызывало снижение осаждения β-амилоидных бляшек на 40–50%, уменьшение воспалительного ответа активированных глиальных клеток [23]. Также на мышиных моделях было зафиксировано, что введение лираглутида перед инъекциями β-амилоида оказывало протективный эффект в отношении пространственной памяти и долговременной потенциации [24].
Существуют предположения, что определенные протективные свойства арГПП-1 могут наблюдаться и в отношении пациентов с психическими нарушениями. В частности, опубликован протокол проспективного исследования SemaPsychiatry, в котором принимают участие пациенты с расстройствами шизофренического спектра [25]. Ряд работ посвящен антидепрессивным свойствам арГПП-1. Выводы метаанализа Chen X. et al. заключались в улучшении результатов шкалы оценки депрессии у исследуемых при использовании арГПП- 1 [26, 27]. В основе описанных эффектов лежат такие эффекты арГПП-1, как ингибирование апоптоза нейронов, снижение оксидативного стресса, повышение синаптической пластичности, подавление высвобождения провоспалительных цитокинов, а также снижение инсулинорезистентности и уменьшение накопления β-амилоида (рис. 3).
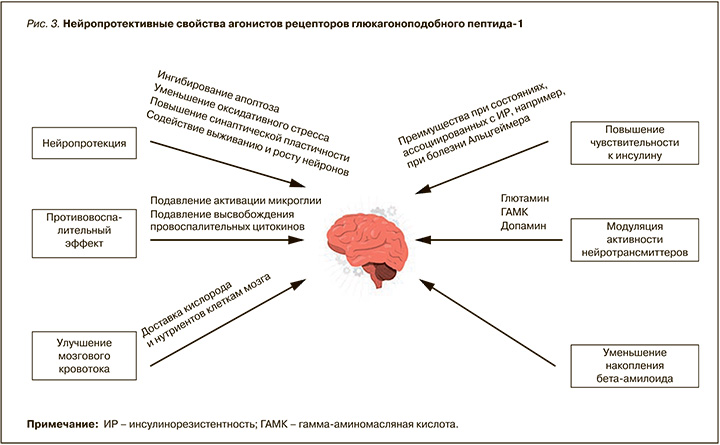
Особое внимание в современных клинических исследованиях уделяется профилактике инсультов у пациентов, получающих арГПП- 1, в основе которой лежит антиоксидантное, противовоспалительное и антиапоптотическое действие этих препаратов [28]. Наиболее яркий пример подобного исследования – SUSTAIN-6, включившее 6480 пациентов с высоким сердечно-сосудистым риском, у 108 из которых произошел ишемический инсульт. Результаты показали, что применение семаглутида достоверно снижало количество любых инсультов по сравнению с плацебо (0,8 против 1,1 случая инсульта на 100 пациенто-лет наблюдения соответственно; 95% ДИ: 0,46– 1,00; p = 0,048), а также уменьшало частоту окклюзии мелких сосудов головного мозга (0,3 против 0,7 случая на 100 пациенто-лет наблюдения; 95% ДИ: 0,29– 0,89; p = 0,017) [29].
Репродуктивное здоровье
В настоящее время арГПП-1 все больше укрепляют свои позиции в репродуктивной эндокринологии. Учитывая тот факт, что эти лекарственные средства могут применяться пациентками репродуктивного возраста для лечения ожирения и СД 2, вопрос безопасности арГПП-1 во время подготовки к беременности и на ее протяжении чрезвычайно актуален. Несмотря на то что арГПП-1 не зарегистрированы для лечения ожирения или СД 2 у беременных, в литературе описываются случаи незапланированных беременностей, наступавших на фоне терапии этими препаратами. С момента диагностики беременности их использование прекращалось, но в ряде случаев имел место факт применения арГПП- 1 в I триместре беременности. В большинстве исследований описывается отсутствие врожденных пороков или благоприятные исходы для новорожденных при использовании арГПП-1 беременными. Проведены масштабные клинические исследования, позволяющие утверждать, что риск формирования пороков развития у плода при применении арГПП-1 во время гестации не превышает таковой у беременных, использующих инсулинотерапию. Распространенность врожденных пороков среди новорожденных, матери которых использовали арГПП-1 на этапе планирования беременности, составила 8,3%, что было сопоставимо с риском в группе инсулинотерапии [30].
Не менее активно в современной литературе обсуждается возможность применения арГПП-1 в качестве элемента терапии синдрома поликистозных яичников (СПЯ), однако имеющиеся данные не позволяют сформулировать рекомендации по их использованию в упомянутых целях. Авторы делают вывод, что влияние арГПП-1 на течение СПЯ не ограничивается лишь косвенными эффектами снижения массы тела, но также заключается в коррекции гиперандрогении. Такой вывод был сформулирован на основании того, что уменьшение гиперандрогении наблюдалось даже в случае незначительного снижения индекса массы тела (при использовании арГПП- 1 не в максимальных дозировках) [31]. Есть данные об улучшении течения СПЯ, полученные на мышиных моделях. При этом авторы исследований объясняют выявленные метаболические улучшения в большей степени модуляцией КМ животных [32].
Ожирение остается глобальной медико-социальной проблемой, ассоциированной с высоким кардиометаболическим риском. Включение семаглутида (2,4 мг) в новейшие российские клинические рекомендации по лечению ожирения (2024) как одного из средств первой линии, обеспечивающего выраженное снижение массы тела, преимущественно за счет висцеральной жировой ткани, длительное удержание достигнутого результата и уменьшение сердечно-сосудистых рисков, включая конечные точки МАСЕ, предопределило потребность в доступных и безопасных препаратах, содержащих этот арГПП-1. Препарат Велгия® (ГК Промомед) – первый отечественный семаглутид, соответствующий всем требованиям рекомендаций, включая полный спектр необходимых для титрации дозировок препарата. Велгия® производится на основе оригинальной технологии твердофазного химического синтеза и очистки активной фармацевтической субстанции, разработанной ГК Промомед.
Ключевые преимущества препарата Велгия®
1. Сопоставимость с оригинальным препаратом по клиническим стандартам эффективности и безопасности.
2. Полный набор дозировок для корректной титрации (от стартовой 0,25 мг до терапевтической 2,4 мг), позволяющий персонализировать терапию и соблюдать схемы лечения, утвержденные в клинических рекомендациях.
3. Специально разработанная шприц-ручка, не требующая специализированных навыков инъекций, совместимая с иглами любых производителей и за счет этого обеспечивающая удобство применения препарата, способствующая высокому качеству жизни пациентов и, несомненно, повышающая их комплаентность.
В мае 2025 г. появится новый вариант Велгии – Велгия® Эко, который не содержит консервантов: только семаглутид и буферный раствор. Велгия® Эко будет выпускаться в виде раствора для подкожного введения в удобных для использования и интуитивно понятных автоматических инжекторах. Внедрение в клиническую практику препаратов Велгия® (семаглутид 2,4 мг) и Велгия® Эко, созданных на основе инновационной технологии химического синтеза, представляется значимым событием, расширяющим возможности лечения пациентов с ожирением в РФ.
ЗАКЛЮЧЕНИЕ
Терапевтическое действие арГПП-1 выходит за рамки простого контроля уровня глюкозы и снижения массы тела, проявляясь широким спектром плейотропных эффектов, что оказывает существенное положительное влияние на качество жизни пациентов. Изучение этих дополнительных эффектов открывает новые горизонты для клинического применения арГПП- 1, позволяет разрабатывать более комплексные и персонализированные подходы к лечению СД 2, ожирения и сопутствующих заболеваний. Новые исследования в этой области обещают дальнейшее расширение понимания механизма действия арГПП- 1, что может способствовать их более широкому использованию и дополнительному улучшению качества жизни пациентов. Семаглутид – один из наиболее новых, но в то же время проверенных большим количеством клинических исследований и годами практики препаратов этого класса. Имея такие очевидные преимущества, как возможность применения в разных лекарственных формах, длительный период действия, а также высокая эффективность и безопасность, семаглутид может рассматриваться в качестве мощного сахароснижающего агента и средства коррекции массы тела для широкого круга пациентов.



