ВВЕДЕНИЕ
В последнее время кардиоренальные взаимодействия привлекают все большее внимание исследователей, что обусловлено ростом распространенности почечной патологии сердечно-сосудистой и мочевыделительной систем, сахарного диабета (СД), ожирения, а также более частым применением интервенционных методов обследования и лечения [1].
Заболевания сердца и почек имеют такие общие «традиционные» факторы риска, как, например, артериальная гипертензия (АГ), СД, ожирение и дислипидемия. Кроме того, свою роль в их развитии играют и «нетрадиционные» факторы: гипергидратация, анемия, нарушения фосфорно-кальциевого обмена, системное воспаление, гиперкоагуляция [2].
У пациентов с сердечно-сосудистой патологией вероятность развития дисфункции почек на порядок выше, чем в общей популяции. У лиц с мультифокальным атеросклерозом сочетание кардиальной дисфункции и снижения скорости клубочковой фильтрации (СКФ) значительно утяжеляет прогноз, повышая риск развития осложнений и ускоряя прогрессирование как сердечной, так и почечной недостаточности [3].
Таким образом, взаимоотношения дисфункции почек и изменений сердечно-сосудистой системы носят многогранный характер и выстраиваются по типу обратной связи. В этом контексте почка, с одной стороны, может выступать органом-мишенью для воздействия большинства известных факторов, связанных с сердечно-сосудистыми изменениями, а с другой – активно влиять на формирование системных метаболических и сосудистых патологических процессов, определяющих судьбу соответствующих пациентов [4].
По данным литературы, признаки повреждения почек и/или нарушения СКФ выявляют как минимум у каждого десятого представителя общей популяции и гораздо чаще – до 40–50% – в категории лиц очень высокого сердечно-сосудистого риска [5]. Хроническая болезнь почек (ХБП) является патологией, приобретающей характер неинфекционной эпидемии вследствие значительной распространенности в популяции, резкого снижения качества жизни и высокой смертности пациентов, что диктует необходимость оптимизации инструментов ее прогнозирования у указанной группы больных.
Цель исследования – изучить особенности развития ХБП и разработать алгоритм ее прогнозирования у пациентов с мультифокальным атеросклерозом.
МАТЕРИАЛ И МЕТОДЫ
В исследование были включены 519 пациентов с атеросклеротическим поражением различных сосудистых бассейнов, находившихся на лечении в профильных отделениях ГБУ РО «Ростовская областная клиническая больница», из них 360 (69,4%) мужчин и 159 (30,6%) женщин. Средний возраст обследованных составил 60,0±8,7 лет.
Всем пациентам были проведены стандартные лабораторные и комплекс инструментальных исследований, в том числе коронароангиография, ангиография почечных, брахиоцефальных и артерий нижних конечностей.
Согласно полученным клинико-анамнестическим данным, курение было верифицировано у 209 (39,1%) обследованных пациентов. Индекс массы тела (ИМТ) большинства больных превышал норму. ХСН была диагностирована у 333 (59,7%) человек, острые нарушения мозгового кровообращения (ОНМК) в анамнезе наблюдались у 98 (19,3%), а острый инфаркт миокарда (ОИМ) – у 205 (38,0%) пациентов группы исследования. Анализ проведенного ангиографического исследования позволил установить, что атеросклеротический стеноз коронарных артерий имел место у 472 (90,9%), поражение брахиоцефальных артерий – у 199 (38,3%), стеноз почечных артерий – у 103 (19,8%), артерий нижних конечностей – у 105 (20,2%) исследованных больных с учетом как моно- так и комбинированного сосудистого поражения. Были выделены группы пациентов с атеросклеротическим поражением одного (n=256; 49,5%), двух (n=171; 32,8%), трех (n=86; 16,5%) и четырех (n=6; 1,2%) сосудистых бассейнов.
Статистический анализ полученных результатов выполнялся с помощью пакетов прикладных статистических программ Microsoft Office Excel 2010 (Microsoft Corp., США) и STATISTICA 10.0 (StatSoft Inc., США). С целью оценки типа распределения данных использовался критерий Колмогорова–Смирнова, при значениях p >0,05 распределение считали не отличающимся от нормального.
Центральные тенденции представлены в виде среднего арифметического (М)±стандартное отклонение (SD) при нормальном распределении и в виде медианы (Me) и квартилей [Q1; Q3] в остальных случаях. При нормальном распределении выборки при сравнении двух независимых выборок применялся критерий Стьюдента, а при отличии от нормального – критерии Манна–Уитни и χ2 или тест Левена с определением F. Также использовался логистический регрессионный анализ с расчетом относительных рисков (OR) и определением χ2. Связь считалась статистически значимой при значении р <0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты проведенных эпидемиологических исследований показали, что на сегодняшний день проблема ХБП остается достаточно острой. Анализ современной литературы свидетельствует, что признаки ХБП отмечаются более чем у 1/3 пациентов c хронической сердечной недостаточностью. Снижение функции почек наблюдается у 36% людей в возрасте старше 60 лет, у лиц трудоспособного возраста снижение функции имеет место в 16% случаев, а при наличии сердечно-сосудистых заболеваний его частота возрастает до 26%. По данным регистра NHANES III, сочетание любых двух факторов кардиоваскулярного риска увеличивает в 3,7 раз вероятность развития почечной дисфункции [6, 7].
Согласно полученным нами данным, у 123 (28,9%) пациентов, включенных в исследование, в течение трех лет проспективного наблюдения отмечались сосудистые события, причем у 43 больных (10,1%) они носили фатальный характер. При этом установлено, что ХБП развилась у 2,2% пациентов исследуемой группы.
Систематизированная оценка имеющихся данных позволила выявить факторы, оказывающие влияние на риск развития ХБП в отдаленном периоде. Логистический регрессионный анализ подтвердил, что свое влияние на риск развития обсуждаемой конечной точки оказывали такие признаки, как длительность СД (р=0,005), возраст эпизода ОНМК (р=0,03), значение конечного диастолического объема (р=0,042),уровень креатинина (р=0,008) и мочевины сыворотки крови (р=0,021), величина СКФ (р <0,001), стадия ХБП (р <0,001), значение длины левой почки (р=0,011), поражение коронарной артерии (р=0,044), поражение проксимальной правой коронарной артерии (р=0,002), поражение задней межжелудочковой ветви (р=0,005), стеноз почечной артерии (р <0,001), поражение одной почечной артерии (р=0,002) , поражение двух почечных артерий (р=0,002), степень (%) атеросклеротического стеноза артерии левой почки в условиях двустороннего поражения (р=0,01).
Принимая во внимание полученные данные, с использованием логистического регрессионного анализа на основе формул была составлена оригинальная номограмма оценки риска развития отдаленного исхода, позволяющая прогнозировать возможные случаи ХБП (табл. 1). Так, при сопоставлении характеристик статистически значимых факторов можно оценить риска развития ХБП в отдаленном периоде у пациентов с мультифокальным атеросклерозом.
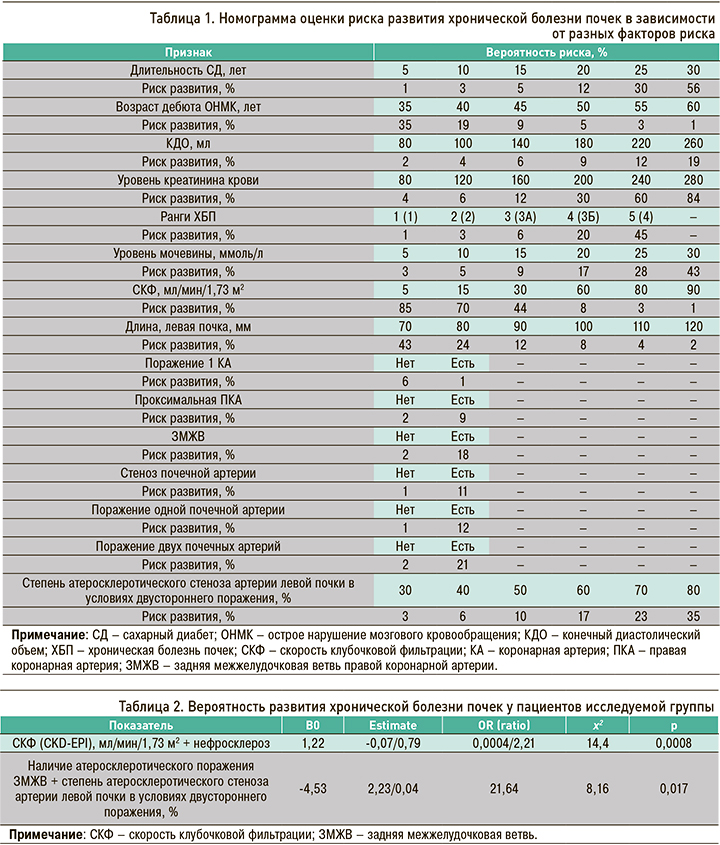
При длительности СД в течение 5 лет риск развития ХБП в отдаленном периоде составлял 1%, тогда как при длительности СД в течение 20 лет возрастал до 12%.
Если у пациента наблюдалось атеросклеротическое поражение почечных артерий, то обсуждаемый риск равнялся 11%, а при отсутствии стеноза был существенно ниже – 1%. Следует отметить тот факт, что при диагностировании у больного двустороннего стеноза почечных артерий вероятность развития ХБП в отдаленном периоде достигала 21%, в то время как при наличии одностороннего атеросклеротического процесса составляла 12%.
При атеросклеротическом поражении двух почечных сосудов и наличии стенозирования артерии левой почки, например, 30%, обсуждаемый риск был равен 3%, а при атеросклеротическом стенозе двух почечных сосудов и наличии 70% стеноза артерии левой почки увеличивался до 23%.
Полученные в ходе двухфакторного логистического регрессионного анализа данные позволили установить существенное влияние на вероятность развития ХБП комбинации таких признаков, как «СКФ (CKD-EPI, мл/мин/1,73 м2) + нефросклероз», «наличие атеросклеротического поражения задней межжелудочковой ветви + степень (%) атеросклеротического стеноза артерии левой почки в условиях двустороннего поражения» (табл. 2).
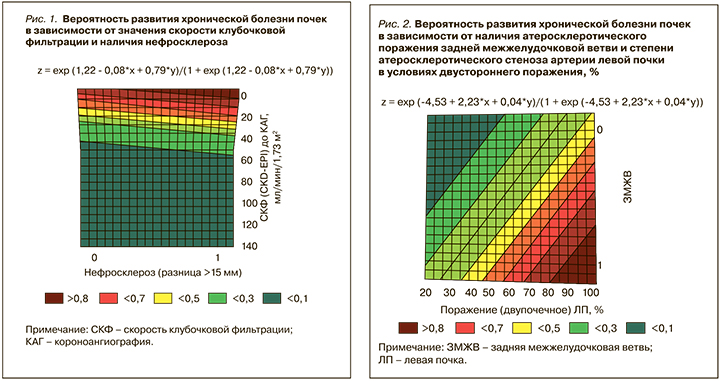
На основании полученных результатов с использованием уравнения логистической регрессии были составлены оригинальные номограммы, позволяющие определить риск развития ХБП в отдаленном периоде при оценке характеристик факторов (рис. 1, 2, табл.3, 4).

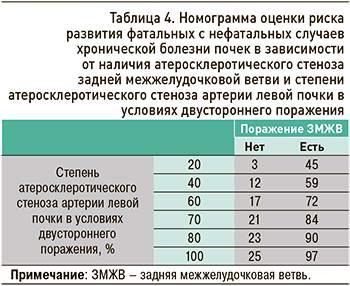
Так, при наличии нефросклероза и значении СКФ, например, 70 мл/мин/1,73 м2, обсуждаемый риск составлял 21%, а при том же значении СКФ, но уже в отсутствии нефросклероза он был равен 11%.
Согласно проанализированной литературе, в ряде работ продемонстрирована зависимость нарушения почечной функции от поражения коронарных сосудов. Так, атеросклеротическое поражение коронарных артерий по данным коронароангиографии напрямую коррелирует с СКФ [8]. При значении СКФ более 60 мл/мин/1,73 м2 гемодинамически значимое поражение сосудов коронарного русла отмечено у 33% лиц, а при СКФ менее 30 мл/мин/1,73 м2 аналогичный показатель составлял уже 53% [9]. Полученные в нашей работе данные наглядно демонстрируют тесное взаимодействие и взаимное негативное влияние патофизиологических механизмов в сердечно-сосудистой системе и почках, которые объединяют их в кардиоренальный континуум.
Группа больных с поражением коронарных сосудов и атеросклеротическим стенозом некоронарных бассейнов достаточно сложна для ведения. Результаты регистра REACH наглядно показали, что у лиц с мультифокальным атеросклерозом традиционные факторы риска хуже поддавались контролю, несмотря на более интенсивную медикаментозную терапию [10].
У пациентов с ишемической болезнью сердца и диагностированным атеросклеротическим поражением почечных артерий 5-летняя выживаемость была равна 63%, тогда как у больных без патологии почечных сосудов – 89% [11]. В другом исследовании было установлено, что 4-летняя выживаемость у пациентов со стенозом 50, 75 и 95% составила 70, 68 и 48% соответственно [12]. У лиц с двусторонним атеросклеротическим поражением почечных сосудов этот же показатель равнялся 47%, что было ниже, чем у больных с односторонним стенозом (59%) [13].
В многочисленных работах отмечено, что у пациентов с атеросклерозом некоронарной локализации довольно часто диагностируется ХБП [14].
В связи с изложенным выше на сегодняшний день существенное значение приобретает проведение предиктивной диагностики в рамках скрининга лиц с факторами риска ХБП [15]. В особенности это касается медленно развивающихся почечных процессов, таких как сосудистые поражения почек в результате АГ, атеросклероза, СД, ожирения, когда принципиально важны ранняя диагностика и меры по вторичной профилактике сердечно-сосудистых осложнений и прогрессирования ХБП [16].
Ориентируясь на составленную номограмму, можно установить, что при атеросклеротическом поражении задней межжелудочковой ветви и наличии атеросклеротического стеноза артерии левой почки в условиях двустороннего поражения, например, 70%, риск развития ХБП равен 84%, в то время как при отсутствии стеноза задней межжелудочковой ветви, но наличии второго критерия этот риск равен 21%.
ЗАКЛЮЧЕНИЕ
В рамках представленной работы проведено 3-летнее проспективное наблюдение среди пациентов с мультифокальным атеросклерозом для оценки риска развития конечных точек. С использованием логистического регрессионного анализа выявлены предикторы, оказывающие влияние на развитие ХБП у пациентов очень высокого сердечно-сосудистого риска. Выполненный комплексный анализ позволил разработать оригинальные номограммы оценки риска развития ХБП в отдаленном периоде, которые могут быть использованы в реальной клинической практике.



