ВВЕДЕНИЕ
Гиперурикемия (ГУ), определяемая как повышение уровня мочевой кислоты (МК) более 360 мкмоль/л у женщин и 420 мкмоль/л у мужчин, часто встречается в популяции, причем ассоциирована она не только с подагрой, но и распространенными коморбидными состояниями. Список возможных причин ГУ разнообразен: нарушения диеты, снижение почечной или кишечной экскреции уратов, повышенный синтез печенью, генетические причины, повышенный уровень образования МК, например при синдроме лизиса опухолей. В России, по данным эпидемиологического исследования, распространенность ГУ в популяции взрослых от 25–64 лет несколько ниже – 16,8%; при этом наблюдается значимое отличие по частоте ее встречаемости у мужчин (25,3%) и женщин (11,3%) [1]. В последние годы наблюдается рост интереса, исследований и публикаций, посвященных этой теме. Доказана взаимосвязь между уровнем ГУ и распространенностью сахарного диабета, АГ, ожирения [2], сердечно-сосудистых заболеваний (ССЗ) и хронической болезни почек (ХБП) [3].
Цель статьи – осветить показания для проведения диагностики ГУ и последующее ведение пациентов с ГУ при ХБП на основании современных российских рекомендаций.
ГИПЕРУРИКЕМИЯ И ЗАБОЛЕВАНИЯ ПОЧЕК
Почечный механизм повышения уровня МК может приводить к формированию как первичной, так и вторичной ГУ. В основе развития постоянной ГУ при отсутствии повышенного поступления МК прежде всего лежит нарушение ее выведения вследствие изменения клиренса. Примерно 2/3 объема МК экскретируется почками, где происходит процесс фильтрации, а далее – канальцевой реабсорбции, канальцевой секреции и постсекреторной реабсорбции. Эти процессы осуществляются большим количеством молекул транспортеров (OAT1, OAT3, OAT4, URAT1, GLUT9, BCRP, MRP4, NPT1, NTP4), работа которых, в свою очередь, кодируется большим количеством генов [4]. Генетический полиморфизм и многочисленные мутации приводят к широкому спектру клинических ассоциаций между ГУ и ХБП. К генетическим вариантам ХБП можно отнести аутосомно-доминантную тубулоинтерстициальную болезнь почек, для которой характерно прежде всего раннее развитие ГУ и последующей подагры. Однако с клинической точки зрения поражение почек на фоне ГУ принято выделять в виде трех следующих вариантов: уратная (подагрическая) нефропатия как причина ХБП, мочекаменная болезнь и острый мочекислый криз (острая мочекислая нефропатия) [3, 5, 6]. Первые два заболевания протекают в рамках хронических медленно прогрессирующих процессов, однако острая мочекислая нефропатия может представлять собой жизнеугрожающее состояние.
В основе уратной нефропатии лежит преципитация урата в дистальных канальцах и интерстиции с развитием воспаления, повреждения канальцев и последующего фиброза. Процесс прогрессирования ХБП поддерживается хронической активацией ренин-ангиотензин-альдостероновой системы, оксидативным стрессом, эндотелиальной дисфункцией с увеличением внутрипочечного давления и формированием АГ. Возникает пролиферация гладкомышечных клеток капилляров почек и эпителиально-мезенхимальное воспаление в интерстии и канальцевом аппарате почек [7].
Определенная роль в прогрессировании ХБП на фоне ГУ отводится активности фермента ксантиноксидазы (КСО), принимающего участие в синтезе МК; этот механизм связан с нарушением липидного обмена в почках. На данный момент ГУ можно рассматривать как важный и независимый фактор риска развития ХБП, более того, риск формирования и прогрессирования этой болезни возрастает при стойком повышении уровня МК более 420 мкмоль/л [7, 8].
Обращает на себя внимание связь ГУ не только с поражением почек, но и рядом коморбидных заболеваний, ассоциированных с ХБП. Согласно современным представлениям, ГУ служит предиктором ССЗ и общей смертности от всех причин, в том числе у пациентов без предшествовавших кардиоваскулярных заболеваний. Многолетние исследования доказали наличие общих патогенетических механизмов у ГУ, метаболического синдрома, сахарного диабета 2-го типа (СД 2), АГ, триглицеридемии и др. [9].
Механизмы, объясняющие причинно-следственную роль ГУ в развитии и ухудшении течения АГ, тесно переплетаются с изменениями, которые наблюдаются в патогенезе формирования ХБП на фоне ГУ. В рамках данных взаимодействий опять же важное место уделяется активации ренин-ангиотензиновой системы, снижению выработки оксида азота (NO) под воздействием высокого уровня МК, окислительному стрессу с эндотелиальной дисфункцией и депозицией МК в гладкомышечных клетках сосудистой стенки с последующей их пролиферацией и вторичным артериоангиосклерозом [10].
Другая теория постулирует вторичный характер ГУ на фоне АГ, в основе которой лежит нарушение экскреции уратов в результате снижения почечного кровотока. В конечном итоге сочетание ГУ и АГ приводит к более быстрому формированию и прогрессированию ХБП [11]. Еще одной немаловажной проблемой, которая в том числе отражается и на функции почек, является сочетание ГУ с сопутствующим метаболическим синдромом или СД [12]. Было показано, что гиперурикемия может быть независимым предиктором формирования ожирения, неалкогольной жировой болезни печени, метаболического синдрома и СД. В патогенезе этих нарушений ключевая роль отводится МК как прооксиданту, способному активировать процессы перекисного окисления в митохондриях и запускать воспаление в гепатоцитах и адипоцитах. Митохондриальный окислительный стресс способствует нарушению окисления жирных кислот в гепатоцитах, стимулирует липогенез, а также нарушает транслокацию GLUT4 в адипоцитах, что создает предпосылки для формирования инсулинорезистентности [13].
Таким образом, на данный момент известно множество механизмов гиперурикемического повреждения почек, что затрудняет зачастую как поиск основной причины ГУ, так и поиск оптимальной терапевтической тактики.
Важный аспект в практике врача – выявление причин вторичной ГУ или подагры (рис.). При умеренной ГУ в первую очередь обсуждается вопрос повышенного поступления МК, прежде всего за счет богатых пуринами продуктов – красного мяса, субпродуктов, наваристых бульонов, некоторых видов морской рыбы (сардина, сельдь, треска, форель), морепродуктов (панцирных), алкогольных напитков. Все больше внимания в этом контексте уделяют потреблению сладких напитков, содержащих фруктозу [6, 14].
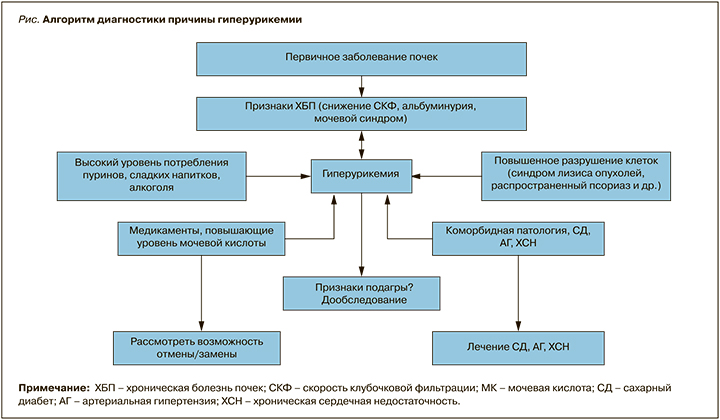
Значимая ГУ может наблюдаться при состояниях, сопровождающихся распадом тканей (синдром лизиса опухолей, распространенный псориаз), но одной из частых причин ее определенно является применение медикаментов, обладающих гиперурикемическим эффектом: диуретиков (тиазидов и фуросемида), иммуносупрессантов (циклоспорина, такролимуса), противотуберкулезных препаратов (пиразинамида, этамбутола), цитостатиков, никотиновой кислоты, ацетилсалициловой кислоты (60–300 мг), леводопы, витамина В12; также ее развитию может способствовать прием таких углеводов, как ксилит, сорбит, фруктоза [15, 16].
Таким образом, при выявлении ГУ очень важно использовать следующий диагностический алгоритм:
- оценить ее характер – первичный или вторичный (выявить возможные причины);
- исключить подагру: уточнить у пациента наличие в анамнезе суставного синдрома и при выявлении такового оценить его соответствие критериям подагры;
- оценить наличие критериев ХБП: вычислить скорость клубочковой фильтрации по формуле CKD-EPI, уровень протеинурии (соотношение альбумин/креатинин);
- оценить наличие коморбидной патологии (ССЗ, СД 2, метаболический синдром).
Добавим, что даже в случае ХБП и ССЗ следует обсудить возможные алиментарные причины ГУ.
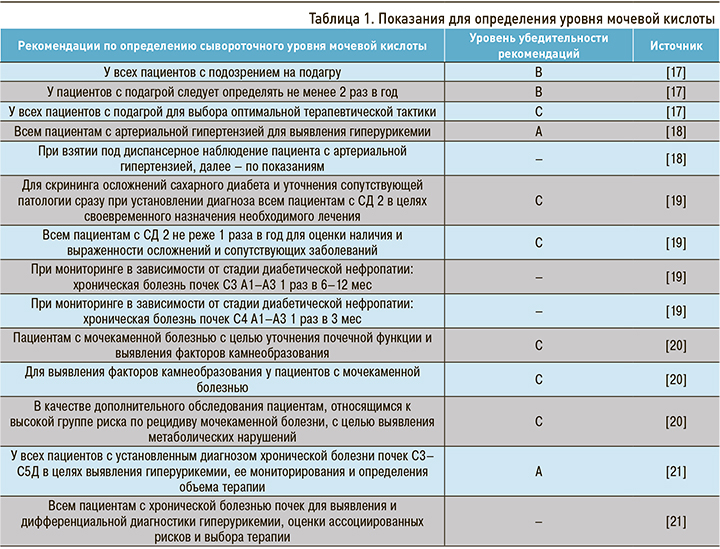
Учитывая многообразие причин развития ГУ и ее тесную связь с многими значимыми метаболическими заболеваниями, перед врачами возникает необходимость обозначить группы пациентов, нуждающихся в контроле уровня МК, для своевременной диагностики ГУ (табл. 1).
КОРРЕКЦИЯ ГИПЕРУРИКЕМИИ
Важным аспектом терапии пациентов как с бессимптомной ГУ, так и с подагрой является соблюдение диетических рекомендаций, которые направлены на исключение продуктов, повышающих уровень МК. В основе диеты неизменным на протяжении многих лет остается исключение животных продуктов, богатых пуринами (мяса, субпродуктов, морепродуктов, некоторых видов рыб), и алкоголя. Среди алкогольных напитков несколько большее влияние на уровень МК оказывает потребление пива за счет высокого содержания в нем пуринов, однако все же преимущественное значение имеет доза алкоголя, независимо от его вида [22]. В последние годы поменялось отношение к растительным продуктам, богатым пуринами: было показано, что потребление таких продуктов существенно не влияет на уровень МК. В ряде ситуаций потребление бобовых может снижать уровень МК, поскольку изофлавоны соевых бобов инактивируют ферменты, преобразующие гипоксантин в ксантин.
В диете пациентов с ГУ и подагрой предпочтение должно отдаваться свежим овощам, низкожировым молочным продуктам, бобовым, яйцам и в меньшей степени фруктам (возможно потребление несладких фруктов). Сладкие фрукты, богатые фруктозой, как и фруктовые соки, могут повышать уровень МК в крови. Среди фруктов и ягод наибольшее предпочтение отдается цитрусовым, вишне и вишневому соку. Последние исследования опровергают необходимость ограничений в приеме кофе и чая пациентами с подагрой и бессимптомной ГУ. Более того, риск развития подагры значительно ниже у мужчин, потребляющих более 6 чашек кофе в день; для женщин аналогичная корреляция наблюдается при потреблении 1–3 чашек этого напитка в течение дня. Тем не менее не следует забывать, что потребление кофе может быть фактором риска ХБП у пожилых пациентов [14, 22].
После обсуждения диетических рекомендаций врачу следует определиться с медикаментозным лечением. До сих пор немало дискуссий вызывает вопрос назначения уратснижающей терапии (УСТ). Для выбора тактики терапии врачу прежде всего необходимо определиться с группой пациентов: пациенты с бессимптомной ГУ или пациенты с подагрой (табл. 2).

К настоящему времени не доказана эффективность назначения УСТ при выявлении бессимптомной ГУ без сопутствующей коморбидной патологии. Рекомендуется оценка уровня МК и назначение УСТ пациентам с мочекаменной болезнью, имеющим высокий риск рецидива. Это прежде всего больные инфекциями мочевых путей с аномалиями развития мочевыделительной системы, а также лица с наличием генетических факторов и заболеваний, ассоциированных с камнеобразованием (гиперпаратиреоз, болезни желудочно-кишечного тракта, нефрокальциноз, прием высоких доз витамина D и др.) [20].
Достаточно ясно определены показания к УСТ при подагре: она назначается во всех случаях сочетания этого заболевания с коморбидными патологиях, при выявлении тофусов, частых рецидивах артрита, неэффективности диеты [17].
Несмотря на то, что в рекомендациях пациентам с СД, АГ содержатся указания проводить обязательный скрининг уровня МК сыворотки, в действующих гайдлайнах по лечению ССЗ четко не определены показания к УСТ при выявлении ГУ. Авторы считают возможным обратить внимание и рекомендовать к использованию данные Консенсуса по ведению пациентов с ГУ, в котором определен целевой уровень МК менее 300 мкмоль/л, рекомендованы изменение образа жизни (диета, ограничение алкоголя и т.д.) и оценка эффективности терапии основного заболевания; только при отсутствии эффекта от этих мери наличии ≥2 сердечно-сосудистых факторов риска (АГ, СД, ХБП, дислипидемия, недавно перенесенные острый инфаркт миокарда или инсульт) следует начинать УСТ [11]. Также следует обратить внимание на рекомендации по ведению пациентов с крайне высоким уровнем ГУ при подагре – более 535 мкмоль: согласно гайдлайнам Американской ассоциации ревматологов эта группа пациентов также нуждается в назначении УСТ [23].
В России сейчас представлены на фармрынке и широко используются два препарата для УСТ – аллопуринол (стартовая доза 100 мг) и фебуксостат (стартовая доза 40 мг). Препараты уриказы в нашей стране на данный момент не зарегистрированы.
Значительно реже используется препарат урикозурического действия пробенецид; при этом он не рекомендуется в качестве стартовой УСТ, а также при снижении скорости клубочковой фильтрации и мочекаменной болезни.
Противопоказания к УСТ включают беременность и лактацию ввиду отсутствия данных о безопасности ингибиторов ксантиноксидазы в этих случаях.
Несмотря на эффективность двух основных препаратов для УСТ, при применении фебуксостата отмечается более высокая эффективность и лучшая переносимость по сравнению с аллопуринолом, и именно он служит препаратом выбора в лечении пожилых пациентов или пациентов с ХБП [24].



