ВВЕДЕНИЕ
Гипертоническая церебральная микроангиопатия, сахарный диабет (СД) 2-го типа признаны независимыми факторами риска развития когнитивных нарушений, а их сочетание ускоряет и усиливает когнитивный дефицит у больных [1–3]. Наряду с этим лица с артериальной гипертензией и СД 2-го типа подвержены более высокому риску заболевания новой коронавирусной инфекцией (COVID-19) [4], которая также негативно сказывается на познавательной деятельности человека [5, 6].
В то же время характер влияния на когнитивные функции указанных заболеваний в случае их сочетания друг с другом изучен мало. Между тем прояснение этого вопроса имеет не только теоретическое, но и практическое значение, поскольку может повлиять на выбор стратегии терапии больных.
Цель исследования – определить влияние СД 2-го типа и перенесенного COVID-19 на выраженность и особенности когнитивных нарушений у пациентов с гипертонической церебральной микроангиопатией.
МАТЕРИАЛ И МЕТОДЫ
Исследование по методологии являлось клиническим ретроспективным наблюдательным. Обследовано 33 больных с гипертонической церебральной микроангиопатией (гЦМА; 1-я группа: 19 мужчин и 14 женщин, 59,8±11,2 лет, 35–80 лет), 30 больных с гЦМА и СД 2-го типа (2-я группа, 15 мужчин и 15 женщин, 63,9±7,6 лет, 46–77 лет) и 33 больных с гЦМА и СД 2-го типа, перенесших на протяжении предшествовавшего года COVID- 19 (3-я группа: 18 мужчин и 15 женщин, средний возраст 60,8±8,1 лет, 37–72 лет). Больные 1-й и 2-й групп наблюдались нами за год до начала пандемии COVID-19 и соответственно не имели указанной патологии в анамнезе.
Критериями включения в исследование являлись возраст от 35 до 80 лет, наличие клинически и нейровизуализационно верифицированной гЦМА, подписанное информированное согласие на проведение обследования и публикацию его результатов без указания имени.
Критериями невключения служили наличие онкологической патологии, тяжелая коморбидная соматическая и/или психическая патология, черепно-мозговая травма тяжелой или средней степени тяжести в анамнезе, инсульт, инфекционные и аутоиммунные заболевания центральной нервной системы, указания в анамнезе на нейродегенеративное заболевание головного мозга, а для больных 3-й группы также данные о перенесенном COVID- 19 более чем за 12 мес до настоящего исследования.
Исследование было одобрено локальным этическим комитетом ФГБОУ ВО «Приволжский исследовательский медицинский университет» Минздрава России.
Доказательствами перенесенного COVID-19 у больных 3-й группы являлись представленные больными данные медицинской документации, которые содержали указание на перенесенный на протяжении предшествовавших 1–12 мес COVID- 19, а именно: сведения о наличии у больного за предшествовавший год клинических проявлений острой респираторной инфекции в сочетании с положительным результатом лабораторного исследования на наличие РНК SARS-CoV-2 или антигена SARS-CoV-2.
Всем пациентам проводился соматический и клинико-неврологический осмотр, оценка когнитивных функций, нейровизуализационное исследование. При оценке соматического статуса учитывался стаж заболевания по СД 2-го типа (годы), наличие таких сопутствующих заболеваний, как артериальная гипертензия, фибрилляция предсердий и ожирение. Выполнялось клиническое нейропсихологическое исследование по методике А.Р. Лурия с дополнительным использованием Монреальской шкалы оценки когнитивных функций (англ. Montreal Cognitive Assessment, сокр. МоСА), Батареи лобной дисфункции (англ. Frontal Assessment Battery, сокр. FAB).
По данным МоСА, диагностировались отсутствие или легкие когнитивные нарушения (суммарный показатель 26–30 баллов) либо умеренные/выраженные когнитивные нарушения (суммарный показатель 25 и менее баллов). По результатам выполнения FAB, выраженная регуляторная дисфункция диагностировалась при суммарной оценке менее 12 баллов, умеренная – 12–15 баллов, легкая/отсутствие регуляторных нарушений – 16–18 баллов.
Для скрининговой диагностики тревожно-депрессивных расстройств использовалась Госпитальная шкала тревоги и депрессии (англ. Hospital Anxiety and Depression Scale, сокр. HADS).
Нейровизуализационное исследование проводилось на томографе General Electric Signa Infinity HiSpeed Plus (1,5 Тл), протокол которого включал следующие импульсные последовательности: Т2, Т1, FLAIR, T2*GRE (для верификации зон отложения дериватов гемоглобина). Степень выраженности поражения белого вещества полушарий головного мозга (гиперинтенсивность белого вещества, ГИБВ) оценивалась по модифицированной шкале Fazekas (1987): 0 – отсутствие ГИБВ, 1-я степень – единичные очаги, 2-я степень – наличие как единичных, так и частично сливных очагов, 3-я степень – сливные очаги.
Диагноз гЦМА устанавливался при наличии в анамнезе диагноза артериальной гипертензии, клинических и нейровизуализационных признаков церебральной микроангиопатии по данным магнитно-резонансной томографии (МРТ) с оценкой по критериям STandards for ReportIng Vascular changes on nEuroimaging (STRIVE) и причинно-следственной взаимосвязи между ними.
Статистический анализ проводился с использованием пакета прикладных программ BM SPSS Statistics 17.0 (IBM Corporation). Для определения нормальности распределения количественных данных использовался критерий Шапиро–Уилка. Для количественных показателей, имеющих гауссовское распределение, выполнялся расчет средних арифметических величин и стандартных отклонений (M±SD). В случае описания количественных данных, распределение которых не подчинялось закону нормального распределения, рассчитывалась медиана (Me) и интерквартильный размах в виде 25 и 75% процентилей (Ме [25–75]). Номинальные данные представлялись в виде абсолютных значений с расчетом процентных долей.
Для множественного сравнения (в трех группах) по одному количественному показателю, имеющему ненормальное распределение, либо порядковому показателю применялся критерий Краскела–Уоллиса, в случае нормального распределения данных – дисперсионный анализ (ANOVA).
Сравнение количественных признаков, подчиняющихся закону гауссовского распределения, в двух группах проводилось с использованием t-критерия, в случае ненормального распределения показателей – U-критерия Манна–Уитни. При множественном сравнении данных, когда возрастала вероятность возникновения ошибок первого рода, проводилась корректировка уровня значимости по методу Бенджамини–Хохберга. Анализ различий частот признаков в независимых выборках осуществлялся с помощью критерия Хи-квадрат и точного критерия Фишера. За критический уровнень значимости принималось значение p <0,050.
РЕЗУЛЬТАТЫ
Сравнительная характеристика пациентов 1–3-й групп исследования приведена в таблице. Участники в указанных трех группах статистически значимо не отличались по социодемографическим характеристикам, выраженности ГИБВ, тяжести тревоги и депрессии (по HADS), а также наличию таких сопутствующих заболеваний, как фибрилляция предсердий, избыточная масса тела. Пациенты 2-й и 3-й групп не имели значимых различий по длительности течения СД 2-го типа.
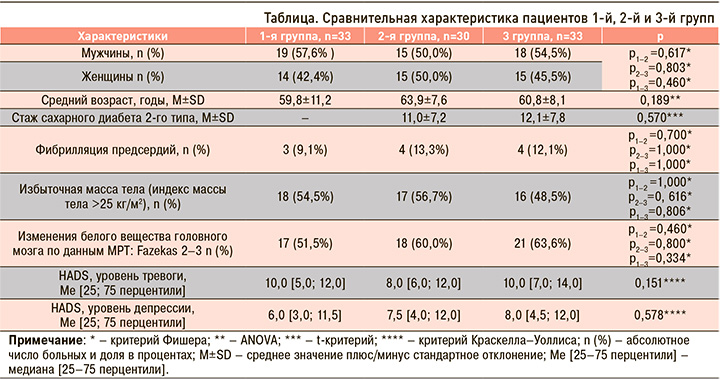
Суммарная оценка по МоСА составила в 1-й, 2-й и 3-й группах 27,0 [24,0; 27,5], 25,5 [23,0; 27,0], 23,0 [21,0; 24,0] балла соответственно, и эти показатели статистически значимо различались в сравниваемых группах (критерий Краскелла–Уоллиса, р=0,000).
Последующее попарное сравнение показателей МоСА у пациентов указанных групп при помощи критерия Манна–Уитни с поправкой по методу Бенджамини–Хохберга указало на статически значимо более выраженное снижение когнитивных функций у пациентов, перенесших на протяжении предшествовавшего года COVID-19 (рис. 1).
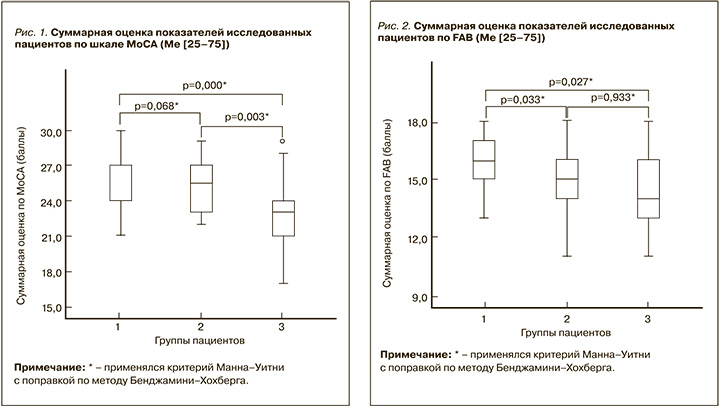
Показатель FAB в 1-й, 2-й и 3-й группах был равен 16,0 [15,0;17,0], 15,0 [14,0;16,0] и 15,0 [13,0;16,0] баллам соответственно. Было выявлено статистически значимое различие выраженности регуляторной дисфункции (оцененной по FAB) в исследуемых группах (критерий Краскела–Уоллиса, р=0,014). Результаты попарного сравнения групп показали, что пациенты с изолированной гЦМА имели статистически более высокий показатель по FAB, чем участники 2-й и 3-й групп (рис. 2).
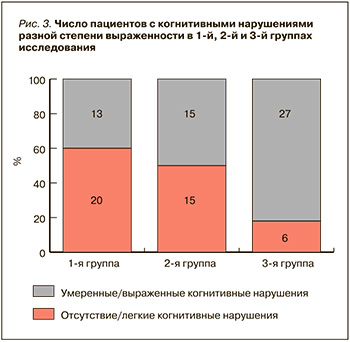
По данным анализа таблиц сопряженности, обнаружена статистически значимая связь между наличием умеренных/выраженных когнитивных нарушений по МоСА и принадлежностью больных к одной из трех указанных групп (Хи-квадрат=13,1, р=0,001). Попарное сравнение частоты встречаемости умеренных/выраженных когнитивных нарушений показало, что такие расстройства статистически значимо чаще выявлялись в 3-й группе пациентов, чем в 1-й и 2-й (р=0,001 и р=0,015 соответственно; рис. 3). До 82% пациентов с гЦМА и СД 2-го типа, перенесшие COVID-19 на протяжении предшествовавшего года, имели умеренные или выраженные когнитивные нарушения.
Сравнение исследуемых групп по субтестам МоСА свидетельствует, что пациенты с изолированной гЦМА (1-я группа) чаще безошибочно справлялись с заданиями, вовлекающими преимущественно произвольное внимание и регуляторные функции, а именно с субтестами «Создание альтернирующего пути» и «Повторение фразы», чем пациенты 2-й (р=0,041 и р=0,017 соответственно) и 3-й групп (р=0,032 и р=0,008 соответственно).
В то же время больные, перенесшие COVID- 19, по сравнению с пациентами 1-й и 2-й групп чаще допускали пространственные ошибки в субтесте «Зрительно-конструктивные навыки, Куб» (р=0,003 и р=0,019 соответственно) и имели более низкий балл в субтесте «Отсроченное воспроизведение» пяти слов (1,0 [0,0; 3,0] и 4,0 [3,0; 5,0], р=0,000, и 1,0 [0,0; 3,0] и 4,0 [2,5; 4,0], р=0,001 соответственно).
ОБСУЖДЕНИЕ
Когнитивные нарушения представляют важную медико-социальную проблему, существенно ограничивая трудоспособность пациентов и их независимость от посторонней помощи в повседневной жизни [1, 3]. В настоящее время доказано негативное влияние СД 2-го типа на когнитивные функции, связанное как с развитием микроангиопатии, так и непосредственным повреждением нейронов в условиях хронической гипергликемии [7–10]. В частности, установлено, что наличие сахарного СД 2-го типа у пожилых пациентов на 50% увеличивает риск развития деменции [11]. Снижение когнитивных функций при СД 2-го типа ассоциировано с возрастом, уровнем образования, длительностью диабета, недостаточным гликемическим контролем, высоким уровнем общего холестерина и триглицеридов в крови, ожирением и ретинопатией [3, 8, 9].
Полученные нами данные указывают на то, что при сочетании СД 2-го типа с гЦМА у больных имеется более выраженная регуляторная дисфункция по FAB, чем у пациентов с изолированной гЦМА. Это согласуется с установленными другими авторами фактами, согласно которым СД 2-го типа способствует снижению скорости обработки информации и нарушению регуляторных (управляющих) функций [3].
Выявленные различия в степени регуляторной дисфункции у пациентов с гЦМА и с гЦМА в сочетании с СД 2-го типа не могут быть объяснены большей интенсивностью сосудистого поражения головного мозга на фоне диабетической микроангиопатии, так как степень поражения белого вещества головного мозга по шкале Fazekas у пациентов разных групп статистически значимо не различалась. Не имели различий и уровни тревоги и депрессии у пациентов исследованных групп, поэтому этот фактор также не может объяснить выявленные различия оценок когнитивных функций. Полученные данные указывают на важность оценки у пациентов с сочетанием гЦМА и СД 2-го типа регуляторных функций, поскольку их нарушения негативно сказываются на повседневных навыках пациентов, и такого рода расстройства важно выявлять своевременно [12].
Анализ результатов МоСА свидетельствует о том, что перенесенный COVID-19 усугубляет когнитивные нарушения у больных с гЦМА в сочетании с СД 2-го типа. К настоящему времени опубликовано достаточно много работ, указывающих на развитие когнитивных нарушений после перенесенного COVID-19. По данным разных авторов, распространенность когнитивной дисфункции после COVID-19 варьирует от 21 до 80% в зависимости от возраста пациентов, давности и тяжести перенесенной инфекции [13–15].
В нашей работе обращает на себя внимание тот факт, что перенесшие новую коронавирусную инфекцию больные с гЦМА, как изолированной, так и сочетавшейся с СД 2-го типа, имели более выраженные зрительно-пространственные и мнестические нарушения, чем пациенты без COVID- 19 в анамнезе.
В этом плане интерес представляют результаты метанализа Premraj L. et al. (2022) и проспективного исследования Mendez R. et al. (2022), указывающие на преобладание нарушений памяти в структуре постковидного когнитивного дефицита [13, 16]. Эти данные могут обсуждаться в контексте гипотезы, согласно которой COVID-19, вызывая системное воспаление, окислительный стресс, прямую вирусную инвазию и прямое цитолитическое повреждение β-клеток, повышает риск развития болезни Альцгеймера [12, 17], сопровождающейся нарушениями памяти и пространственной ориентировки. СД 2-го типа также в 1,5 раза увеличивает риск болезни Альцгеймера [2]. В связи с этим целесообразно осуществлять динамическое наблюдение за зрительно-пространственными навыками и памятью у перенесших новую коронавирусную инфекцию больных с гЦМА в сочетании с СД-го 2 типа для своевременной диагностики прогрессирующего снижения этих функций как раннего признака нейродегенеративного заболевания головного мозга.
Ограничением нашего исследования стало относительно небольшое число обследованных больных, отсутствие учета давности (в месяцах) перенесенной новой коронавирусной инфекции и ее тяжести, а также характера осложнений СД 2-го типа и коморбидных СД 2-го типа метаболических расстройств, способных негативно влиять на когнитивный статус пациентов. Эти ограничения планируется преодолеть в последующих исследованиях.
ЗАКЛЮЧЕНИЕ
СД 2-го типа приводит к нарастанию регуляторной дисфункции у больных с гЦМА. Перенесенный COVID-19 усугубляет когнитивные расстройства у больных с сочетанием гЦМА и СД 2-го типа. Почти 82% пациентов с гЦМА и СД 2-го типа, перенесших на протяжении предшествовавшего года новую коронавирусную инфекцию, имеют умеренные или выраженные когнитивные нарушения по шкале МоСА. Нарастание когнитивного дефицита у этой категории пациентов происходит прежде всего за счет ухудшения зрительно-пространственных и мнестических функций.



