ЭПИДЕМИОЛОГИЯ ВНЕБОЛЬНИЧНОЙ ПНЕВМОНИИ
Внебольничная пневмония (ВП) до настоящего времени является «краеугольным камнем» практического здравоохранения вследствие высокой заболеваемости и смертности. Результаты эпидемиологических исследований свидетельствуют о том, что в общей популяции заболеваемость ВП составляет 1–12‰, а среди лиц старше 65 лет – 25–44‰ [1]. В США было проведено глобальное исследование, включившее данные о 388 406 госпитализированных пациентах с ВП в течение 2004–2005 гг. [2]. Распространенность ВП варьировалась от 0,33 на 1000 жителей у лиц молодого возраста до 35,8 на 1000 населения среди пожилых людей старше 90 лет. Распространенность ВП, требующей госпитализации, составила в среднем 2,75 и 2,96 на 1000 жителей в год в 2005 и 2006 гг. соответственно, а заболеваемость у лиц старше 60 лет достигала 7,65‰ у пациентов в возрасте старше 60 лет. Таким образом, в США ежегодно переносит ВП более 5 млн человек. В Германии общее число ежегодно регистрируемых случаев ВП оценивается в пределах от 400 тыс. до 600 тыс. пациентов в год, при этом необходимость в госпитализации составляет 30–50% [3]. Доступные данные по заболеваемости ВП в странах Евросоюза свидетельствуют о том, что ежегодно общее число взрослых больных ВП в 5 европейских странах (Великобритания, Франция, Италия, Германия, Испания) превышает 3 млн человек [1]. В России официальная статистика учитывает 400–500 тыс. больных ВП в год. Например, в 2015 г. уровень заболеваемости ВП в Российской Федерации составил 337,77 на 100 тыс. населения, а в 2016 г. – 418,18, у детей до 17 лет в 2015 г. – 600,08 на 100 тыс. населения, в 2016 г. – 688,81. В то же время результаты отдельных эпидемиологических исследований и расчетные данные позволяют предположить, что реальная заболеваемость ВП в России составляет 14–15‰, а общее число больных ежегодно превышает 1 500 000 человек. Кроме того, следует принимать во внимание высокую заболеваемость ВП у отдельных категорий, например военнослужащих по призыву. Так, по доступным данным, заболеваемость ВП у военнослужащих по призыву достигает 30–40‰ [5–6].
 Важнейшей проблемой остается высокая летальность при пневмонии. До настоящего времени инфекции нижних дыхательных путей (пневмония, грипп) занимают 3-е место среди ведущих причин смерти от различных заболеваний, уступая лишь инфарктам и сосудистым катастрофам, забирая на себя более 3 млн летальных исходов по всему миру. В России из числа госпитализированных по поводу пневмонии пациентов в среднем умирают около 3–4% [1].
Важнейшей проблемой остается высокая летальность при пневмонии. До настоящего времени инфекции нижних дыхательных путей (пневмония, грипп) занимают 3-е место среди ведущих причин смерти от различных заболеваний, уступая лишь инфарктам и сосудистым катастрофам, забирая на себя более 3 млн летальных исходов по всему миру. В России из числа госпитализированных по поводу пневмонии пациентов в среднем умирают около 3–4% [1].
ЭТИОЛОГИЯ ВП
Основным возбудителем ВП до настоящего времени является Streptococcus pneumoniae (30–50% случаев заболевания). К более редким (3–5%) «типичным» возбудителям ВП (3–5%) относятся Haemophilus influenzae, Staphylococcus aureus и Klebsiella pneumoniae (реже другие энтеробактерии – Escherichia coli и др.) [7–9]. Для амбулаторной практики определенное значение имеют «атипичные» микроорганизмы (8–30% случаев нетяжелой ВП) – Chlamydophila pneumoniae, Mycoplasma pneumoniae. А при тяжелом течении ВП существует вероятность инфицирования Legionella pneumophila. В ряде случаев ВП может вызывать Pseudomonas aeruginosa (у больных муковисцидозом, бронхоэктатической болезнью, лиц с иммунодефицитами). Нередко (~50%) у взрослых пациентов, переносящих ВП, выявляют два и более возбудителей, чаще всего это сочетание пневмококка с микоплазменной или хламидийной инфекцией, что утяжеляет течение заболевания.
 Пневмония может быть вызвана респираторными вирусами (вирусы гриппа типа А и B, парагриппа, аденовирусная инфекция, респираторно-синцитиальный вирус и др.). Частота выявления респираторных вирусов у пациентов с ВП носит сезонный характер и возрастает в холодное время года. Рост актуальности вирусной пневмонии в последние годы обусловлен появлением и распространением в популяции пандемического вируса гриппа A/H1N1pdm2009, способного вызывать первичное поражение легочной ткани с развитием острого респираторного дистресс-синдрома и быстро прогрессирующей острой дыхательной недостаточности (ОДН). Различают первичную вирусную пневмонию (развивается в результате непосредственного вирусного поражения легких, характеризуется быстро прогрессирующим течением с развитием выраженной ОДН) и вторичную бактериальную пневмонию (вирусно-бактериальная пневмония), которая может сочетаться с первичным вирусным поражением легких или быть самостоятельным поздним осложнением гриппа [10]. Наиболее частыми возбудителями вторичной бактериальной пневмонии у пациентов с гриппом являются S. pneumoniae и S. aureus [10–12].
Пневмония может быть вызвана респираторными вирусами (вирусы гриппа типа А и B, парагриппа, аденовирусная инфекция, респираторно-синцитиальный вирус и др.). Частота выявления респираторных вирусов у пациентов с ВП носит сезонный характер и возрастает в холодное время года. Рост актуальности вирусной пневмонии в последние годы обусловлен появлением и распространением в популяции пандемического вируса гриппа A/H1N1pdm2009, способного вызывать первичное поражение легочной ткани с развитием острого респираторного дистресс-синдрома и быстро прогрессирующей острой дыхательной недостаточности (ОДН). Различают первичную вирусную пневмонию (развивается в результате непосредственного вирусного поражения легких, характеризуется быстро прогрессирующим течением с развитием выраженной ОДН) и вторичную бактериальную пневмонию (вирусно-бактериальная пневмония), которая может сочетаться с первичным вирусным поражением легких или быть самостоятельным поздним осложнением гриппа [10]. Наиболее частыми возбудителями вторичной бактериальной пневмонии у пациентов с гриппом являются S. pneumoniae и S. aureus [10–12].
Этиологическая структура ВП может различаться в зависимости от возраста больных, тяжести заболевания, наличия сопутствующей патологии и предшествующей системной антибиотикотерапии. Так, ключевыми возбудителями нетяжелой ВП у пациентов без сопутствующих заболеваний и не принимавших в последние 3 мес антибактериальных препаратов чаще всего являются пневмококк, «атипичные» микроорганизмы и их сочетания. У больных нетяжелой ВП, принимавших в последние 3 мес антибактериальные препараты и/или имеющих сопутствующую патологию (хроническую обструктивную болезнь легких – ХОБЛ, сахарный диабет, сердечную недостаточность, хроническую почечную недостаточность, заболевания печени, алкоголизм, наркоманию, дефицит массы тела), помимо S. pneumoniae и C. Pneumoniae, возрастает роль таких возбудителей, как H. influenzae, S. aureus и K. pneumoniae, в том числе штаммов, обладающих механизмами антибиотикорезистентности.
 ДИАГНОСТИКА ВП
ДИАГНОСТИКА ВП
Подозрение на пневмонию должно возникать при наличии у больного лихорадки в сочетании с жалобами на кашель, одышку, отделение мокроты и боли в груди.
Классическими объективными признаками ВП являются укорочение (тупость) перкуторного звука над пораженным участком легкого, фокус звучных мелкопузырчатых хрипов или крепитации, усиление бронхофонии и голосового дрожания. Обязательным при подозрении на ВП является проведение обзорной рентгенографии органов грудной полости в передней прямой и боковой проекциях. При выявлении нетипичной для пневмонии рентгенологической картины (обтурационный ателектаз, деструктивные изменения, признаки инфаркт-пневмонии при тромбоэмболии легочной артерии) либо, напротив, при отсутствии изменений на рентгенограмме у пациента с очевидной клинической симптоматикой пневмонии целесообразно выполнение компьютерной томографии.
Помимо сбора анамнеза, физического обследования и рентгенографии органов грудной клетки на поликлиническом уровне, необходимо выполнять общий анализ крови (лейкоцитоз более 10–12x109/л указывает на высокую вероятность бактериальной инфекции; лейкопения ниже 3x109/л или лейкоцитоз выше 25x109/л являются неблагоприятными прогностическими признаками) и пульсоксиметрию (SpO2 менее 90% является признаком ОДН).
Кроме того, перспективным с практической точки зрения является определение у всех пациентов с предполагаемой по клиническим данным пневмонией уровня С-реактивного белка (СРБ) [9, 13]. Диагноз пневмонии следует считать вероятным при значении уровня СРБ>100 мг/л, а низкий уровень СРБ (<20 мг/л) делает данный диагноз маловероятным. Промежуточные данные диктуют необходимость дообследования пациента для установления диагноза (рентгенография органов грудной клетки и пр.).
На поликлиническом уровне диагностический минимум должен включать исследования, позволяющие установить диагноз ВП и решить вопрос о тяжести течения и необходимости госпитализации пациента. С этой целью проводится сбор анамнеза, физическое обследование больного, рентгенография органов грудной клетки, пульсоксиметрия, анализ крови с определением числа лейкоцитов с подсчетом лейкоцитарной формулы, а также при наличии возможностей определение уровня СРБ количественным способом. Микробиологическая диагностика, как правило, не проводится, так как не оказывает существенного влияния на выбор антибактериального препарата.
Одним из наиболее важных вопросов является определение места лечения пациента:
- амбулаторно, в домашних условиях;
- в стационаре в палате общего профиля;
- в условиях отделения реанимации и интенсивной терапии (ОРИТ).
С учетом современных подходов к ведению взрослых пациентов с ВП около 70% больных могут с успехом лечиться на дому. К преимуществам амбулаторного лечения стоит отнести комфортность для пациента и минимизацию риска развития нозокомиальных инфекций. Также необходимо помнить, что решение о госпитализации пациента сопровождается значительным увеличением экономических расходов, поскольку стоимость стационарного лечения пневмонии в десятки раз превышает затраты на амбулаторное ведение больных ВП.

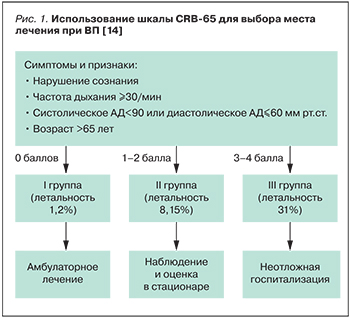
Помочь разобраться врачу в данном вопросе призваны так называемые критерии, или показания, к госпитализации, а также ряд специализированных шкал, количественно стратифицирующих по тяжести состояния и дальнейшему прогнозу пациентов с ВП. С практической точки зрения наиболее простыми и доступными для рутинного использования являются прогностические шкалы CURB-65 и CRB-65 [14]. В их основе лежит модифицированная шкала Британского торакального общества, предполагающая оценку 5 и 4 параметров соответственно. Пример использования шкалы СRB-65, не требующей определения каких-либо лабораторных показателей, представлен на рис. 1.
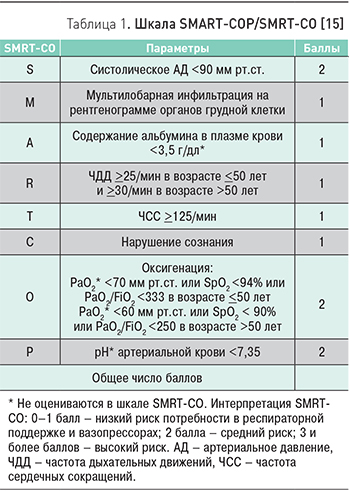
 На этапе приемных отделений стационаров наиболее оптимальным инструментом прогноза с возможностью определения необходимости госпитализации в ОРИТ является шкала SMRT-CO (табл. 1) [15–16]. В случае диагностирования нетяжелой пневмонии (отсутствие критериев тяжелого течения, 2 и менее баллов по шкале SMRT-CO) пациента следует госпитализировать в отделение общего профиля (общетерапевтическое, пульмонологическое).
На этапе приемных отделений стационаров наиболее оптимальным инструментом прогноза с возможностью определения необходимости госпитализации в ОРИТ является шкала SMRT-CO (табл. 1) [15–16]. В случае диагностирования нетяжелой пневмонии (отсутствие критериев тяжелого течения, 2 и менее баллов по шкале SMRT-CO) пациента следует госпитализировать в отделение общего профиля (общетерапевтическое, пульмонологическое).
Хотелось бы отметить, что внедрение описанных выше прогностических шкал при ВП позволяет сократить частоту необоснованных госпитализаций среди пациентов с низким риском неблагоприятного прогноза, а также выделить категорию лиц, нуждающихся в интенсивной терапии. Однако прогностические шкалы не рассматривают такие факторы, как декомпенсация сопутствующих хронических заболеваний, вариабельность клинической картины и возможность быстрого прогрессирования заболевания, немедицинские показания к госпитализации [1]. В связи с этим количественные значения шкал могут играть вспомогательную роль при выборе места лечения, но в каждом конкретном случае этот вопрос должен решаться врачом индивидуально. Стоит заметить, что у лиц молодого возраста возможности шкалы CRB-65 чрезвычайно ограничены [16].
АНТИБАКТЕРИАЛЬНАЯ ТЕРАПИЯ
Основными ориентирами при выборе тактики антибактериальной терапии (АБТ) являются анализ клинико-эпидемиологической ситуации (наиболее вероятные возбудители ВП), региональная ситуация по антибиотикорезистентности, оценка безопасности применения антибиотика, его фармакокинетические характеристики, приверженность больного лечению.
 При анализе клинико-эпидемиологической ситуации ведущее значение приобретает тщательное изучение анамнеза, позволяющее в ряде случаев актуализировать возбудителей пневмонии (табл. 2) и соответственно проводить целенаправленную этиотропную АБТ.
При анализе клинико-эпидемиологической ситуации ведущее значение приобретает тщательное изучение анамнеза, позволяющее в ряде случаев актуализировать возбудителей пневмонии (табл. 2) и соответственно проводить целенаправленную этиотропную АБТ.
Следующим важным моментом является оценка региональной ситуации по антибиотикорезистентности ключевых возбудителей пневмонии и выявление факторов риска инфицирования антибиотикорезистентными и высоковирулентными микроорганизмами (рис. 2).
Как уже было отмечено, основным возбудителем ВП является S. pneumoniae – 30–50% случаев заболевания [8–9]. Кроме того, для пневмококковой пневмонии характерны нередкое развитие бактериемии, высокая летальность. Стоит отметить, что в последние годы актуальной проблемой является распространение среди пневмококков штаммов со сниженной чувствительностью к β-лактамным антибиотикам и рост устойчивости к макролидам [18]. Как показывает отечественное многоцентровое исследование Церебрус, уровень устойчивости пневмококков к пенициллину, цефалоспоринам III поколения и эритромицину в 2011–2012 гг. составил 3,8, 2,8 и 15,4% соответственно, и данная негативная тенденция будет усугубляться с течением времени [19]. Согласно данным другого исследования, проводившегося в 5 европейских странах, частота выявления штаммов S. pneumoniae, не чувствительных к амоксициллину, азитромицину и кларитромицину, составила 8,1, 43,2 и 43,2% соответственно [20].
 Таким образом, в стартовой терапии ВП приоритетное место до настоящего времени занимают β-лактамные антибиотики. Это связано с высокой бактерицидной активностью против пиогенных возбудителей ВП и невысокими цифрами устойчивости микроорганизмов к аминопенициллинам. В связи с этим во всех клинических рекомендациях различных международных и национальных сообществ, вышедших в последние годы, приоритет в стартовой терапии ВП отдается β-лактамам [21–24]. Эксперты Всемирной организации здравоохранения относят β-лактамы к препаратам первой линии при ВП и предлагают использовать амоксициллин, амоксициллин/клавуланат в качестве препаратов выбора (ключевых препаратов) для эмпирической терапии нетяжелой ВП [25].
Таким образом, в стартовой терапии ВП приоритетное место до настоящего времени занимают β-лактамные антибиотики. Это связано с высокой бактерицидной активностью против пиогенных возбудителей ВП и невысокими цифрами устойчивости микроорганизмов к аминопенициллинам. В связи с этим во всех клинических рекомендациях различных международных и национальных сообществ, вышедших в последние годы, приоритет в стартовой терапии ВП отдается β-лактамам [21–24]. Эксперты Всемирной организации здравоохранения относят β-лактамы к препаратам первой линии при ВП и предлагают использовать амоксициллин, амоксициллин/клавуланат в качестве препаратов выбора (ключевых препаратов) для эмпирической терапии нетяжелой ВП [25].
С учетом этих данных у пациентов с нетяжелой ВП, не имеющих факторов риска неэффективности терапии (больные без сопутствующих заболеваний и не принимавших за последние 3 мес системных антимикробных препаратов – АМП ≥2 дней), препаратом выбора является амоксициллин. При аллергии на β-лактамы применяются макролиды или респираторные фторхинолоны. В районах с высоким (>25%) уровнем устойчивости S. pneumoniae к макролидам следует рассмотреть возможность применения альтернативных режимов терапии (респираторные фторхинолоны).
У пациентов с нетяжелой ВП, имеющих факторы риска неэффективности терапии1 (табл. 3), препаратами выбора являются «защищенные» аминопенициллины (амоксициллин/клавуланат). Альтернативой в данной ситуации может быть применение «респираторных» фторхинолонов (левофлоксацин, моксифлоксацин).
У госпитализированных пациентов целесообразно начинать терапию с парентеральных антибиотиков (табл. 4). Через 2–4 дня лечения при нормализации температуры, уменьшении интоксикации и других симптомов заболевания возможен переход с парентерального на пероральное применение антибиотика до завершения полного курса лечения (ступенчатая терапия). При нетяжелом течении ВП у госпитализированных больных, особенно в случае госпитализации по немедицинским показаниям, допускается сразу назначение антибиотиков внутрь.
В качестве стартовой терапии рекомендовано применение цефалоспоринов III поколения (цефотаксим, цефтриаксон), ампициллина, ингибиторозащищенных аминопенициллинов (амоксициллин/клавуланат). Альтернативным режимом является применение «респираторных» фторхинолонов (моксифлоксацин, левофлоксацин) в режиме ступенчатой терапии.
Выбор режима эмпирической АБТ тяжелой ВП зависит от наличия факторов риска инфицирования P. aeruginosa, предполагаемой аспирации, клинических и/или эпидемиологических данных, свидетельствующих об инфицировании вирусами гриппа [4]. Препаратами выбора являются ингибиторозащищенные аминопенициллины, цефалоспорины III поколения без антисинегнойной активности (цефтриаксон, цефотаксим), цефепим, цефтаролин или эртапенем, которые должны назначаться в комбинации с макролидом для внутривенного введения (табл. 5). Альтернативным режимом эмпирической антибиотикотерапии тяжелой ВП без дополнительных факторов риска является комбинация респираторного фторхинолона (моксифлоксацин, левофлоксацин) с цефалоспорином III поколения (цефотаксим, цефтриаксон).
 При тяжелой ВП назначение антибиотиков должно быть неотложным; отсрочка c началом лечения на 4 ч и более существенно ухудшает прогноз. Стартовая антибиотикотерапия тяжелой ВП в обязательном порядке предполагает внутривенное (в/в) введение препарата. По мере клинической стабилизации пациента возможна реализация стратегии ступенчатой терапии.
При тяжелой ВП назначение антибиотиков должно быть неотложным; отсрочка c началом лечения на 4 ч и более существенно ухудшает прогноз. Стартовая антибиотикотерапия тяжелой ВП в обязательном порядке предполагает внутривенное (в/в) введение препарата. По мере клинической стабилизации пациента возможна реализация стратегии ступенчатой терапии.
У пациентов с факторами риска инфицирования Paeruginosa препаратами выбора являются β-лактамные антибиотики с антисинегнойной активностью (пиперациллин/тазобактам, цефепим, меропенем, имипенем) в сочетании ципрофлоксацином или левофлоксацином в дозе 1 г/ сут; β-лактамы с антисинегнойной активностью могут комбинироваться с аминогликозидами II–III поколений и макролидами либо с респираторными фторхинолонами.
При документированной/предполагаемой аспирации препаратами выбора являются ингибиторозащищенные β-лактамы, карбапенемы либо комбинация цефалоспорина III поколения без антисинегнойной активности с клиндамицином или метронидазолом.
В дополнение к антимикробной терапии у пациентов с клиническими симптомами, предполагающими инфицирование вирусами гриппа, рекомендуется эмпирическое применение ингибиторов нейраминидазы. Противовирусные препараты (осельтамивир, занамивир) могут назначаться эмпирически пациентам с ВП, находящимся в критическом состоянии в период сезонного подъема заболеваемости гриппом в регионе (терапию целесообразно отменить в случае отрицательного результата исследования респираторных образцов на грипп методом полимеразной цепной реакции).
Критерии эффективности АБТ
Первоначальная оценка эффективности АБТ должна проводиться через 48–72 ч после начала лечения. Основными критериями эффективности в эти сроки являются снижение температуры тела, выраженности интоксикации, дыхательной и полиорганной недостаточности. Если у пациента сохраняются высокая лихорадка и интоксикация, прогрессируют симптомы заболевания или развиваются осложнения, антибиотикотерапия расценивается как неэффективная. В этом случае необходимо модифицировать/поменять выбранный режим терапии. В обязательном порядке необходимо тщательно пересмотреть анамнестические, эпидемиологические и клинико-рентгенологические данные, что позволит уточнить альтернативную этиологию заболевания, провести дообследование больного для уточнения диагноза или выявления возможных осложнений ВП (рентгенография, компьютерная томография, ультразвуковое исследование плевральных полостей, фибробронхоскопия, эхокардиография, осмотр ЛОР-специалистом и пр.) и проанализировать результаты доступных к этому моменту микробиологических исследований [17].
Продолжительность АБТ
При нетяжелой ВП АБТ может быть завершена по достижении стойкой нормализации температуры тела, наблюдаемой в течение 3 сут, при положительной динамике других симптомов заболевания. При таком подходе длительность лечения составляет 7–10 дней [1]. В случае наличия клинических и/или эпидемиологических данных о микоплазменной или хламидийной этиологии ВП продолжительность терапии (макролиды, «респираторные» фторхинолоны) должна составлять 14 дней.
При тяжелой ВП неуточненной этиологии рекомендован 10-дневный курс АБТ (выбор оптимальной продолжительности лечения определяется индивидуально). Более длительные курсы лечения (14–21 день) рекомендуются при развитии осложнений заболевания (эмпиема, абсцесс), наличии внелегочных очагов инфекции, инфицировании такими возбудителями, как S. aureus, Legionella spp., P. aeruginosa, K. pneumoniae. Длительность применения противовирусных препаратов (осельтамивир, занамивир) обычно составляет 5–10 дней.
При решении вопроса об отмене антибиотика рекомендуется руководствоваться следующими основными критериями [1, 4, 6]:
- температура <37,5 ºС в течение 3 последовательных суток;
- частота дыхания менее 20 в минуту;
- число лейкоцитов в крови <10×109/л, нейтрофилов <80%, юных форм <6%;
- уровень СРБ менее 20 мг/л;
- отсутствие гнойной мокроты;
- положительная динамика на рентгенограмме.
Сохранение отдельных клинических, лабораторных или рентгенологических признаков ВП не является абсолютным показанием к продолжению антибиотикотерапии или ее модификации. Однако в случае длительно сохраняющейся клинической, лабораторной и рентгенологической симптоматики необходимо провести дифференциальную диагностику ВП с другими заболеваниями.
Ступенчатая АБТ ВП
Ступенчатая АБТ предполагает 2-этапное применение антибиотиков: начало лечения с парентеральных препаратов с последующим переходом на их пероральный прием сразу после стабилизации клинического состояния пациента. Оптимальным вариантом ступенчатой АБТ является последовательное использование двух лекарственных форм (для парентерального введения и приема внутрь) одного и того же антибиотика, что обеспечивает преемственность лечения. Возможно последовательное применение препаратов, близких по своим антимикробным свойствам и с одинаковым уровнем приобретенной устойчивости.
Критериями перехода с парентерального на пероральный прием антибиотика являются:
- нормальная температура тела (<37,5 ºC) при двух измерениях с интервалом 8 ч;
- уменьшение одышки;
- отсутствие нарушения сознания;
- положительная динамика других симптомов заболевания;
- отсутствие нарушений всасывания в желудочно-кишечном тракте;
- согласие (настроенность) пациентов на пероральное лечение.
На практике возможность перехода на пероральный способ введения антибиотика появляется в среднем через 2–3 дня после начала лечения.
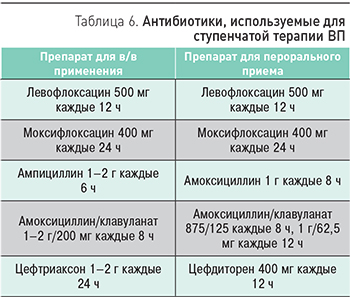
Для ступенчатой АБТ используют следующие антибиотики: амоксициллин/клавуланат, левофлоксацин, моксифлоксацин (табл. 6).
Для некоторых антибиотиков, не имеющих лекарственных форм для перорального применения, возможна замена на близкие по антимикробному спектру препараты (например, ампициллин → амоксициллин, цефтриаксон → цефдиторен).



