1) Yakutsk Scientific Center for Complex Medical Problems;
2) M.K. Ammosov North-Eastern University, Yakutsk
Abstract. Numerous studies indicate that BDNF may play an important role in energy homeostasis, in the regulation of food intake, and in the peripheral regulation of metabolism.
The aim of the research was to search for the correlation between single nucleotide polymorphism c.189G> A p. (Val66Met) of the BDNF gene and the levels of circulating in blood leptin in Yakut population.
Material and methods. Study sample consisted of 281 persons (186 females and 95 males), the average age of the participants was 19,8±1,5 years. The sample was stratified by sex and subdivided according to body mass index (BMI) into three groups: underweight (n=37), normal weight (n=215), and overweight/obesity (n=29) group.
Results. In the Yakut population, the frequency of the major allele p. (Val66) was 84,9%, the minor allele p. (Met66) – 15,1%. Due to the low frequency of distribution of homozygotes p. [Met66]; [Met66] and heterozygote p. [Val66]; [Met66], in the analysis, these two genotypes were combined into one group p. [Val66]; [Met66] + p. [Met66]; [Met66]. As a result, an association of the genotypes of p. [Val66]; [Met66] + p. [Met66]; [Met66] with decreased serum leptin levels in normal weight females (p=0,01). In males with normal weight, there was a tendency towards a decrease in leptin level in carriers of the genotypes p. [Val66]; [Met66] + p. [Met66]; [Met66] (3,83±0,85 ng/ml) comparatively with homozygotes p. [Val66]; [Val66] (5,58±0,93 ng/ml; p=0,09).
Conclusion. Our results indicate that individuals with p. (Met66) allele probably may have an impaired signaling pathway of leptin through BDNF in the ventromedial hypothalamic nucleus. According to this assumption, carriers of the p. (Met66) allele may have a decreased appetite since their birth time, which leads to a decrease in the amount of consumed foos and an increase in the use of fats in energy metabolism. This, in turn, reduces the accumulation of normal amounts of adipose tissue required for leptin production and is a risk factor for the development of eating disorders associated with anorexia nervosa and bulimia nervosa.
BDNF
p. 189G> A p. (Val66Met)
leptin
Yakuts
body mass index
ВВЕДЕНИЕ
Ген BDNF кодирует белок нейротрофический фактор мозга (BDNF) [1, 2], который принадлежит к суперсемейству нейротрофинов [3] и экспрессируется в центральной нервной системе (ЦНС) [4]. К основным функциям BDNF относятся поддержание выживания существующих нейронов, дифференцировка и стимулирование роста новых нейронов и синапсов [5, 6]. Многочисленные исследования показывают, что BDNF может играть важную роль в энергетическом гомеостазе, в регуляции потребления пищи [7, 8] и в периферической регуляции метаболизма [9].
Одним из наиболее функционально значимых полиморфизмов гена BDNF является однонуклеотидный полиморфизм с.189G>A, также известный как G189A или rs6265, который приводит к замене аминокислоты валина (Val) на метионин (Met) в 66 кодоне; эта замена нарушает внутриклеточную сортировку белка BDNF и его наличие в синаптической щели [10]. Данный полиморфизм ассоциирован с течением и развитием различных неврологических и психических расстройств, в том числе его связывают с расстройствами пищевого поведения, такими как нервная анорексия и нервная булимия [11]. В исследовании Gratocos M. et al. [12] было выявлено, что у лиц с генотипами p.[Val66]; [Met66] и p.[Met66]; [Met66] риск развития расстройств пищевого поведения увеличивается до 33%. Однако точная роль полиморфизма с.189G>A p.(Val66Met) в формировании предрасположенности к расстройствам пищевого поведения изучена недостаточно. Так, в нескольких исследованиях были установлены ассоциации генотипов p.[Val66]; [Met66] и p.[Met66]; [Met66] с вероятностью развития данных заболеваний [11–14], но в других исследованиях таких ассоциаций обнаружено не было [15–19].
Лептин – это пептидный гормон, вырабатываемый адипоцитами [20, 21]. Наиболее известное действие лептина – модулирование потребления пищи [22–24], регулирование массы тела и энергетического гомеостаза [25–27]. В нескольких исследованиях, проведенных на мышах, была продемонстрирована взаимосвязь лептина и BDNF. В исследовании Wang P. et al. [28] на мышах с дефицитом лептина ob/ob было показано, что при делеции гена BDNF притупляется влияние лептина на иннервацию жировой ткани. Оказалось, что при лечении лептином у мышей ob/ob повышаются общие уровни мРНК BDNF [29]. В исследовании Monteleone P. et al. [30] было продемонстрировано, что BDNF и лептин могут дополнительно участвовать в модуляции процессов вознаграждения и мотивирования на поощрение употребления высококалорийной пищи, богатой углеводами или жирами. В связи с этим целью данного исследования стал поиск ассоциации полиморфизма с.189G>A p.(Val66Met) гена BDNF с уровнем лептина в случайной выборке якутов молодого возраста с учетом индекса массы тела (ИМТ).
МАТЕРИАЛ И МЕТОДЫ
В исследование были включены 281 человек (186 женщин и 95 мужчин), средний возраст которых составил 19,8±1,5 лет. Все участники – этнические якуты, которые были здоровы во время исследования и прошли анкетирование с указанием пола, национальности и возраста. Выборку составили лица, не предъявлявшие жалобы на состояние здоровья и не состоящие на диспансерном учете по хроническим заболеваниям. Все обследуемые дали письменное информированное согласие на участие в исследовании и обработку персональных данных. Данная работа была одобрена локальным этическим комитетом по биомедицинской этике при Якутском научном центре комплексных медицинских проблем (г. Якутск, протокол № 16 от 13 декабря 2014 г.).
Венозная кровь для исследования забиралась утром после 12-часового голодания у всех участников. Антропометрические показатели (масса тела в килограммах, рост в сантиметрах) измерялись у всех участников по стандартизованным методам. ИМТ рассчитывали делением массы тела на квадрат роста. Общая выборка была разделена на три группы согласно классификации Всемирной организации здравоохранения (ВОЗ): с дефицитом веса (≤18,4 кг/м2; n=37), с нормальным весом (18,5–24,99 кг/м2; n=215), с избыточной массой тела/ожирением (≥25 кг/м2; n=29). Для определения уровня циркулирующего в крови лептина использовали иммуноферментный набор Leptin ELIS Akit (Diagnostics Biochem Canada Inc., Канада). Концентрацию лептина в образцах измеряли при длине волны 450 нм в микротитровальном планшет-ридере VICTORX5 Multimode Plate Reader (Perkin Elmer Inc., США).
Геномную ДНК выделяли из цельной крови методом фенол-хлороформной экстракции. Генотипирование выполнялось методом ПЦР-ПДРФ-анализа. Оригинальные олигонуклеотидные праймеры были подобраны с использованием программы FastPCR (http://primerdigital.com/). Последовательность использованных праймеров для с.189G>A p.(Val66Met) гена BDNF: F: 5’-AGAAGAGGAGGCTCCAAAGG-3’, R: 5’-CCATTCACGCTCTCCAGAGT-3’.
Детекция проводилось с помощью стандартной ПЦР на T100 Thermal Cycler (Bio-Rad Laboratories, Inc., США). Условия ПЦР для с.189G>A p.(Val66Met) гена BDNF были следующими: начальный этап денатурации – 95 °C (5 мин), денатурация – 95 °C (45 с), отжиг – 55 °C (45 с), элонгация – 72 °C (7 мин), всего 30 циклов. Анализ полиморфизма длин рестрикционных фрагментов выполнялся с использованием эндонуклеазы FaeI («СибЭнзим», Россия) в соответствии с рекомендациями производителя. Разделение продуктов гидролиза проводили в горизонтальных электрофорезных камерах в 4% агарозном геле. Визуализация электрофореграмм осуществлялась с помощью систем гель-видеодокументации фирмы Bio-Rad (США). После инкубации с FaeI аллель Val остается интактным (197 п.н.), тогда как аллель Met расщепляется (122 и 75 п.н.).
Результаты исследования анализировались с помощью компьютерной программы для статистической обработки данных SPSS Statistica 18.0 (SPSS: An IBM Company, США). Значения р ≤0,05 считали статистически значимыми. Все результаты выражали как стандартное отклонение (±) стандартная ошибка. Анализ равновесия Харди–Вайнберга оценивали посредством критерия χ2. Сравнительный анализ уровней лептина в зависимости от генотипов с.189G>A p.(Val66Met) для групп с дефицитом веса и избыточной массой тела/ожирением (n <30) был произведен с применением критерия Манна–Уитни (U-критерий), для лиц с нормальным весом сравнительный анализ был сделан с использованием критерия Стьюдента (t-критерия; n >60).
РЕЗУЛЬТАТЫ
Средние уровни лептина в популяции якутов, а также корреляция лептина с ИМТ и с полом ранее были определены и опубликованы [31, 32]. В настоящей работе были определены частоты аллелей и генотипов полиморфизма с.189G>A p.(Val66Met) гена BDNF в популяции якутов. Частота мажорного аллеля p.(Val66) составила 84,9%, минорного аллеля p.(Met66) – 15,1%. Распределение частот генотипов по исследуемому полиморфизму в выборке якутов (n=281) соответствовало равновесию Харди–Вайнберга (χ2 = 0,09). Наиболее распространенным был генотип p.[Val66]; [Val66] (58%), редким ‒ p.[Met66]; [Met66] (16%), гетерозиготный вариант p.[Val66]; [Met66] составил 26%.
В связи с низкой частотой гомозигот p.[Met66]; [Met66] и гетерозигот p.[Val66]; [Met66] для анализа уровней лептина в зависимости от ИМТ и от генотипов полиморфизма с.189G>A гена BDNF данные два генотипа были объединены в одну группу: p.[Val66]; [Met66] + p.[Met66]; [Met66]. В таблице представлены уровни лептина у якутов с нормальным весом, дефицитом веса, избытком веса/ожирением в зависимости от генотипов полиморфизма с.189G>A p.(Val66Met) гена BDNF.
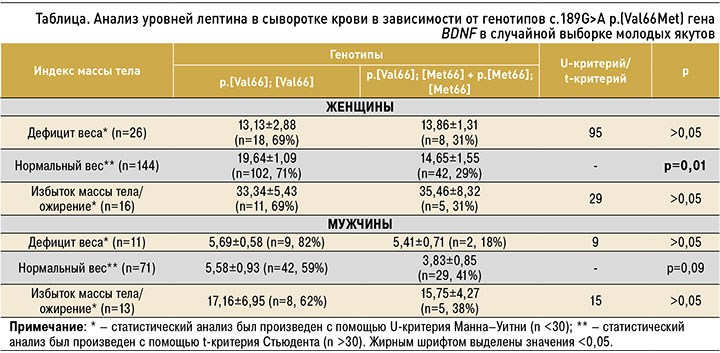
Сравнительный анализ не выявил значимых различий в уровнях лептина между двумя генотипами p.[Val66]; [Met66] + p.[Met66]; [Met66] и p.[Val66]; [Val66] у женщин и мужчин с дефицитом веса и с избытком веса/ожирением. Значимые ассоциации были обнаружены у женщин с нормальным весом, где уровень лептина был достоверно выше у лиц с генотипом p.[Val66]; [Val66] (19,64±1,09 нг/мл), по сравнению с генотипами p.[Val66]; [Met66] + p.[Met66]; [Met66] (14,65±1,55 нг/мл; p=0,01). У мужчин с нормальной массой тела была установлена похожая тенденция к повышению уровня лептина у гомозигот p.[Val66]; [Val66] (5,58±0,93 нг/ мл), по сравнению с p.[Val66]; [Met66] + p.[Met66]; [Met66] (3,83±0,85 нг/мл), которая, вероятно, из-за небольшой численности последних не достигла статистической значимости (p=0,09).
ОБСУЖДЕНИЕ
В настоящем исследовании мы определили частоты аллелей и генотипов полиморфизма с.189G>A p.(Val66Met) гена BDNF в популяции якутов. Ранее в этой же в выборке индивидов (281 человек – 186 женщин и 95 мужчин, средний возраст 19,8±1,5 лет) был измерен уровень циркулирующего в крови лептина, который имел прямую корреляционную зависимость от ИМТ (как у мужчин, так и у женщин) и демонстрировал выраженный половой диморфизм [31, 32]. У женщин средние уровни лептина (18,95±0,9 нг/мл) были в 2 раза выше, чем у мужчин (6,57±0,88 нг/мл) [31]. Также было выявлено, что у лиц с избыточным весом/ожирением уровни лептина намного выше, чем у лиц с нормальным весом и дефицитом веса [32]. Таким образом, полученные результаты об уровнях лептина в популяции якутов соответствовали ранее опубликованным общемировым данным [33–39].
С учетом полового диморфизма и зависимости уровней лептина от количества жировой ткани общая выборка была стратифицирована по полу и подразделена в зависимости от ИМТ на три группы: с дефицитом веса (n=37), нормальным весом (n=215) и избыточной массой тела/ожирением (n=29). В результате было обнаружено, что среди женщин, имеющих нормальный вес, уровень лептина был достоверно выше у лиц с генотипом p.[Val66]; [Val66] (19,64±1,09 нг/мл) по сравнению с p.[Val66]; [Met66] + p.[Met66]; [Met66] (14,65±1,55 нг/мл; p=0,01; см. табл.). У мужчин с нормальным весом была обнаружена тенденция к повышению уровня лептина у гомозигот p.[Val66]; [Val66] (5,58±0,93 нг/мл) по сравнению с p.[Val66]; [Met66] + p.[Met66]; [Met66] (3,83±0,85 нг/мл; p=0,09). В целом наши результаты свидетельствуют о том, что разные аллельные варианты полиморфизма с.189G>A p.(Val66Met) гена BDNF, вероятно, могут влиять на уровни циркулирующего в крови лептина, поскольку и лептин, и BDNF вовлечены в общий механизм регулирования энергетического гомеостаза.
Регулирование энергетического гомеостаза, аппетита и массы тела довольно сложно контролируется ЦНС. В настоящий момент известно, что контроль приема пищи у людей регулируется не только гомеостатическими механизмами, но также когнитивными и аффективными процессами (вознаграждением, эмоциями/памятью, вниманием) [40]. Так, в исследовании Monteleone P. et al. [30] было показано, что BDNF и лептин могут дополнительно участвовать в модуляции процессов вознаграждения и мотивирования на поощрение употребления высококалорийной пищи, богатой углеводами или жирами. В свою очередь, гомеостатический контроль приема пищи осуществляется в гипоталамусе и включает несколько нейронных систем. Лептин выступает одним из ключевых гормонов, который может воздействовать на эти нейронные системы, подавляя или пробуждая аппетит. В настоящее время хорошо изучены пути передачи лептинового сигнала через дугообразное ядро гипоталамуса, но недавние исследования показывают, что рецепторы лептина, экспрессирующиеся в вентромедиальном гипоталамическом ядре, также могут влиять на энергетический гомеостаз [22, 41]. Возможно, передача сигналов лептина играет решающую роль в передаче симпатического тонуса от вентромедиального гипоталамического ядра к периферическим тканям [42].
Вентромедиальное гипоталамическое ядро – важная область мозга, которое может оказывать воздействие на мотивацию к приему пищи и соответственно связано с массой тела [43, 44]. Было установлено, что вентромедиальное гипоталамическое ядро содержит высокую плотность нейронов, которые экспрессируют BDNF [45]. В нескольких работах было обнаружено, что лептин может стимулировать свою синаптическую нейропластичность через BDNF [46, 47] и, возможно, имеется дополнительный сигнальный путь лептина через BDNF в вентромедиальном гипоталамическом ядре. Носители аллеля p.(Met66) с рождения, по-видимому, имеют пониженную экспрессию BDNF в вентромедиальном гипоталамическом ядре, и в связи с этим у них нарушается данный дополнительный лептиновый сигнальный путь. По аналогии с результатами исследований об экспрессии BDNF, о его сигнальных путях в вентромедиальном гипоталамическом ядре, которые были проведены на различных линиях мышей (ob/ob, BDNFlacZ, BDNFklox/klox) [41, 45–47], мы выдвинули предположение о возможном механизме регулирования насыщения и формирования чувства голода лептином через BDNF в гипоталамусе (рис.).

Возможно, эти нарушения приводят к пониженному аппетиту (вероятнее всего, нарушаются процессы вознаграждения и мотивирования на поощрения употребления высококалорийной пищи), что приводит к недостаточному накоплению жировой ткани и, следовательно, к низким уровням лептина в крови. Это, в свою очередь, становится фактором риска развития дальнейших расстройств пищевого поведения, в крайних случаях, приводящих к нервной анорексии и булимии.
ЗАКЛЮЧЕНИЕ
1. В популяции якутов (n=281) частота мажорного аллеля p.(Val66) составила 84,9%, а минорного аллеля p.(Met66) – 15,1%. Наиболее распространенным был генотип p.[Val66]; [Val66] (58%), редким ‒ p.[Met66]; [Met66] (16%), гетерозиготный вариант p.[Val66]; [Met66] встречался в 26% случаев.
2. В популяции якутов выявлена ассоциация генотипов p.[Val66]; [Met66] + p.[Met66]; [Met66] с пониженным уровнем лептина в сыворотке крови у женщин с нормальным весом (p=0,01). У мужчин с данными генотипами обнаружена тенденция к понижению уровня лептина (p=0,09).
3. Результаты нашего исследования свидетельствуют о том, что полиморфизм с.189G>A p.(Val66Met) гена BDNF, возможно, связан с нарушением лептинового сигнала в вентромедиальном гипоталамическом ядре, а его аллельный вариант p.(Met66) может выступать фактором риска развития расстройств пищевого поведения.
- Jones M.E., Schoemaker M.J., Wright L.B. et al. Smoking and risk of breast cancer in the generations study cohort. Breast Cancer Res. 2017; 19(1): 118. doi: 10.1186/s13058-017-0908-4.
- Maisonpierre P.C., Le Beau M.M., Espinosa R. et al. Human and rat brain-derived neurotrophic factor and neurotrophin-3: Gene structures, distributions, and chromosomal localizations. Genomics. 1991; 10(3): 558–68. doi: 10.1016/0888-7543(91)90436-I.
- Matsuo K., Walss-Bass C., Nery F.G. et al. Neuronal correlates of brain-derived neurotrophic factor Val66Met polymorphism and morphometric abnormalities in bipolar disorder. Neuropsychopharmacology. 2009; 34(8): 1904–13. doi: 10.1038/npp.2009.23.
- Leibrock J., Lottspeich F., Hohn A. et al. Molecular cloning, and expression of brain-derived neurotrophic factor. Nature. 1989; 341(6238): 149–52. doi: 10.1038/341149a0.
- Acheson A., Conover J.C., Fandl J.P. et al. A BDNF autocrine loop in adult sensory neurons prevents cell death. Nature .1995; 374(6521): 450–53. doi: 10.1038/374450a0.
- Huang L., Wang Z., Li C. Modulation of circulating leptin levels by its soluble receptor. J Biol Chem. 2001; 276(9): 6343–49. doi: 10.1074/jbc.M009795200.
- Lommatzsch M., Zingler D., Schuhbaeck K. et al. The impact of age, weight, and gender on BDNF levels in human platelets and plasma. Neurobiol Aging. 2005; 26(1): 115–23. doi: 10.1016/j.neurobiolaging.2004.03.002.
- Han H.R., Ryu H.-J., Cha H.S. et al. Genetic variations in the leptin and leptin receptor genes are associated with type 2 diabetes mellitus and metabolic traits in the Korean female population. Clin Genet. 2008; 74(2): 105–15. doi: 10.1111/j.1399-0004.2008.01033.x.
- Pedersen B.K., Pedersen M., Krabbe K.S. et al. Role of exercise-induced brain-derived neurotrophic factor production in the regulation of energy homeostasis in mammals. Exp Physiol. 2009; 94(12): 1153–60. doi: 10.1113/expphysiol.2009.048561.
- Egan M.F., Kojima M., Callicott J.H. et al. The BDNF val66met polymorphism affects activity-dependent secretion of BDNF and human memory and hippocampal function. Cell. 2003. 112(2): 257–69. doi: 10.1016/s0092-8674(03)00035-7.
- Ribases M., Gratacos M., Fernandez-Aranda F. et al. Association of BDNF with anorexia, bulimia, and age of onset of weight loss in six European populations. Hum Mol Genet. 2004; 13(12): 1205–12. doi: 10.1093/hmg/ddh137.
- Gratacos M., Gonzalez J.R., Mercader J.M. et al. Brain-derived neurotrophic factor Val66Met and psychiatric disorders: meta-analysis of case-control studies confirm association to substance-related disorders, eating disorders, and schizophrenia. Biol Psychiatry. 2007; 61(7): 911–22. doi: 10.1016/j.biopsych.2006.08.025.
- Ribases M., Gratacos M., Armengol L. et al. Met66 in the brain-derived neurotrophic factor (BDNF) precursor is associated with anorexia nervosa restrictive type. Mol Psychiatry. 2003; 8(8): 745–51. doi: 10.1038/sj.mp.4001281.
- Koizumi H., Hashimoto K., Itoh K. et al. Association between the brain-derived neurotrophic factor 196G/A polymorphism and eating disorders. Am J Med Genet B Neuropsychiatr Genet. 2004; 127B(1): 125–27. doi: 10.1002/ajmg.b.20153.
- De Krom M., Bakker S.C., Hendriks J. et al. Polymorphisms in the brain-derived neurotrophic factor gene are not associated with either anorexia nervosa or schizophrenia in Dutch patients. Psychiatr Genet. 2005; 15(2): 81. doi: 10.1097/00041444-200506000-00003.
- Friedel S., Horro F.F., Wermter A.K. et al. Mutation screen of the brain derived neurotrophic factor gene (BDNF): Identification of several genetic variants and association studies in patients with obesity, eating disorders, and attention-deficit/hyperactivity disorder. Am J Med Genet B Neuropsychiatr Genet. 2005; 132B(1): 96–99. doi: 10.1002/ajmg.b.30090.
- Gunstad J., Schofield P., Paul R.H. et al. BDNF Val66Met polymorphism is associated with body mass index in healthy adults. Neuropsychobiology. 2006; 53(3): 153–56. doi: 10.1159/000093341.
- Monteleone P., Zanardini R., Tortorella A. et al. The 196G/A (Val66met) polymorphism of the BDNF gene is significantly associated with binge eating behavior in women with bulimia nervosa or binge eating disorder. Neurosci Lett. 2006; 406(1–2): 133–37. doi: 10.1016/j.neulet.2006.07.040.
- Dardennes R.M., Zizzari P., Tolle V. et al. Family trios’ analysis of common polymorphisms in the obestatin/ghrelin, BDNF and AGRP genes in patients with Anorexia nervosa: Association with subtype, body-mass index, severity, and age of onset. Psychoneuroendocrinology. 2007; 32(2): 106–113. doi: 10.1016/j.psyneuen.2006.11.003.
- Considine R.V., Kriauciunas A., Ohannesian J.P., Bauer T.L. Serum immunoreactive-leptin concentrations in normal-weight and obese humans. N Engl J Med. 1996; 334(5): 292–95. doi: 10.1056/NEJM199602013340503.
- Zhang Y., Chua S. Leptin function and regulation. In Comprehensive Physiology; Terjung, R. Ed.; John Wiley & Sons, Inc.: Hoboken, NJ, USA. 2017; 351–69. ISBN: 978-0-470-65071-4.
- Elmquist J.K., Elias C.F., Saper C.B. From lesions to leptin: Hypothalamic control of food intake and body weight. Neuron. 1999; 22(2): 221–32. doi: 10.1016/s0896-6273(00)81084-3.
- Baicy K., London E.D., Monterosso J. et al. Leptin replacement alters brain response to food cues in genetically leptin-deficient adults. Proc Natl Acad Sci U S A. 2007; 104(46): 18276–79. doi: 10.1073/pnas.0706481104.
- Garfield A.S., Patterson C., Skora S. et al. Neurochemical characterization of body weight-regulating leptin receptor neurons in the nucleus of the solitary tract. Endocrinology. 2012; 153(10): 4600–07. doi: 10.1210/en.2012-1282.
- Anand B.K., Brobeck J.R. Localization of a «feeding center» in the hypothalamus of the rat. Proc Soc Exp Biol Med. 1951; 77(2): 323–24. doi: 10.3181/00379727-77-18766.
- Ahima R.S., Bjorbaek C., Osei S., Flier J.S. Regulation of neuronal and glial proteins by leptin: Implications for brain development. Endocrinology. 1999; 140(6): 2755–62. doi: 10.1210/endo.140.6.6774.
- Cowley M.A., Smart J.L., Rubinstein M. et al. Leptin activates anorexigenic POMC neurons through a neural network in the arcuate nucleus. Nature. 2001; 411(6836): 480–84. doi: 10.1038/35078085.
- Wang P., Loh K.H., Wu M. et al. A leptin–BDNF pathway regulating sympathetic innervation of adipose tissue. Nature. 2020; 583(7818): 839–44. doi: 10.1038/s41586-020-2527-y.
- Li C., Meng F., Lei Y. et al. Leptin regulates exon-specific transcription of the BDNF gene via epigenetic modifications mediated by an AKT/P300 HAT cascade. Mol Psychiatry. 2021; 26(8): 3701–22. doi: 10.1038/s41380-020-00922-0.
- Monteleone P., Maj M. Dysfunctions of leptin, ghrelin, BDNF and endocannabinoids in eating disorders: beyond the homeostatic control of food intake. Psychoneuroendocrinology. 2013; 38(3): 312–30. doi: 10.1016/j.psyneuen.2012.10.021.
- Никанорова А.А., Барашков Н.А., Находкин С.С. с соавт. Анализ уровня циркулирующего в крови лептина в популяции якутов. Вопросы биологической, медицинской и фармацевтической химии. 2020; 5: 10–14. [Nikanorova A.A., Barashkov N.A., Nahodkin S.S. et al. Analysis of level of leptin circulating in blood in the Yakut population. 2020; 5: 10–14 (In Russ.)]. https://dx.doi.org/10.29296/25877313-2020-05-02.
- Никанорова А.А., Готовцев Н.Н., Барашков Н.А. с соавт. Уровень циркулирующего в крови лептина у молодых якутов в зависимости от индекса массы тела. Якутский медицинский журнал. 2020; 4: 16–19. [Nikanorova A.A., Gotovtsev N.N., Barashkov N.A. et al. Circulating levels of leptin in blood of young Yakuts depending on body mass index. Yakutskiy meditsinskiy zhurnal = Yakutsk Medical Journal. 2020; 4: 16–19 (In Russ.)]. https://dx.doi.org/10.25789/YMJ.2020.72.04.
- Couillard C., Mauriege P., Prud’homme D. et al. Plasma leptin concentrations: Gender differences and associations with metabolic risk factors for cardiovascular disease. Diabetologia. 1997. 40(10): 1178–84. doi: 10.1007/s001250050804.
- Fox C.S., Esparza J., Nicolson M. et al. Is a low leptin concentration, a low resting metabolic rate, or both the expression of the «thrifty genotype»? Results from Mexican Pima Indians. Am J Clin Nutr. 1998; 68(5): 1053–57. doi: 10.1093/ajcn/68.5.1053.
- Chan J.L., Heist K., DePaoli A.M. et al. The role of falling leptin levels in the neuroendocrine and metabolic adaptation to short-term starvation in healthy men. J Clin Invest. 2003; 111(9): 1409–21. doi: 10.1172/JCI17490.
- Esteghamati A., Khalilzadeh O., Ashraf H. et al. Physical activity is correlated with serum leptin independent of obesity: results of the national surveillance of risk factors of noncommunicable diseases in Iran (SuRFNCD-2007). Metabolism. 2010; 59(12): 1730–35. doi: 10.1016/j.metabol.2010.04.016.
- Guzman D.D., Marchau L.A.M., Reyes J.L. et al. Leptin levels and nutritional status of indigenous Tepehuan and Mestizo subjects in Durango, Mexico. Dis Markers. 2014; 2014: 974503. doi: 10.1155/2014/974503.
- MacIver N.J., Thomas S.M., Green C.L., Worley G. Increased leptin levels correlate with thyroid autoantibodies in nonobese males. Clin. Endocrinol (Oxf). 2016; 85(1): 116–21. doi: 10.1111/cen.12963.
- Koca T.T., Berk E., Seyithanoglu M. et al. Relationship of leptin, growth hormone, and insulin-like growth factor levels with body mass index and disease severity in patients with fibromyalgia syndrome. Acta Neurol Belg. 2020; 120(3): 595–99. doi: 10.1007/s13760-018-01063-6.
- Farr O.M., Chiang-Shan R.L., Mantzoros C.S. Central nervous system regulation of eating: Insights from human brain imaging. Metabolism. 2016; 65(5): 699–713. doi: 10.1016/j.metabol.2016.02.002.
- Scott M.M., Lachey J.L., Sternson S.M. et al. Leptin targets in the mouse brain. J Comp Neurol. 2009; 514(5): 518–32. doi: 10.1002/cne.22025.
- Zhou Y., Rui L. Leptin signaling and leptin resistance. Front Med. 2013; 7(2): 207–22. doi: 10.1007/s11684-013-0263-5.
- King B.M. Amygdaloid lesion-induced obesity: relation to sexual behavior, olfaction, and the ventromedial hypothalamus. Am J Physiol Regul Integr Comp Physiol. 2006; 291(5): R1201–14. doi: 10.1152/ajpregu.00199.2006.
- Kim K.W., Sohn J.W., Kohno D. et al. SF-1 in the ventral medial hypothalamic nucleus: a key regulator of homeostasis. Mol Cell Endocrinol. 2011; 336(1–2): 219–23. doi: 10.1016/j.mce.2010.11.019.
- Xu B., Goulding E.H., Zang K. et al. Brain-derived neurotrophic factor regulates energy balance downstream of melanocortin-4 receptor. Nat Neurosci. 2003; 6(7): 736–42. doi: 10.1038/nn1073.
- Halaas J., Gajiwala K., Maffei M. et al. Weight-reducing effects of the plasma protein encoded by the obese gene. Science. 1995; 269(5223): 543–46. doi: 10.1126/science.7624777.
- Liao G.Y., An J.J., Gharami K. et al. Dendritically targeted BDNF mRNA is essential for energy balance and response to leptin. Nat Med. 2012; 18(4): 564–71. doi: 10.1038/nm.2687.
Alena A. Nikanorova, junior researcher of the Laboratory of molecular genetics, Yakutsk Scientific Center for Complex Medical Problems. Address: 677018, Yakutsk, 6/3 Yaroslavskogo Str. E-mail:
nikanorova.alena@mail.ru. ORCID: 0000-0002-7129-6633
Nikolai A. Barashkov, PhD, head of the Laboratory of molecular genetics, Yakutsk Scientific Center for Complex Medical Problems. Address: 677018, Yakutsk, 6/3 Yaroslavskogo Str. E-mail:
barashkov2004@mail.ru. ORCID: 0000-0002-6984-7934
Sergei S. Nakhodkin, researcher of the research Laboratory of molecular biology, Institute of Natural Sciences of M.K. Ammosov North-Eastern University. Address: 677010, Yakutsk, 48 Kulakovskogo Str. E-mail:
sergnahod@mail.ru. ORCID: 0000-0002-6917-5760
Vera G. Pshennikova, PhD, head of the Laboratory of population genetics, Yakutsk Scientific Center for Complex Medical Problems. Address: 677018, Yakutsk, 6/3 Yaroslavskogo Str. E-mail:
pshennikovavera@mail.ru. ORCID: 0000-0001-6866-9462
Nyurgun N. Gotovtsev, researcher of the Laboratory of molecular genetics, Yakutsk Scientific Center for Complex Medical Problems. Address: 677018, Yakutsk, 6/3 Yaroslavskogo Str. E-mail:
donzcrew@mail.ru. ORCID: 0000-0002-4710-1592
Aisen V. Soloviev, PhD, senior researcher of scientific-research Laboratory of molecular biology, Institute of Natural Sciences of M.K. Ammosov North-Eastern University. Address: 677010, Yakutsk, 48 Kulakovskogo Str. E-mail:
nelloann@mail.ru. ORCID: 0000-0002-0664-4224
Georgy P. Romanov, researcher of scientific-research Laboratory of molecular biology, Institute of Natural Sciences of M.K. Ammosov North-Eastern University. Address: 677010, Yakutsk, 48 Kulakovskogo Str. E-mail:
gpromanov@gmail.com. ORCID: 0000-0002-2936-5818
Sargylana S. Kuzmina, PhD, associate professor of the Institute of Natural Sciences of M.K. Ammosov North-Eastern University. Address: 677010, Yakutsk, 48 Kulakovskogo Str. E-mail:
sskuzmina@bk.ru
Nikolay N. Sazonov, MD, professor of the Institute of Natural Sciences of M.K. Ammosov North-Eastern University. Address: 677010, Yakutsk, 48 Kulakovskogo Str. E-mail:
saznikol@mail.ru
Sardana A. Fedorova, MD, head of the research Laboratory of molecular biology, Institute of natural sciences of M.K. Ammosov North-Eastern University. Address: 677010, Yakutsk, 48 Kulakovskogo Str. E-mail:
sardaanafedorova@mail.ru. ORCID: 0000-0002-6952-3868





