ВВЕДЕНИЕ
Ревматоидный артрит (РА) – одно из самых тяжелых хронических заболеваний человека. Тяжесть заболевания связана со сложным многокомпонентным патогенезом хронического воспаления, развивающегося преимущественно в синовиальной оболочке суставов, что приводит к деструкции хряща суставных поверхностей и субхондральной кости с утратой функции опорно-двигательного аппарата.
 В недавнем прошлом лечение РА при отсутствии современного арсенала лекарственных средств и четкой стратегии терапии не давало возможности стабильного подавления активности и прогрессирования заболевания, что приводило к частой инвалидизации больных в первые 5 лет болезни [1]. На современном этапе результаты лечения РА при грамотном ведении больных позволяют контролировать течение болезни и сохранять работоспособность пациентов. Это стало возможным благодаря нескольким обстоятельствам.
В недавнем прошлом лечение РА при отсутствии современного арсенала лекарственных средств и четкой стратегии терапии не давало возможности стабильного подавления активности и прогрессирования заболевания, что приводило к частой инвалидизации больных в первые 5 лет болезни [1]. На современном этапе результаты лечения РА при грамотном ведении больных позволяют контролировать течение болезни и сохранять работоспособность пациентов. Это стало возможным благодаря нескольким обстоятельствам.
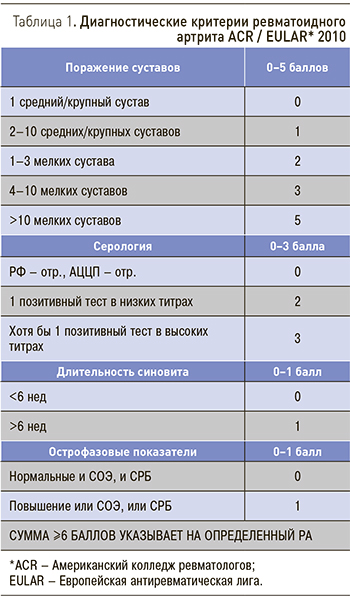
Во-первых, разработаны новые классификационные критерии РА 2010 г. [2], позволяющие устанавливать диагноз на ранних стадиях болезни (табл. 1). Во-вторых, сформулированы принципы стратегии лечения РА «Лечение до достижения цели» (Treat to Target) [3]. Согласно им лечение больных РА должно проводиться при постоянном взаимодействии врача и пациента, основная стратегическая цель лечения РА – максимальное сохранение качества жизни пациента, основной путь к достижению этой цели – подавление воспаления и постоянный контроль за достаточностью терапии. В соответствии со стратегией «Лечение до достижения цели» формулируются и современные международные (рекомендации Европейской антиревматической лиги – EULAR) [4] и национальные [5] рекомендации по ведению больных РА, в которых четко сформулирована тактика этого ведения. Лечение больных РА должно проводиться ревматологами.
В настоящее время для лечения РА используются, с одной стороны, симптоматические (стероидные и нестероидные) противовоспалительные препараты, которые бывают необходимы на ранних этапах проведения терапии, но не способны оказать влияние на течение РА, с другой – синтетические базисные противовоспалительные препараты (БПВП), задача которых надежно подавить воспаление и предотвратить развитие деструкции. В отсутствии достаточного эффекта при их использовании к лечению присоединяют генно-инженерные биологические препараты (ГИБП) или так называемый таргетный БПВП – блокатор янус-киназ тофацитиниб. Высокая стоимость ГИБП лимитирует их применение у всех больных РА, хотя ряд контролируемых исследований и показывает их более высокую эффективность у больных на ранней стадии и не получавших ранее БПВП [6, 7].
Лечение РА с применением синтетических БПВП начинают сразу после установления диагноза, не позднее чем через 3–6 мес от момента появления симптомов поражения суставов (уровень доказательности 1а) [3–5]. В связи с этим каждый врач общей практики должен уметь выделить среди пациентов с болями в суставах больных, у которых имеются признаки хронизации воспаления, и как можно раньше отправить их на консультацию к ревматологу.
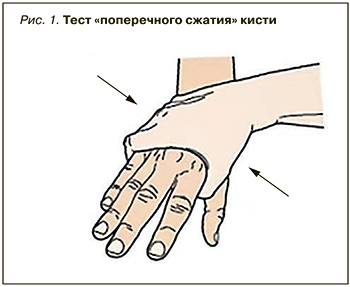 EULAR дано определение артралгий, позволяющих заподозрить развитие РА [8]. Врачу общей практику следует оценить 5 анамнестических параметров (табл. 2), а при осмотре оценить, есть ли затруднения при сжатии кисти в кулак и провести тест поперечного сжатия кисти (или стопы; рис. 1).
EULAR дано определение артралгий, позволяющих заподозрить развитие РА [8]. Врачу общей практику следует оценить 5 анамнестических параметров (табл. 2), а при осмотре оценить, есть ли затруднения при сжатии кисти в кулак и провести тест поперечного сжатия кисти (или стопы; рис. 1).
Как видно из табл. 2, при наличии 4 положительных ответов из 7 риск развития РА уже составляет почти 94%, а при наличии 5–7 положительных ответов он равен 100%, что должно служить основанием для направления больного к ревматологу. При раннем начале лечения (в первые 3–6 мес) у большинства пациентов можно добиться ремиссии или течения РА с низкой активностью, что и является критерием эффективного лечения РА.
Задержка с назначением синтетических БПВП приводит к уменьшению эффекта лечения. Согласно анализу данных 14 рандомизированных клинических исследований (1435 пациентов с РА, из которых 886 получали различные синтетические БПВП и 549 – плацебо) с учетом демографических факторов (пол, возраст), функционального класса по Steinbrocker и клинико-лабораторных параметров активности болезни (боль, число болезненных и припухших суставов, СОЭ, индекс оценки функции HAQ и др.), при любой длительности РА различие в частоте развития терапевтического эффекта между активным лечением и плацебо было примерно одинаковым – около 30% [9]. Однако по мере увеличения длительности РА эффективность синтетических БПВП снижалась с 52% «ответчиков» (в случае начала терапии при длительности РА <1 года) до 35% (при длительности РА >10 лет).
 Якорным препаратом в лечении РА считается метотрексат (МТ), который эффективен у большинства больных РА и обладает хорошей переносимостью доз, используемых в ревматологии [10–11]. Успех лечения этим лекарственным средством зависит от ряда моментов:
Якорным препаратом в лечении РА считается метотрексат (МТ), который эффективен у большинства больных РА и обладает хорошей переносимостью доз, используемых в ревматологии [10–11]. Успех лечения этим лекарственным средством зависит от ряда моментов:
- использование оптимальных терапевтических доз – 15–25 мг в неделю;
- контроль над эффективностью терапии с коррекцией дозы и формы МТ при недостаточном эффекте;
- контроль над переносимостью МТ (клинически и лабораторно);
- с учетом антифолатного действия МТ – его комбинация с приемом фолиевой кислоты в дозе 1–2 мг в те дни, когда МТ не принимается, что позволяет уменьшить частоту нежелательных явлений (НЯ) [12].
Таким образом, при отсутствии ограниченных противопоказаний к назначению МТ (острая инфекция, алкоголизм, беременность) после установки диагноза он назначается по 15 мг/нед в комбинации с фолиевой кислотой по 5 мг/нед. Поскольку эффект МТ развивается обычно через 8–12 нед, на этот период к лечению добавляют нестероидные противовоспалительные препараты (НПВП) с учетом факторов риска развития НЯ.
Необходимость применения глюкокортикоидов (ГК) должна определяться ревматологами: такая терапия не является рутинной из-за большого числа НЯ по мере нарастания кумулятивной дозы ГК. И в международных, и в национальных рекомендациях [4, 5] указывается, что используемые дозы ГК должны быть невысокими (обычно 7,5–10 мг/ сут в дебюте лечения), они назначаются в начале применения БПВП и должны быть отменены так быстро, как позволяет клиническая ситуация. В последнем систематическом обзоре с метаанализом, посвященном месту ГК и БПВП в терапии РА [13], указывается, что применение высоких доз ГК не имеет преимуществ перед низкими дозами. В настоящий момент пульс-терапия мегадозами ГК (1000 мг преднизолона в течение 3 дней внутривенно) для лечения РА практически не используется. Однако и применение низких доз ГК с учетом необходимости длительной многомесячной терапии неизбежно приводит к многочисленным НЯ: это, в частности, вторичный остеопороз, профилактику которого начинают сразу после назначения ГК, а также существенное возрастание частоты деструкции крупных суставов (чаще тазобедренных), что сразу переводит больного в статус инвалида и увеличивает частоту необходимости тотального эндопротезирования. Кроме этого, может отмечаться развитие таких хорошо знакомых клиницистам побочных эффектов стероидной терапии, как сахарный диабет, катаракта, ожирение, кушингоид, нарастание частоты инфекционных заболеваний, увеличение риска развития кардиоваскулярных заболеваний и др. [14, 15].
 Таким образом, применение МТ при активном РА начинается с 15 мг/нед; далее, через 3 мес терапии, ревматологи количественно оценивают появление эффекта по динамике числа болезненных, припухших суставов, выраженности боли по визуальной аналоговой 100-миллимитровой шкале, уровню СОЭ и С-реактивного белка с вычислением специальных композитных индексов активности болезни (по оценке 28 суставов – DAS28, или клинический индекс активности – CDAI, или простой индекс активности болезни – SDAI) [5].
Таким образом, применение МТ при активном РА начинается с 15 мг/нед; далее, через 3 мес терапии, ревматологи количественно оценивают появление эффекта по динамике числа болезненных, припухших суставов, выраженности боли по визуальной аналоговой 100-миллимитровой шкале, уровню СОЭ и С-реактивного белка с вычислением специальных композитных индексов активности болезни (по оценке 28 суставов – DAS28, или клинический индекс активности – CDAI, или простой индекс активности болезни – SDAI) [5].
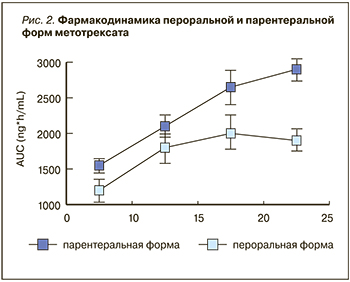
Для каждого из этих индексов имеется количественная градация баллов, соответствующих низкой, умеренной или высокой активности РА, а также ремиссии. При слабо выраженной положительной динамике параметров активности болезни в течение первых 3 мес доза МТ увеличивается. При этом следует учитывать особенности фармакодинамики пероральной и парентеральной форм МТ (рис. 2) [16]. Увеличение дозировки МТ выше 15 мг/нед должно сопровождаться переводом больного на парентеральную форму (предпочтительно подкожную), поскольку при приеме таблеток МТ в дозе более 15 мг/ нед практически отсутствует повышение концентрации лекарственного средства в сыворотке крови, тогда как при использовании парентеральной формы можно наблюдать линейное нарастание концентрации препарата по мере увеличения недельной дозы.
При плохой переносимости перорального МТ со стороны ЖКТ (гастралгии, тошнота, рвота) также показан перевод больного на парентеральную форму, что в большинстве случаев сопровождается исчезновением таких симптомов непереносимости. Кроме того, подкожная форма МТ имеет и более высокую биодоступность, достигающую 94%, тогда как у таблеток аналогичный показатель составляет 75% [16].
 Мониторинг переносимости МТ состоит в контроле над уровнем АЛТ, АСТ, креатинина и показателей клинического анализа крови раз в 1–1,5 мес в начале лечения или при увеличении дозы МТ и ее стабилизации каждые 3 мес; клиническую оценку НЯ следует проводить во время каждого визита пациентов. Лечение МТ следует прервать при повышении концентрации АЛТ/АСТ выше трехкратной верхней границы нормы (3 ВГН); возобновляют лечение в более низкой дозе после нормализации лабораторных показателей. При стойком увеличении уровня АСТ/АЛТ >3 ВГН следует скорректировать дозу МТ, при сохранении увеличения уровня АСТ/АЛТ >3 ВГН после отмены МТ – провести соответствующие диагностические процедуры.
Мониторинг переносимости МТ состоит в контроле над уровнем АЛТ, АСТ, креатинина и показателей клинического анализа крови раз в 1–1,5 мес в начале лечения или при увеличении дозы МТ и ее стабилизации каждые 3 мес; клиническую оценку НЯ следует проводить во время каждого визита пациентов. Лечение МТ следует прервать при повышении концентрации АЛТ/АСТ выше трехкратной верхней границы нормы (3 ВГН); возобновляют лечение в более низкой дозе после нормализации лабораторных показателей. При стойком увеличении уровня АСТ/АЛТ >3 ВГН следует скорректировать дозу МТ, при сохранении увеличения уровня АСТ/АЛТ >3 ВГН после отмены МТ – провести соответствующие диагностические процедуры.
За 5-летний период использования подкожной формы МТ в нашей клинической практике с применением на практике клинических рекомендаций и принципов стратегии «Лечение до достижения цели» в нашей когорте больных с ранним РА возможность достижения низкой активности или стойкой ремиссии заболевания увеличилась.
Цель исследования. Оценка эффективности и переносимости подкожной формы МТ при проспективном наблюдении больных с ранним РА.
МАТЕРИАЛ И МЕТОДЫ
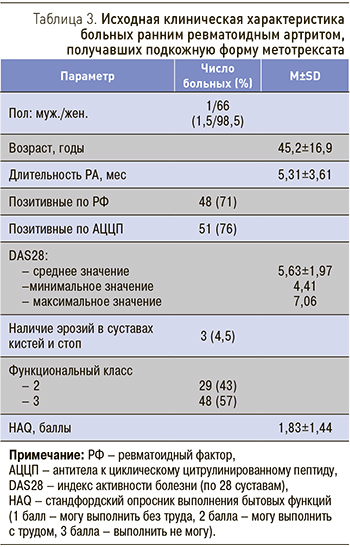
Подкожная форма МТ была назначена 67 больным с достоверным диагнозом РА по критериям ACR/EULAR 2010 г. Исходная клиническая характеристика больных представлена в табл. 3.
Средняя длительность заболевания составила 5,3±3,61 мес, средний возраст 45,2±16,9 лет. Большинство больных были среднего возраста (42–65 лет), 9 пациенток были старше 65 лет. Активность заболевания оценивалась по составному индексу активности при оценке поражения 28 суставов (DAS28) [17], наиболее часто поражаемых при РА. DAS28 вычисляется по формуле: 0,56 × Ö (ЧБС28) + 0,28 × Ö (ЧПС28) + 0,70Ln (СОЭ) + 0,014 (ОСЗ), где ЧБС – число болезненных суставов, ЧПС – число припухших суставов, ОСЗ – оценка состояния здоровья по 100 мм визуальной аналоговой шкале. Для вычисления DAS существует калькулятор, так что врач только вносит оцениваемые параметры. Значение DAS28 <2,6 балла соответствует ремиссии РА, >2,6–3,2 – низкой активности, >3,2–5,1 – умеренной активности и >5,1 – высокой активности.
Активность РА по DAS28 у 43 больных (64%) была умеренной и у 24 (36%) – высокой. Хотя функциональный класс не был максимальным ни в одном случае, средний HAQ составил 1,83±1,44. Лишь у 3 больных были выявлены единичные эрозии в суставах кистей и стоп (IIб стадия), у остальных имелись только сужения суставных щелей (IIa стадия). С-реактивный белок оценивался методом радиальной иммунодиффузии (норма <5 мг/л), РФ – иммуноферментным методом (норма <25 МЕ/мл), АЦЦП – методом цитофлуометрии (норма <20 ед/мл). Большинство больных были серопозитивны и по РФ, и по АЦЦП (табл. 3). Функция больных оценивалась с помощью стандфордской анкеты (HAQ) [18].
Статистический анализ проводился с помощью параметрических методов с использованием программы Statistica-6.
Со всеми больными на первом визите проводилась подробная обучающая беседа, в ходе которой объяснялась тяжесть заболевания, возможность прогрессирующего варианта его течения, необходимость длительного непрерывного лечения, коррекция которого возможна только при участии врача. Разъяснялись возможные виды терапии, и объяснялось, почему именно МТ рекомендуется им в качестве первого препарата. Больным выдавалась памятка, в которой указывались ритм приема МТ и фолиевой кислоты, необходимые параметры контроля над эффектом и переносимостью лечения. Рекомендовалось соблюдение диетического режима с ограничением жирной, острой пищи. Пациентам также объяснялось, что их задача на начальных этапах лечения – внимательно следить за возможным возникновением НЯ и незамедлительно сообщать о них врачу, а также оценить, как изменяются симптомы, есть ли (пусть и небольшое) улучшение. Мы считаем, что обучение больного играет большую роль в успешности проводимой терапии РА, так как ведет к увеличению комплаентности лечения, вдумчивой оценке своего состояния, ответственному поведению пациента по предупреждению НЯ.
 Всем больным (после пробного введения 10 мг МТ) назначалась подкожная форма препарата в дозе 15 мг/нед в комбинации с 1–2 мг фолиевой кислоты, НПВП в общепринятых терапевтических дозах. ГК не назначались. Внутрисуставные введения бетаметазона потребовались в ранние сроки лечения только 3 больным. В течение 12 мес было пролечено 65 больных (97%), в течение 24 мес – 47 больных, в течение 36 мес – 22 пациента.
Всем больным (после пробного введения 10 мг МТ) назначалась подкожная форма препарата в дозе 15 мг/нед в комбинации с 1–2 мг фолиевой кислоты, НПВП в общепринятых терапевтических дозах. ГК не назначались. Внутрисуставные введения бетаметазона потребовались в ранние сроки лечения только 3 больным. В течение 12 мес было пролечено 65 больных (97%), в течение 24 мес – 47 больных, в течение 36 мес – 22 пациента.
РЕЗУЛЬТАТЫ
Практически у всех больных (у 61 из 67 – 91%) первые симптомы улучшения отмечались через 4–5 нед использования МТ в дозе 15 мг/нед, к 8-й неделе терапии эффект отмечался у всех больных (за исключением 2, у которых препарат был отменен на ранних сроках терапии из-за появления гриппоподобного синдрома – flu-синдрома). При отсутствии признаков улучшения в первые 4–6 нед доза МТ увеличивалась до 20 мг/нед: такая мера потребовалось 8 больным и привела к развитию эффекта без необходимости дальнейшего увеличения дозы.
Через 3 мес достигнуть цели (низкой активности РА) удалось у 16 больных, имевших исходно умеренную степень активности (24% от общего числа больных и 37% от числа больных с исходно умеренной активностью). Однако, поскольку у остальных больных отмечалась отчетливая тенденция к нарастанию эффекта, доза МТ у них не увеличивалась.
Через 6 мес терапии у пациентов не была отмечена высокая степени активности РА, умеренная степень активности имела место у 32 из 65 (49%) больных и низкая активность – у 33 (51%). К 12-му месяцу у всех больных цель лечения была достигнута: у 12 отмечалась ремиссия по DAS28 и по критериям ремиссии ACR/EULAR 2010 г. [19], в остальных случаях регистрировалась низкая активность РА.
Через 2 года лечения ремиссии достигли 43% больных, у остальных регистрировалась низкая активность РА; через 3 года ремиссии достигли уже более половины пациентов (24 пациента, из них 18 к этому сроку получали препарат, продолжительность ремиссии у них составила от 12 до 24 мес).
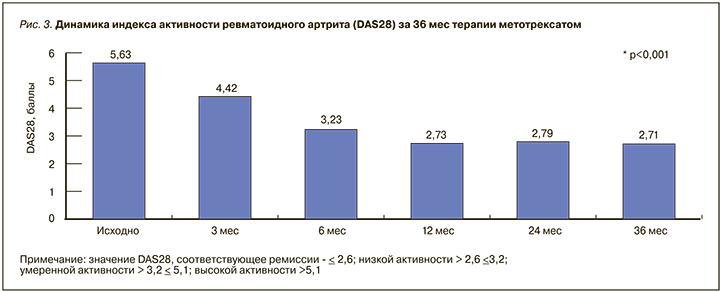
Динамика DAS28(СОЭ) у участников исследования представлена на рис. 3.
Две пациентки, достигшие ремиссии через 18 и 20 мес лечения, высказали желание забеременеть. Доза МТ у них был снижена на 3 мес до 10 мг/нед, далее препарат был отменен, и больные находились под наблюдением еще в течение 3 мес. Поскольку обострения РА у них не было, больным была разрешена беременность, и обе в срок родили здоровых детей.
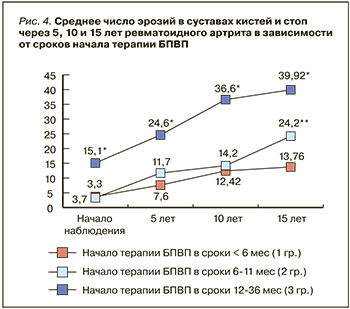
За первый год лечения было отмечено появление эрозий у 18 больных (максимальное число – 5 у 1 больной). У 17 пациенток это были единичные небольшие эрозии (среднее число новых эрозий 1,63±1,02); им, несмотря на достижение цели, было решено не уменьшать дозу МТ, а у больной с 5 новыми эрозиями на последующие 6 мес доза препарат была увеличена до 20 мг/нед. В дальнейшем среди больных, пролеченных 24 и 36 мес, появление новых эрозий было отмечено в 11 случаях. Параллельно со снижением активности РА улучшалось и функциональное состояние больных: индекс HAQ через 3, 6, 12, 24 и 36 мес составил соответственно 1,78; 1,31; 0,86; 0,63 и 0,67 балла.
Следует отметить хорошую переносимость МТ в нашей группе больных. Из-за НЯ препарат был отменен в первые 8 нед у 2 больных (гриппоподобный синдром), через 3 мес (из-за стойкого повышения концентрации сывороточных трансаминаз) у 1 больной. У 12 пациенток отмечались частые простуды, что требовало только временного перерыва в лечении, у 19 пациентов (38%) – транзиторное повышение АЛТ и/или АСТ, однако нарастание этих параметров лишь трижды превышало 2 ВГН, что не требовало коррекции терапии.
Заключение
Таким образом, подкожная форма МТ обладает высокой эффективностью в отношении активности и прогрессирования раннего РА, длительной хорошей переносимостью и позволяет при использовании принципов контролируемого лечения достичь цели у большинства больных через 6–12 мес терапии.
Особенностью ведения нашей группы больных было начало терапии МТ в первые 6 мес болезни, что позволило достичь ремиссии более чем у половины больных. При этом отмечено минимальное прогрессирование эрозивного артрита у 18 больных (27%), не вызвавшее стойкого снижения их функциональной способности.
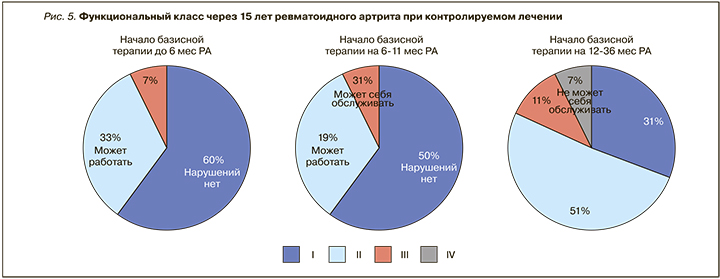
Успех лечения РА основывается на раннем установлении диагноза и немедленном начале терапии БПВП: это позволяет значительно уменьшить развитие деструкции суставов [20, 21] и максимально сохранить функциональное состояние больных (рис. 4, 5) [21].
В заключение еще раз хочется обратить внимание практикующих врачей на необходимость обучения больных. По данным опросов пациентов, в более чем 50% случаев врач не обсуждал с ними стратегию лечения. Сами опрошенные врачи объясняют нежелание такого обсуждения с больным отсутствием времени (21% респондентов), неспособностью некоторых больных понять эти принципы (48%) или принять решение (59%). При этом данный аспект очень важен, ведь приверженность больного лечению и регулярное применение назначенных препаратов уменьшают число обострений РА и сокращают время до достижения ремиссии [22, 23]. В связи с этим в странах Европы, включая Россию, проводятся школы для улучшения коммуникации между медицинским персоналом и больными и для объяснения пациентам принципов лечения РА – программа Treatment to Target Connect. Конечно, врач из-за нехватки времени обычно не имеет возможности на амбулаторном приеме подробно обсуждать с больным стратегические вопросы. Поэтому привлечение пациентов в такие школы может существенно облегчить работу клиницистам.



