ВВЕДЕНИЕ
Вирусные инфекции часто сопровождаются ревматологическими симптомами, такими как артралгии, миалгии, ощущение скованности, лихорадка и утомляемость [1]. Эти проявления болезни хорошо известны, в частности, для «обычного» гриппа, при котором боли в суставах и мышцах отмечаются у большинства пациентов [2].
При некоторых вирусных инфекциях поражение суставов носит более серьезный характер, проявляясь развитием острого воспаления синовиальной оболочки и периартикулярных тканей. Так, клинически выраженный полиартрит, который характеризуется стойкой локальной болью и припухлостью суставов, отмечается у 1–5% пациентов с инфекцией, вызванной цитомегаловирусом (ЦМВ), вирусом Эпштейна–Барр (ВЭБ), вирусом иммунодефицита человека (ВИЧ). Гораздо чаще (10–15%) поражение суставов отмечается в остром периоде гепатита В и С, при инфекции, вызванной парвовирусом В19 («инфекционная эритема») и альфовирусами (тропические лихорадки денге и Зика). Есть вирусные заболевания, при которых появление артрита носит облигатный характер и отмечается у большинства заболевших (80–90%), например, при тропических лихорадках реки Росс и леса Барма. В ряде случаев вирусные заболевания приводят к развитию хронического ревматоидоподобного полиартрита: этим характеризуется распространенная на всех континентах в странах тропического и субтропического пояса лихорадка Чикунгунья (арбовирус), при которой стойкая ревматологическая патология (артрит, тендинит, энтезит) наблюдается примерно у 15% пациентов. Так же известна взаимосвязь между вирусными инфекциями (ЦМВ, ВЭБ, вирус гепатита С) и развитием аутоиммунных ревматических заболеваний – ревматоидного артрита (РА) и синдрома/болезни Шегрена [3–5].
В настоящее время, в период пандемии COVID- 19, которая продолжается уже более двух лет и остается наиболее важной медицинской и социальной проблемой человечества, одними из наиболее актуальных вопросов становятся отдаленные последствия инфекции, вызванной SARS- CoV-2. В частности, активно обсуждается возможность развития после перенесенного COVID-19 различных аутоиммунных нарушений, в том числе ревматологической патологии [6].
Важно отметить, что информация по этой проблеме накапливается очень быстро, кардинально меняя первоначальные представления исследователей и практикующих врачей. Так, судя по научным публикациям, во время первой волны COVID- 19, пришедшейся на март–май 2020 г., манифестация ревматологических заболеваний после перенесенной инфекции практически не фиксировалась. Например, в обзоре Schett G. et al. [7], опубликованном в августе 2020 г., SARS-CoV-2 был отнесен к вирусным инфекциям, которые в остром периоде часто вызывают артралгии, но очень редко артрит. Однако уже в августе 2020 г. появились первые публикации о развитии артрита после перенесенного COVID-19 [8]. К февралю 2022 г. в поисковой системе англоязычной медицинской литературы PubMed/MEDLINE по запросам «COVID-19» и «arthritis» предоставлялась 1251 ссылка на соответствующие публикации, из которых 38 являются клиническими наблюдениями, а 21 – обзорами по данной проблеме. В русскоязычной поисковой системе eLIBRARY по запросу «COVID-19» и «артрит» выдаются 802 ссылки, среди которых 9 работ – клинические наблюдения развития ревматической патологии после перенесенной инфекции SARS-CoV-2.
ИММУННЫЕ НАРУШЕНИЯ, СВЯЗАННЫЕ С ИНФЕКЦИЕЙ SARS-CoV-2
Жизненный цикл SARS-CoV-2 – одноцепочечного РНК-содержащего вируса – определяется последовательным взаимодействием с клеткой-«хозяином». После контакта S-белка (спайк-белка) вируса с клеточным рецептором ангиотензинпревращающего фермента (АПФ) 2 происходит «разрезание» первого на субъединицы S1 и S2 при помощи мембранной протеазы TMPRSS2, а также ряда других энзимов клетки (фурина, катепсина, трипсина и др.), локальное разрушение фосфолипидов клеточной мембраны, сопровождающееся последующим их слиянием с фосфолипидами вируса с формированием эндосомы. Эндосома перемещает внутрь клетки РНК вируса, где после высвобождения последней происходит транскрипция субгеномномных матричных РНК, формируется репликационно-трансляционный комплекс и начинается процесс трансляции вирусных белков с использованием эндоплазматического ретикулума клетки-«хозяина». Затем происходит «сборка» вновь синтезированной вирусной РНК и E-, N-, M- и S-протеинов SARS-CoV-2 в копию (нуклеокапсид) исходного вируса. Этот процесс происходит очень активно, быстро истощая энергетические и метаболические резервы инфицированной клетки и вызывая тем самым ее некробиотические изменения [9–11]. Так, число вирусных частиц в слюне зараженного пациента в период активной инфекции SARS- CoV-2 составляет от 1×104 до 1×107/мл [12]. Захват новообразованными копиями SARS- CoV-2 фосфолипидов мембраны при формировании внеклеточной формы вируса, ее экзоцитоза и вызванный активацией внутриклеточных сигнальных путей апоптоз приводят к гибели и разрушению инфицированной клетки [9–11].
Процесс вирусной инвазии вызывает реакцию врожденной иммунной системы. Однако в дебюте инфекционного процесса вирусные частицы (при отсутствии специфических антител) фактически недоступны для обнаружения макрофагальными клетками и цитотоксическими Т-лимфоцитами (ЛФЦ); они также ускользают от действия иммунной системы в период внутриклеточного цикла репликации. Поэтому первой «мишенью» неспецифического иммунитета становятся поврежденные вирусом клетки: именно здесь антигенпрезентирующие клетки приобретают возможность контактировать с молекулярным комплексом, связанным с патогеном (PAMP), фагоцитировать вирусные белки, «представлять» антигены вируса для toll-подобных рецепторов (TLR3, TLR4, TLR7/8) и активировать Т-ЛФЦ (CD4+), запуская, таким образом, формирование адаптивной иммунной реакции [6, 10, 11].
Цитопатический процесс приводит к формированию большого числа клеточных «обломков», содержащих измененные белки и фрагменты ядерного материала (короткие цепочки РНК и ДНК), – так называемый молекулярный комплекс повреждения (DAMP). Это, в свою очередь, привлекает макрофаги, нейтрофилы и цитотоксические лимфоциты (такие как NK), которые разрушают и элиминируют инфицированные SARS-CoV-2 клетки. Активация клеток врожденного иммунитета сопровождается каскадным синтезом цитокинов (интерлейкина 1, интерлейкина 6, фактора некроза опухоли альфа, интерферона гамма и др.), что в ряде случаев может вызывать «цитокиновый шторм». С другой стороны, DAMP может стать причиной активации клонов Th17-лимфоцитов, определяющих развитие реакции адаптивной иммунной системы против собственных измененных белков, т.е. формирование аутоиммунных реакций [6, 10, 11]. Важную роль в развитии воспалительного ответа, тромбоэмболических осложнений и аутоиммунных реакций при COVID-19 играет процесс формирования нейтрофильных внеклеточных ловушек – разрушение активированных патогеном нейтрофилов, которые образуют внеклеточные сети, содержащие внеклеточные белки, хроматин, ДНК клеток и связанные компоненты вируса [13].
Активация системы врожденного и адаптивного иммунитета и вызванная этим воспалительная реакция лежат в основе развития патологии скелетно-мышечной системы в пери- и постинфекционном периоде. Собственно цитопатическое действие SARS-CoV-2 имеет здесь относительно небольшое значение. Существует несколько «сценариев» развития иммунного воспаления, приводящего к развитию артралгий и артрита [6, 10, 11]:
- неспецифическое системное воспаление, связанное с образованием иммунных комплексов, содержащих антигены (PAMP, DAMP, белки вируса), антитела и белки комплемента, и фиксация последних на эндотелиальных клетках. Синовиальная оболочка с ее разветвленной капиллярной сетью становится «мишенью» для данного процесса;
- развитие аутоиммунной реакции, связанной со сходством (мимикрией) компонентов вируса и PAMP с белками организма-«хозяина». Согласно работе Dotan А. et al. (2021), у человека есть как минимум 34 белка, которые имеют сходные гептапептиды с белками SARS-CoV-2 [20];
- активация под влиянием вирусной инфекции и адаптивного иммунного ответа уже существующих «запретных» клонов Th17-клеток, вызывающих аутоиммунный ответ против собственных белков, – так называемая реакция «постороннего» (bystander).
Развитие аутоиммунных нарушений при COVID- 19 отражает появление как в остром периоде инфекции, так и после элиминации вируса широкого спектра аутоантител. У 10–50% пациентов, госпитализированных в связи с тяжелым течением COVID-19, обнаруживался высокий титр антинуклеарных антител (АНА) [14– 16]. Anaya J-M. et al. [17], проведя метаанализ 13 исследований, определили среднюю частоту повышения АНА при COVID-19 как 32,1% (95% доверительный интервал (ДИ): 15,6–54,7). Помимо АНА, отмечалось повышение уровня ревматоидного фактора (РФ) – у 19,9% пациентов; антител к кардиолипину: IgM – у 10,6%, IgG – у 8,6%; антител к β2 гликопротеину-1: IgM – у 7,7%, IgG – у 5,4%; антител к циклическому цитруллинированному пептиду (АЦЦП) – у 5,6%; антител к тиреопероксидазе – у 36,7% и др.
По данным Seeble J. et al. [18], в когорте пациентов, перенесших COVID-19 12 мес назад, АНА в титре ≥1:160 обнаруживались в 43,6% случаев.
Иммунные реакции, возникающие в ходе инфекции SARS-CoV-2, влекут за собой развитие целого ряда аутоиммунных нарушений и заболеваний de novo. В мировой научной печати имеется серия описаний возникновения после COVID-19 синдрома Гийена–Барре, болезни Кавасаки и других системных васкулитов, кожного васкулита, антифосфолипидного синдрома, РА, системной красной волчанки, полимиозита, аутоиммунной гемолитической анемии, иммунной тромбоцитопенический пурпуры, сахарного диабета 1-го типа (инсулинзависимого) и др. [6, 7, 19, 20].
В зависимости от характера и выраженности иммунных реакций варьирует и тяжесть патологических изменений суставов и позвоночника: в большинстве случаев это преходящие артралгии и миалгии, сопутствующие острой стадии заболевания, а также постинфекционному периоду (длительный COVID-19, или постковидный синдром). Однако в ряде случаев перенесенная инфекция SARS-CoV-2 приводит к развитию постинфекционного артрита (ПИА) или становится триггером системного аутоиммунного ревматического заболевания, такого как РА.
АРТРАЛГИИ ПРИ COVID-19 И ПОСТКОВИДНОМ СИНДРОМЕ
По данным серии наблюдений, скелетно-мышечные боли выступают одним из наиболее частых проявлений острой инфекции COVID-19. Так, в зависимости от исследуемых групп пациентов, частота миалгий колебалась от 50,0 до 84,4%, полиартралгии – от 13,5 до 90,8%. Скелетно-мышечная боль становилась причиной использования парацетамола или нестероидных противовоспалительных препаратов (НПВП) у >80% пациентов с COVID-19 [21–23]. По данным Tuzun S. et al. [24], артралгии наиболее часто отмечались в лучезапястных, голеностопных и коленных суставах.
Артралгии могут сохраняться, усиливаться или возникать вновь после завершения острого периода COVID-19 и элиминации вируса. В этом случае боли в суставах и мышцах становятся одним из проявлений постковидного синдрома (ПКС), вызывающим серьезное беспокойство и существенно снижающим качество жизни пациентов. Так, Lopez-Leon S. et al. [25], выполнив метаанализ 15 исследований (n=47 910), представили список из 50 основных проявлений ПКС, которые отмечались в период от 14 до 110 дней после завершения острой фазы инфекции. На первом месте были утомляемость (58,0%), головная боль (44,0%) и нарушение внимания (27,0%). Артралгии входили в число наиболее частых симптомов ПКС, в среднем выявляясь у 19,0% пациентов. В более поздней публикации Anaya J.-M. et al. [17], представивших метаанализ 40 исследований (n=11 196), помимо артралгий, в при ПКС была отмечена высокая частота боли в спине – 30,3% (рис. 1).

Боли в суставах в рамках ПКС могут сохраняться и при длительном сроке наблюдения. По результатам исследования Karaarslan F. et al. [26], которые провели телефонный опрос 285 пациентов, перенесших COVID-19 (случаи, потребовавшие госпитализации), через 6 мес после завершения острой фазы инфекции те или иные ревматологические симптомы имелись у 43,2% респондентов. Среди этих проявлений наиболее часто встречались утомляемость (31,6%), боли в суставах (18,6%) и миалгии (15,1%). Близкие данные были получены в ходе телефонного опроса, проведенного Zayet S. et al. [27]: среди 354 пациентов, перенесших подтвержденный полимеразной цепной реакцией (ПЦР) COVID-19, через 9 мес у 35,9% отмечался хотя бы один симптом заболевания. Из 127 пациентов с ПКС 26,0% предъявляли жалобы на артралгии, а 24,4% – на миалгии.
ПОСТИНФЕКЦИОННЫЙ АРТРИТ
Диагноз ПИА правомочен в том случае, если имеется доказанная инфекция SARS-CoV-2; артрит возникает в период окончания ее острой фазы (через 1–12 нед после появления первых симптомов COVID-19), при этом отсутствуют четкие лабораторные признаки другого ревматического заболевания, такие как РФ, АЦЦП и АНА [28–31]. Качественное описание данной патологии было дано в работе Kocyigit В. et Akyol А., опубликованной в ноябре 2021 г. [32]. Авторы представили собственный клинический случай ПИА, а также обзор 21 клинического наблюдения ПИА после COVID-19, описанного в 20 журнальных публикациях.
Развитие ПИА отмечалось через 7–90 (в среднем 18) дней после дебюта COVID-19; при этом в 12 случаях артрит развился у лиц с легким и среднетяжелым течением инфекции, не потребовавшим госпитализации. В большинстве случаев (n=14) ПИА возник у мужчин, медиана возраста пациентов составила 50 лет. В 11 случаях наблюдался моноартрит, в 5 – олигоартрит (поражение ≤3 суставов), в 5 – полиартрит (поражение >3 суставов), преимущественно нижних конечностей (рис. 2). Ни в одном случае не было обнаружено значительного повышения РФ и АЦЦП; только в одном случае был увеличен уровень АНА, в 4 случаях выявлен HLA B27 [32].
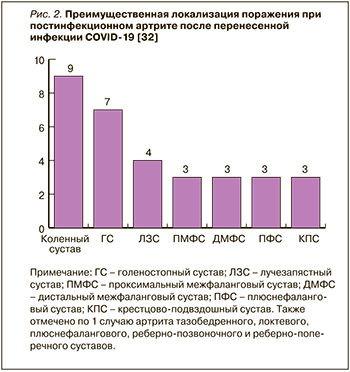
ПИА, как правило, протекает благоприятно и обычно через 2–4 нед терапии благополучно разрешается. В представленных случаях 19 больным были назначены НПВП как в варианте монотерапии, так и в комбинации с внутрисуставным введением или коротким курсом системных глюкокортикоидов (ГК), у трех пациентов проводилась монотерапия ГК. В одном случае также был использован сульфасалазин, еще в одном – цертулизумаба пэгол [32].
Правда, недавно было опубликовано сообщение о развитии ПИА голеностопного сустава, резистентного к терапии НПВП и локальной инъекции ГК, который сопровождался выраженными эрозивными изменениями и потребовавшего в итоге (через 2 мес после дебюта) артроскопической синовэктомии. В этом случае артрит развился остро на 6-й день после появления симптомов COVID- 19, не сопровождался повышением РФ, АЦЦП и АНА, HLA B27 был отрицательным, кристаллы моноурата натрия в синовиальной жидкости не выявлялись. Однако ранее у пациента имели место гиперурикемия и перелом костей голени [33].
Развитие ПИА в виде недифференцированного артрита, а также его трансформация в конкретные нозологические формы ревматических заболеваний, в частности в РА, были описаны в работе В.И. Мазурова с соавт. [34].
COVID-19 КАК ПУСКОВОЙ МЕХАНИЗМ РЕВМАТОИДНОГО АРТРИТА
Больные РА, как и другими системными воспалительными заболеваниями, имеют более высокий риск тяжелого течения COVID-19 [35]. Это демонстрирует, в частности, масштабная работа американских ученых Raiker R. et al. [36], которые сопоставили исходы данной инфекции у 9730 пациентов с РА и 656 979 лиц, не страдавших этим заболеванием. У больных РА наблюдался более высокий относительный риск госпитализации – 1,60 (95% ДИ: 1,55–1,66), тяжелого течения COVID-19 – 1,89 (95% ДИ: 1,74–2,06), необходимости перевода в отделение интенсивной терапии – 1,86 (95% ДИ: 1,71 –2,05) и летального исхода – 2,11 (95% ДИ: 1,90–2,34).
Вместе с тем у проблемы влияния COVID-19 на ревматологическую патологию есть еще один важный аспект. Как было отмечено выше, аутоиммунные нарушения, возникающие в ходе инфекции SARS-CoV-2, способны выступать в роли «триггера» ряда системных ревматических заболеваний, в том числе РА [6, 7].
В мировой медицинской литературе есть несколько публикаций, в которых представлены клинические наблюдения развития РА у лиц, перенесших COVID-19 [37]. Вероятно, первой из них стала работа Perrot L. et al. [38], описавших случай серопозитивного по РФ и АЦЦП РА, дебютировавшего у 60-летней женщины на 25-й день после появления симптомов COVID-19. Важно подчеркнуть, что у пациентки отмечался высокий уровень АНА (в титре 1/1280). Описание серопозитивного РА, возникшего после COVID-19, представили Baimukhamedov С. et al. [39]. Серия из 6 случаев развития серопозитивного РА у пациентов, перенесших COVID-19, была зафиксирована Roongta R. et al. [40].
Не во всех случаях РА, возникший после инфекции SARS-CoV-2, имеет классический серопозитивный характер. Так, Derksen V. et al. [41] представили серию из 3 случав стойкого полиартрита, выявленного у реконвалесцентов после COVID-19, у которых уровни РФ и АЦЦП не были повышены. Аналогично Mukarram M. et al. [42] описали серию из 5 случаев стойкого полиартрита, «фенотипически напоминающего» РА, у пациентов, перенесших COVID-19 за 6–10 нед до развития поражения суставов. Хотя во всех случаях тесты на РФ и АЦЦП были негативными, клиника соответствовала диагнозу серонегативного РА, а длительное сохранение симптомов болезни, несмотря на прием НПВП, потребовало назначения ГК и базисных противовоспалительных препаратов.
В настоящее время появляются сообщения о развитии РА после вакцинации от инфекции SARS- CoV-2, однако это лишь единичные публикации; на основании существующих данных едва ли можно думать о какой-либо серьезной проблеме в этой области [43, 44].
ПАЦИЕНТ С СУСТАВНЫМ СИНДРОМОМ ПОСЛЕ ПЕРЕНЕСЕННОГО COVID-19 НА ПРИЕМЕ ВРАЧА ОБЩЕЙ ПРАКТИКИ
Количество пациентов, перенесших COVID- 19, неуклонно возрастает: по данным института Джона Хопкинса, число жителей России, болеющих или уже переболевших этой инфекцией, на 7 февраля 2022 г. составляло >12,7 млн [45]. В связи с этим для современной системы здравоохранения проблема постковидных осложнений, в том числе связанных с сохранением или появлением ревматологической патологии, становится все более актуальной. Поэтому врачи общей практики, на которых в основном будет ложится обязанность оказания медицинской помощи пациентам с ПКС, должны иметь четкое представление о диагностических и терапевтических подходах при данной патологии.
Принципиальное значение при обследовании пациентов, перенесших COVID-19 и предъявляющих жалобы на артралгии, миалгии, скованность и повышенную утомляемость, имеет выделение групп риска – больных, имеющих признаки системных ревматических заболеваний. В этой ситуации следует обращать особое внимание на такие «красные флажки», как нарастание выраженности ревматологических симптомов, развитие артрита (припухлость и локальная болезненность сустава), стойкие артралгии и скованность в суставах кистей, воспалительный ритм болей в суставах и спине (появление или усиление болевых ощущений в покое и ночью, снижение их интенсивности после разминки или начала движения), положительный тест поперечного сжатия кисти, изменения кожи и слизистых, повышение скорости оседания эритроцитов и С-реактивного белка. При подозрении на системное ревматическое заболевание необходимо направить пациента на консультацию ревматолога [46, 47].
Пациенты с ПКС нуждаются в адекватной реабилитации – полноценной диете с включением необходимых нутриентов и витаминов (С, D, группы В), регулярной дозированной физической нагрузке, аэробных упражнениях, психологической поддержке. В качестве первой меры для восстановления после перенесенного COVID-19 можно рекомендовать прогулки на свежем воздухе с постепенным увеличением их длительности. Контроль скелетно-мышечной боли может потребовать назначения анальгетических средств: с этой целью в качестве препаратов первой линии целесообразно использовать парацетамол, местные формы (гели, мази) или безрецептурные пероральные НПВП [48–50].
Развитие ПИА и системных ревматических заболеваний требует своевременной диагностики и назначения активной противовоспалительной терапии (НПВП в полной фармакологической дозе, в ряде случаев – локальных и системных форм ГК), а также базисных противовоспалительных препаратов.



