ВВЕДЕНИЕ
Согласно данным Инициативы по улучшению глобальных исходов заболеваний почек (Kidney Disease: Improving Global Outcomes, KDIGО), ежегодно острое почечное повреждение (ОПП) развивается у 13,3 млн человек, что приводит к 1,7 млн летальных исходов [1]. Результаты обзора крупных исследований по данной теме свидетельствуют, что смертность от ОПП достигает 23,9% (95% доверительный интервал (ДИ): 22,1–25,7) [2]. Высокая распространенность и летальность при ОПП создают серьезную экономическую нагрузку на здравоохранение различных стран: так, у стационарных пациентов затраты на лечение возрастают в среднем на 1,795 тыс. долл. за госпитализацию (95% ДИ: 1,692–1,899 тыс.). Более того, примерно 5% больных необходимо проведение диализа, при котором расходы увеличиваются в среднем на 42 077 долл. [3]. По другим сведениям (исследование Zeng X. и et al.), дополнительные финансовые затраты на лечение ОПП доходят до 7100 долл. за госпитализацию [4]. Общие расходы системы здравоохранения Великобритании, связанные с ОПП, оцениваются в 1,02 млрд фунтов стерлингов в год [5].
Разработчики клинических практических рекомендаций KDIGO по ОПП считают, что для оценки риска развития этого заболевания, помимо сывороточного креатинина, необходимо введение новых диагностических биомаркеров [1]. Исходя из результатов современных исследований, в качестве многообещающих биомаркеров для ранней диагностики и прогнозирования ОПП можно рассматривать такие соединения, как интерлейкин 18 (ИЛ-18), цистатин C, кластерин, белок, связывающий жирные кислоты (L-FABP), остеопонтин, молекула повреждения почек-1 (KIM-1) и липокалин, связанный с нейтрофильной желатиназой (NGAL) [6].
КIМ-1 – белок проксимальных канальцев почек, внеклеточный компонент которого включает домены 6-цистеина (со структурой, напоминающей иммуноглобулины) и O-гликозилированного муцина [12]. В опубликованных научных работах предполагается, что KIM-1 принимает участие в процессе фагоцитоза в поврежденной почке: превращая проксимальную эпителиальную клетку в фагоцит, эта молекула запускает важные патофизиологические механизмы для активного иммунного ответа и процесса восстановления тканей после повреждения [14]. Метаанализ, включающий 11 исследований, показал высокую чувствительность мочевого KIM-1 для диагностики ОПП – 74,0% – при специфичности 86,0% [13].
NGAL является секретируемым гликопротеином размером 25 кДа. Первоначально он был обнаружен в зрелых гранулах нейтрофилов, а в дальнейшем и в других типах клеток. Среди функций NGAL описаны стимуляция дифференциации и пролиферации клеток, способность действовать как фактор роста, хемотаксис, транспорт железа [7, 8, 10]. Также этот биомаркер обладает бактериостатическим эффектом [9]. По данным Mori K. et al. (2005), при ОПП уровень NGAL может увеличиваться в 1000 раз в моче (0,04–40 мг/мл) и до 300 раз в крови (100–3000 нг/мл) [11].
Несмотря на большое количество исследований диагностического значения вышеупомянутых маркеров, их прогностическая функция в отношении ОПП остается малоизученной. В связи с этим целью нашего исследования стали изучение и оценка прогностической и диагностической значимости маркеров NGAL и KIM-1 в крови при ОПП у пациентов, получающих антибактериальную терапию.
МАТЕРИАЛ И МЕТОДЫ
Методом проспективного анализа у 276 послеоперационных больных отделения урологии и колопроктологии была оценена частота ОПП в соответствии с критериями клинических практических рекомендаций KDIGO [1] после назначения антибактериальных препаратов из группы цефалоспоринов, карбапенемов, фторхинолонов, ванкомицина, амоксициллина и клавулановой кислоты, амикацина, метронидазола, доксициклина, джозамицина, фосфомицина. Критерием отбора больных в исследование была инициация антибиотикотерапии, при этом терапия сопутствующих заболеваний в период исследования не изменялась.
Пациенты, получавшие иммуносупрессивную, противовирусную терапию или проходящие инструментальные исследования, предполагающие введение контрастных веществ, в исследование не включались.
Исследование уровня сывороточных концентраций новых маркеров и креатинина выполнялось перед назначением антибиотика, через 24–48 ч после назначения антибактериального препарата, а у пациентов с ОПП – через 72–96 ч и далее 1 раз/ сут до восстановления функции почек.
Исследование сывороточной концентрации маркеров в крови проводилось методом иммуноферментного анализа при помощи специальных реактивов: для NGAL – Human lipocalin-2/NGAL ELISA (BioVendor, Чехия), для KIM-1 – Human Serum TIM-1/KIM-1/HAVCR Quantikine ELISA (R&D Systems, США). Уровень сывороточного креатинина определялся на автоматическом биохимическом анализаторе выборочного действия Advia-1800 (Siemens, США), при этом применялись коммерческие оригинальные реагенты для биохимических анализаторов серии Advia (Siemens, США). Уровень протеинурии оценивался на автоматическом анализаторе CLINITEK Novus (SiemensHealthcareDiagnostics, США) с использованием кассет CLINITEK Novus 10 (SiemensHealthcareDiagnostics, США). Расчет скорости клубочковой фильтрации (СКФ) выполнялся по формуле Кокрофта–Голта.
Исследование было одобрено локальным этическим комитетом ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет), протокол от 22.01.2021 № 01-21.
Статистическая обработка полученных результатов осуществлялась при помощи статистической программы MedCalc (версия 18.11) для Windows XP Vista. Нормальность распределения полученных данных определялась по критерию Колмогорова–Смирнова. При наличии нормального распределения данные представляли в виде среднего значения М и среднеквадратичного отклонения (s). Статистическая значимость разницы оценивалась по критерию Стьюдента (t), при проведении множественных сравнений – по критерию Стьюдента с поправкой Бонферрони. При отсутствии нормального распределения значения представляли в виде медианы (Mo) и ее 95% ДИ. Статистическую значимость разницы значений определяли по критерию Манна–Уитни (для независимых выборок) и по критерию Уилкоксона (для парных выборок). Зависимость КИМ-1 и развития ОПП оценивали по результатам ROC-анализа, рассчитывали отношение шансов (ОШ) и диагностическую значимость. Различия считались статистически значимыми при р <0,05.
РЕЗУЛЬТАТЫ
На фоне применения антибиотиков ОПП развилось у 99 человек, что составило 35,86% (95% ДИ: 30–42%).
До назначения антибиотиков уровень NGAL варьировал от 9,969 до 241,708 нг/мл, медиана значений составила 80,193 нг/мл (95% ДИ: 76,971–94,620). Уровень KIM-1 также значительно колебался – от 7,700 до 1517 пг/мл, медиана значений равнялась 55,560 пг/мл (95% ДИ: 45,708–73,661).
Учитывая, что у пациентов наблюдалось различное функциональное состояние почек на момент начала исследования, мы оценили уровень NGAL и KIM-1 в зависимости от стадии хронической болезни почек (ХБП). Значения медиан представлены в таблице 1. Данные значения возрастали с повышением стадии ХБП, при этом в случае ХБП 1-й и 2-й стадий наблюдалась достоверность различий в показателях маркеров по сравнению с ХБП 3а и 3b. Полученный результат позволяет предположить, что высокий уровень NGAL и KIM-1 служит маркером сниженной функции почек.
Также нами была оценена зависимость уровней NGAL и KIM-1 от такого показателя функционального состояния почек, как протеинурия. Последняя была выявлена у 85 (30,8%) из 276 пациентов, получавших антибиотики.
У пациентов с протеинурией медиана значений NGAL составила 80,1 нг/мл (95% ДИ: 75,7–121,9) против 80,2 нг/мл (95% ДИ: 76,9–95,4) у больных без протеинурии; статистически значимой разницы при этом обнаружено не было.
В группе пациентов с протеинурией значение медианы уровня KIM-1 в крови составило 87,62 пг/ мл (95% ДИ: 55,56–145,72) против 46,88 пг/мл (95% ДИ: 34,1026–67,3144) у больных без протеинурии; выявленная разница была статистически значимой (p=0,034). Таким образом, одним из факторов, вероятно повлиявших на динамику KIM-1, мог быть факт наличия протеинурии еще до назначения антибиотиков.
Принимая во внимание выявленные изменения концентраций изучаемых маркеров в зависимости от стадии ХБП и протеинурии, с целью уточнения значений NGAL и KIM-1 для прогноза развития ОПП мы сгруппировали больных по принципу случай (больные с ОПП) – контроль (больные без ОПП), по 60 человек в каждой. Эти группы не отличались по основным клиническим параметрам, назначенным антибиотикам, сопутствующей терапии и функциональному состоянию почек до начала антибиотикотерапии (табл. 2).
Для оценки взаимосвязи между уровнями NGAL и KIM-1 и развитием ОПП был проведен ROC-анализ, результаты которого приведены в таблице 3. Для NGAL достоверное значение площади под кривой (AUC) отмечалось в случае с его показателями до начала антибиотикотерапии. Для уровня KIM-1 достоверная AUC отражала взаимосвязь между развитием ОПП и его значениями через 24–48 ч после начала лечения.
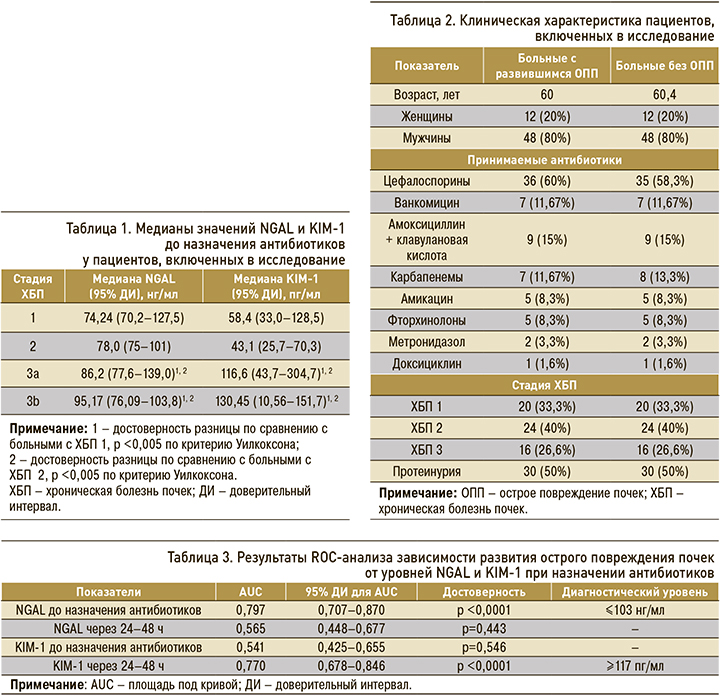
Критический уровень NGAL по результатам ROC-анализа составлял ≤103 нг/мл до назначения антибиотиков. Такие значения отмечались у 47 больных: у 40 (85,1%) из них развилось ОПП, у 7 (14,9%) признаков ОПП не было. Таким образом, ОШ развития ОПП при назначении антибиотиков у больных с уровнем NGAL ≤103 нг/мл составило 15,1 (95% ДИ: 5,8–39,3; p <0,0001). Достоверная ROC-кривая зависимости развития ОПП от уровня NGAL до назначения антибиотиков представлена на рисунке 1.
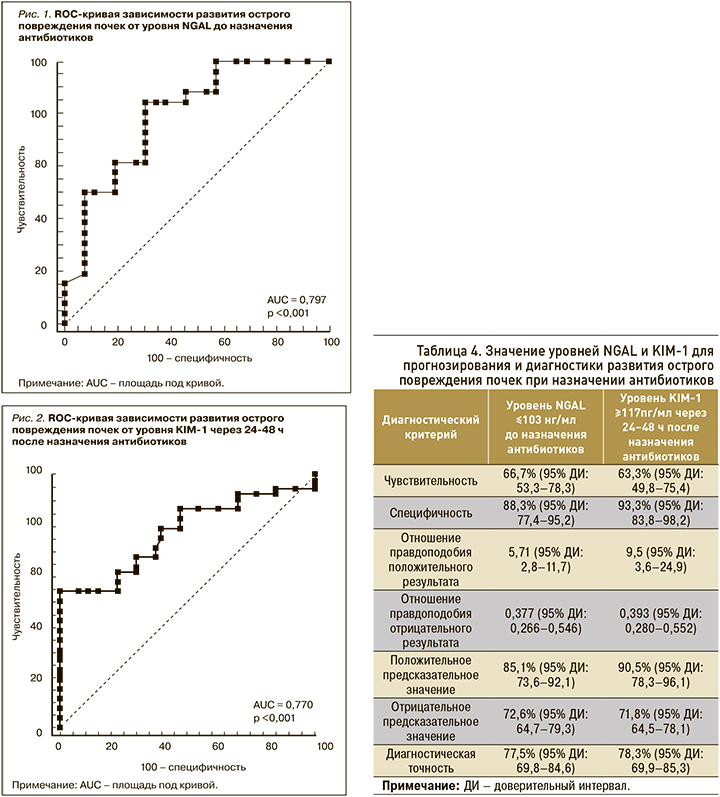
Критически значимый для развития ОПП уровень KIM-1 через 24–48 ч после назначения антибиотиков составлял ≥117 пг/мл; он был определен у 42 больных, у 38 (90,5%) из которых развилось ОПП, а у 4 (9,5%) диагностических признаков ОПП не наблюдалось. ОШ развития ОПП при повышении уровня KIM-1 ≥117 пг/мл составило 24,2 (95% ДИ: 7,2–75,8). Достоверная ROC-кривая зависимости развития ОПП от уровня KIM-1 через 24–48 ч после назначения антибиотиков представлена на рисунке 2.
Для дополнительной оценки прогностической и диагностической значимости установленной взаимосвязи по результатам ROC-анализа были рассчитаны показатели, характеризующие уровень прогностической и диагностической значимости новых биомаркеров (табл. 4).
Для уровня NGAL ≤103 нг/мл (до назначения антибактериальных препаратов) чувствительность в отношении прогноза развития ОПП составила 66,7% (95% ДИ: 53,3–78,3), специфичность – 88,3% (95% ДИ: 77,4–95,2), диагностическая точность – 77,5% (95% ДИ: 69,8–84,6).
Что касается диагностической значимости уровня KIM-1 ≥117 пг/мл (через 24–48 ч после назначения антибиотиков), то для него чувствительность составила 63,3% (95% ДИ: 49,8–75,4;), специфичность – 93,3% (95% ДИ: 83,8–98,2), диагностическая точность – 78,3% (95% ДИ: 69,9–85,3).
ОБСУЖДЕНИЕ
У подавляющего большинства включенных в исследование больных еще до применения антибактериальных препаратов наблюдалось нарушение функции почек, что выражалось в снижении клубочковой фильтрации и наличии протеинурии. Вероятно, с этими факторами связана высокая
частота развития ОПП при назначении антибиотиков в исследуемой группе.
Полученные результаты свидетельствовали о высоком прогностическом значении уровня NGAL.
Прогностическое значение уровня NGAL ≤103 нг/мл у больных до назначения антибиотиков в отношении развития ОПП, вероятно, обусловлено снижением протективной функции этого маркера при малых его сывороточных концентрациях. Важная роль NGAL в восстановлении функции почек после повреждения была описана в исследовании Schmidt-Ott K.M. et al. [10]. Похожая тенденция для NGAL была выявлена и в других исследованиях, посвященных возможностям прогнозирования и ранней диагностики ОПП. Согласно результатам нашего исследования, уровни сывороточного NGAL для прогнозирования ОПП соответствовали AUC 0,797. Отметим, что этот показатель согласуется с результатами исследования Chen J.J. et al. (2021), в котором концентрации сывороточного NGAL для прогнозирования ОПП соответствовали AUC в диапазоне 0,71–0,89 [14].
Данным, свидетельствующим о более низком уровне NGAL у пациентов с развившимся впоследствии ОПП, в сравнении с пациентами без такового повреждения, соответствуют результаты исследования Jahaj E. et al. (2021). Однако в нашем исследовании были установлены более выраженные уровни чувствительности и специфичности этого маркера в отношении прогнозирования ОПП – 66,7 и 88,3% соответственно, тогда как в указанном исследовании аналогичные показатели равнялись 61,87 и 59,14% соответственно [15].
Уровень сывороточного KIM-1 показал более высокую чувствительность и специфичность в отношении ранней диагностики ОПП: концентрация этого маркера ≥117 пг/мл через 24–48 ч после назначения антибиотиков обладает чувствительностью 66,7% и специфичностью 63,3%. В то же время KIM-1 не показал статистически значимых значений для прогноза развития ОПП. Более высокий уровень KIM-1 через 24–48 ч у пациентов c ОПП также может свидетельствовать о его репаративной роли, описанной в литературных данных [16]. Тенденция к повышению уровня KIM-1 через 24–48 ч у пациентов c ОПП была отмечена и в других исследованиях (Lee C.W. et al., 2018), однако статистической значимости разницы при этом обнаружено не было [17].
ЗАКЛЮЧЕНИЕ
- Определение уровня NGAL и KIM-1 у больных с риском развития ОПП позволяет улучшить прогноз развития и диагностику этого заболевания. Это позволит повысить эффективность терапии и снизить риск серьезных нефротоксических реакций при лечении антибактериальными препаратами.
- Уровень NGAL менее 103 нг/мл может служить прогностическим фактором развития ОПП при назначении антибиотиков.
- Повышение уровня KIM-1 в сыворотке крови более 117 пг/мл в течение первых 24–48 ч после назначения антибиотиков может служить ранним диагностическим критерием развития ОПП.



