ВВЕДЕНИЕ
В настоящее время весь мир охвачен пандемией новой коронавирусной инфекции COVID-19, обусловленной новым штаммом коронавирусов – SARS-CoV-2 [1]. Первые случаи заболевания были зарегистрированы в городе Ухане (Китай) в декабре 2019 г. 31 января 2020 г. Всемирная организация здравоохранения (ВОЗ) объявила COVID-19 чрезвычайной ситуацией в области общественного здравоохранения, имеющей международное значение, а 11 марта 2020 г. она была окончательно охарактеризована как пандемия [2].
SARS-CoV-2 представляет собой оболочечный, несегментированный, одноцепочечный, позитивно-смысловой РНК-вирус, относящийся к царству Riboviria, отряду Nidovirales, подотряду Cornido virineae, семейству Coronaviridae, подсемейству Orthocoronavirinae, роду Betacoronavirus, подроду Sarbecovirus, виду SARS [1]. К этому же роду принадлежат вирусы SARS-CoV и MERS- CoV, приводящие к тяжелому острому респираторному синдрому (ТОРС, вспышка 2003 г.) и ближневосточному респираторному синдрому (вспышка 2013–2015 гг.) соответственно [3]. Степень гомологии геномов SARS-CoV-2 и SARS-CoV составляет порядка 79%. Все вышеперечисленные коронавирусы являются зоонозными, при этом природный резервуар SARS-CoV-2 неизвестен; возможно, им, как и в случае с SARS-CoV, служат летучие мыши [1].
Среди структурных белков SARS-CoV-2 выделяют S-белок (спайковый белок, или «белковый шип»), мембранный белок, белок оболочки и белок нуклеокапсида. S-белок играет важную роль в прикреплении, слиянии и проникновении вируса в клетки [3].
В качестве ключевого фактора вирулентности рассматривается взаимодействие рецептор-связывающего домена S-белка, расположенного на внешней мембране SARS-CoV-2, с рецептором ангиотензинпревращающего фермента 2 (АПФ2), активируемого трансмембранными сериновыми протеазами [4, 5]. Как ключевой фактор вирулентности рассматривается взаимодействие рецептор-связывающего домена S-белка, расположенного на внешней мембране SARS-CoV-2, с рецептором ангиотензинпревращающего фермента 2 (АПФ2), активируемого трансмембранными сериновыми протеазами [5]. AПФ2 высоко экспрессируется в альвеолярных клетках легких и в миокарде [6]. Несмотря на тропизм SARS-CoV-2 к легким, при COVID-19 отмечен весьма высокий риск развития полиорганной недостаточности, в том числе поражения сердечно-сосудистой системы [7, 8].
Примерно у половины пациентов, инфицированных SARS-CoV-2, определена мультиморбидность, частота которой увеличивается до 72% при тяжелом варианте течения заболевания [9]. Больные COVID-19 часто страдают заболеваниями сердца, а также имеют такие факторы риска, как ожирение и сахарный диабет (СД) [9]. Согласно ретроспективному анализу данных (n=1590, Китай), у четверти больных COVID-19 была выявлена сопутствующая патология [10]. Артериальная гипертензия (АГ) встречалась у 16,9% больных, другие сердечно-сосудистые заболевания (ССЗ) – у 53,7%, СД – у 8,2% [10].
Американские ученые доложили о наличии АГ у 56,6%, ишемической болезни сердца (ИБС) – у 11,1%, ожирения – у 41,7%, СД – у 33,8% больных COVID-19 [11].
Onder G. et al., анализируя когорту больных COVID-19 (n=22 512, из которых умерли 355), выявили, что 30% пациентов страдали ИБС, 35,5% – СД, 24,5% – фибрилляцией предсердий (ФП). У 9,6% пациентов было в анамнезе перенесенное острое нарушение мозгового кровообращения (ОНМК). Только 3 пациента (0,8%) не имели сопутствующих патологий, 89 (25,1%) страдали одним заболеванием, 91 (25,6%) – двумя, а 172 (48,5%) – тремя или более. Наличие сопутствующей патологии увеличивало риск летальности независимо от наличия инфекции COVID-19 [12].
В ретроспективном анализе клинико-демографических данных 1007 пациентов COVID-19, поступивших в отделения реанимации и интенсивной терапии клиник нашей страны с острым респираторным дистресс-синдромом (ОРДС), у 61,4% из них были выявлены ССЗ. Часто встречались АГ (56,3%) и ИБС (16,3%), реже – перенесенное ОНМК (7,1%) и ФП (9,3%). Ожирением страдали 26,1%, СД – 25% больных. Частота ССЗ увеличивалась с возрастом, достигая более 80% в группе лиц пожилого и старческого возраста [13].
Показано, что повреждение миокарда, определяемое повышенными уровнями сердечного тропонина I (сТнI, cTnI) в сыворотке крови пациентов с COVID-19, было связано с высокой смертностью [7, 14, 15]. Кроме того, сердечная недостаточность (СН) обнаружена у 23% больных с COVID-19, что также было более распространено среди умерших больных по сравнению с выжившими (51,9 против 11,7%) [14].
На основе этих наблюдений было постулировано несколько теорий, отражающих связь патофизиологических аспектов COVID-19 и сердечно-сосудистой системы [7, 16, 17]. А именно: COVID- 19 может усугубить кардиоваскулярные факторы риска и ранее существовавшие ССЗ либо привести к развитию сердечно-сосудистых осложнений. Кроме этого, ССЗ могут предрасполагать к высокой заболеваемости и смертности у пациентов с COVID-19, что отражено в ряде исследований. При COVID-19 крайне важно определять пациентов с повышенным риском неблагоприятных исходов, связанных с ССЗ. Этого можно достичь с помощью исследований биологических маркеров крови, таких как cTn.
МЕТОДОЛОГИЯ ПОИСКА ИСТОЧНИКОВ
В нашей статье представлен обзор актуальных публикаций, посвященных изучению прогностической роли сердечно-сосудистых биологических маркеров при COVID-19. Анализ источников литературы проводился в базах данных PubMed, РИНЦ, MedLine, Google Scholar, Science Direct. Рассматривались зарубежные и отечественные статьи. Поиск выполнялся соответственно следующим ключевым словам: COVID-19, «сердечно-сосудистые биологические маркеры», «сердечный тропонин», cardiovascular biological markers, cardiac troponin. Результаты различных исследований свидетельствуют, что существует огромный научный интерес к изучению прогностической ценности cTn при COVID-19.
СЕРДЕЧНЫЕ ТРОПОНИНЫ ПРИ COVID-19
Возможные механизмы, лежащие в основе повреждения миокарда у пациентов с инфекцией COVID-19, не полностью изучены, но, вероятнее всего, являются многофакторными (рис. 1) [17–28]. Повреждение миокарда может быть обусловлено прямым воздействием вируса на эндотелиальные клетки и кардиомиоциты, опосредованным рецептором АПФ2. Вовлечение миокарда также может быть связано с развитием «цитокинового шторма» и апоптозом кардиомиоцитов. Наряду с этим ишемическое повреждение и даже инфаркт миокарда (ИМ) могут быть следствием шока, гипоксии различного генеза и длительной тахикардии.
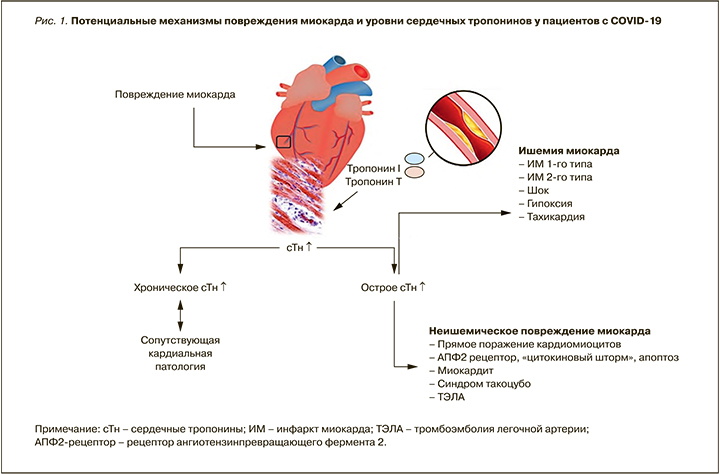
По мнению Sandoval Y. et al., для любого пациента с увеличением cTn >99-й процентиля рост этого маркера должен интерпретироваться или как хроническое повреждение миокарда (при повышенном тропонине, не изменяющемся за время наблюдения), или как острое неишемическое поражение миокарда (при значениях тропонина, повышающихся/снижающихся за время наблюдения), или как острый ИМ (при уровне тропонина, повышающемся/снижающемся за время наблюдения и сопровождающемся ишемическими изменениями на ЭКГ) [27].
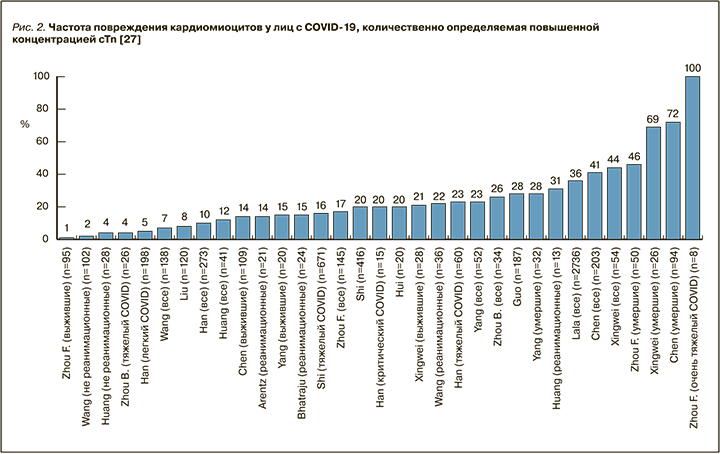
Когортные исследования пациентов, госпитализированных с COVID-19, продемонстрировали, что около 10–20% пациентов имели повышение уровня cTn, причем чаще это встречалось у лиц, поступивших в отделение интенсивной терапии, и у умерших [17–28]. У большинства выживших больных концентрации данного маркера оставались в нормальном диапазоне. Частота повреждения кардиомиоцитов, количественно определяемое повышенной концентрацией cTn, росла по мере утяжеления состояния больных [14, 27]. У умерших лиц рост уровня cTn зависел от тяжести COVID-19 и развития ОРДС (рис. 2) [17–28].
Huang C. et al. сообщили о значительном повышении cTnI (>28 пг/мл) у 5 из 41 (12%) пациентов с COVID-19 [29]. У всех 5 пациентов затем развилось острое повреждение миокарда, а 4 из 5 были госпитализированы в отделение интенсивной терапии; это позволяет концептуализировать cTnI как прогностический лабораторный инструмент при COVID-19 [29].
В метаанализе 4 исследований с участием 341 больных COVID-19 сообщалось о значительно более высокой разнице средних значений cTnI у пациентов с более тяжелым течением новой коронавирусной инфекции по сравнению с больными, имевшими нетяжелое течение заболевания (25,6 нг/л; 95% доверительный интервал (ДИ): 6,8–44,5 нг/л) [30].
В когорте госпитализированных пациентов с лабораторно подтвержденным COVID-19 (n=2736, средний возраст 66,4 лет, 59,6% мужчин) cTnI измеряли в течение 24 ч от момента поступления. Отмечена большая частота ССЗ (ИБС, ФП, АГ и СН) у лиц с более высокими концентрациями cTnI. В общей сложности 506 (18,5%) больных умерли во время госпитализации, 985 (36%) пациентов имели повышенные уровни cTnI. После корректировки на клинические факторы даже несущественное повреждение миокарда (например, cTnI >0,03 до 0,09 нг/мл; n=455; 16,6%) было в значительной степени связано с летальностью (скорректированное отношение рисков (ОР): 1,75; 95% ДИ: 1,37–2,24; p <0,001). Более высокие концентрации исследуемого биомаркера (>0,09 нг/мл; n=530; 19,4%) были значимо связаны с высоким риском смертности (ОР: 3,03; 95% ДИ: 2,42–3,80; p <0,001) [18].
Guo T. et al. провели ретроспективное исследование, посвященное анализу связи ССЗ с летальными исходами у лиц с COVID-19. Среди 187 пациентов с подтвержденным COVID-19 144 (77%) были выписаны, а 43 (23%) умерли. Средний возраст больных составил 58,5 лет. 66 (35,3%) имели сопутствующие ССЗ, включая АГ, ИБС и кардиомиопатию, у 52 (27,8%) было выявлено повреждение миокарда (повышенный уровень cTnT). Смертность во время госпитализации составила 7,62% (8 из 105) у пациентов без ССЗ с нормальным уровнем cTnT, 13,33% (4 из 30) – у больных с сопутствующими ССЗ и нормальным уровнем cTnT, 37,50% (6 из 16) – у пациентов без ССЗ, но с повышенным уровнем cTnT, 69,44% (25 из 36) – у больных с ССЗ и повышенными cTnT. Пациенты с ССЗ чаще имели повышение уровня cTnT по сравнению с пациентами без ССЗ: 36 (54,5%) против 16 (13,2%). Уровни cTnT в плазме продемонстрировали высокую и значимую положительную взаимосвязь с концентрациями высокочувствительного С-реактивного белка в плазме (β=0,530; p <0,001) и уровнями N-концевого предшественника мозгового натрийуретического пептида (NT-proBNP) в плазме (β=0,613; p <0,001). Уровни cTnT и NT-proBNP во время госпитализации и ближе к дате смерти значительно увеличились у умерших больных (p=0,001; p <0,001). Не было отмечено значительных динамических изменений cTnT и NT-proBNP у выживших пациентов (p=0,96; p=0,16). Во время госпитализации у больных с повышенным уровнем cTnT чаще диагностировались злокачественные аритмии, им чаще требовалось назначение глюкокортикостероидной терапии (37 [71,2%] против 69 [51,1%]) и искусственной вентиляции легких (31 [59,6%] против 14 [10,4%]) по сравнению с пациентами с нормальным уровнем cTnT [31].
В исследование Shi S. et al. было включено 416 пациентов с COVID-19 (средний возраст 64 года, 50,7% женщин). В общей сложности 82 пациента (19,7%) имели повреждение миокарда; по сравнению с пациентами без повреждения миокарда они были старше, имели больше сопутствующих заболеваний, более высокий уровень лейкоцитов и С-реактивного белка (CPБ), прокальцитонина, изофермента креатинкиназы-MB (КФК-МВ), миогемоглобина, высокочувствительного тропонина I (hs-сTnI), NT-proBNP, аспартатаминотрансферазы (АСТ) и креатинина, а также более выраженные изменения на рентгенографии легких. Большему количеству пациентов с повреждением миокарда потребовалась неинвазивная и инвазивная искусственная вентиляция легких (ИВЛ) в сравнении с пациентами без повреждения миокарда. Осложнения (ОРДС, острое почечное повреждение, электролитные нарушения, гипопротеинемия и нарушения свертывания крови) чаще встречались у пациентов с повреждением миокарда, чем у пациентов без такового. Также у них была выше смертность. Регрессионная модель Кокса продемонстрировала, что больные с повреждением миокарда по сравнению с больными без повреждения миокарда имели более высокий риск смерти [20].
В исследование Tuo H. et al. было включено 148 пациентов с COVID-19 в критическом состоянии; у 19 из них (12,8%) наблюдались сердечно-сосудистые осложнения. Пятеро из этих пациентов выжили (5,2%), а 14 (26,9%) умерли. По сравнению с выжившими, у умерших лиц были более высокие уровни hs-сTnI, КФК-МВ, миоглобина и NT-proBNP (p <0,05). Возникновение неблагоприятных сердечно-сосудистых событий начиналось через 11–15 дней от начала заболевания и достигало пика через 14–20 дней. Авторы резюмировали, что мониторинг сердечных биомаркеров у пациентов с COVID-19 рекомендуется начинать как минимум с 11-го дня от начала заболевания [32].
Согласно данным исследования De Michieli L. et al., исходное значение hs-cTnI <6 нг/л при COVID- 19 характерно для пациентов с низким риском осложнений [33].
В ретроспективном исследовании Cordeanu E. et al. изучалась роль hs-cTnI в прогнозировании исходов заболевания у пациентов, госпитализированных с COVID-19. Было обследовано 772 больных (средний возраст 66 лет, 67 % мужчин), у 375 из них был проведен анализ крови на hs-TnI. 205 (55%) пациентам была назначена ИВЛ, 90 (24%) больных умерли. Повышение hs-cTnI было отмечено у 34% пациентов, при этом только у 3 пациентов был диагностирован острый коронарный синдром (ОКС) и у одного – миокардит. Смерть чаще наступала у лиц с повышением hs-cTnI (ОР 3,95; 95% ДИ: 2,69–5,71). В многофакторной регрессионной модели повышение hs-cTnI было независимо связано со смертностью (отношение шансов (ОШ) 3,84; 95% ДИ: 1,78–8,28), а также с возрастом ≥65 лет (ОШ 3,17; 95% ДИ: 1,45–7,18) и уровнем СРБ ≥100 мг/л (ОШ 3,62; 95% ДИ: 1,12–13,98). После выполнения анализа чувствительности для недостающих значений hs-cTnI повышение изучаемого маркера оставалось независимо и значимо связано со смертью (ОШ 3,84; 95% ДИ: 1,78–8,28). Данное исследование показало 4-кратное увеличение риска смерти в случае повышения hs-cTnI, что подчеркивает прогностическую ценность этого биомаркера в контексте COVID-19 [34].
При анализе данных 2147 пациентов, инфицированных SARS-CoV-2, включенных в регистр Lean European Open Survey on SARS-CoV ‑ 2 (LEOSS), были сопоставлены клинические данные и лабораторные значения у пациентов с сопутствующими ССЗ и без них на разных клинических стадиях заболевания. Предикторы смертности рассчитывались с использованием многофакторного регрессионного анализа. Авторы показали, что пациенты с сопутствующими ССЗ демонстрируют значительно более высокие значения лабораторных маркеров даже при неосложненном течении COVID-19. В многофакторном анализе повышенные уровни тропонина (OШ 1,54; 95% ДИ: 1,22–1,96; p <0,001), интерлейкина 6 (OШ 1,69; 95% ДИ: 1,26–2,27; p <0,013) и CPБ (OШ 1,32; 95% ДИ: 1,1–1,58; p <0,003) служили предикторами смертности у пациентов с COVID-19 [35].
В исследование Calvo-Fernаndez A. et al. вошли 872 пациента с подтвержденным COVID-19. При поступлении 651 пациентам определяли уровень hs-cTnT и 506 – концентрацию NT-proBNP. Повреждение сердца определялось при значении hs-cTnT >14 нг/л, верхний 99-й процентиль. Также считалось, что уровни NT-proBNP >300 пг/мл связаны с повреждением миокарда. Первичной комбинированной конечной точкой служила 30-дневная смертность или необходимость проведения ИВЛ. Повреждение сердца, оцененное по уровню hs-cTnT, наблюдалось у 34,6% пациентов с COVID-19. Смертность или необходимость ИВЛ были выше у больных с повреждением миокарда по сравнению с больными без повреждения миокарда (39,1 против 9,1%). Уровни hs-cTnT и NT-proBNP были независимыми предикторами смерти или необходимости проведения ИВЛ (ОР 2,18; 95% ДИ: 1,23–3,83 и 1,87; 95% ДИ: 1,05–3,36 соответственно) и изолированно смерти (ОР 2,91; 95% ДИ: 1,211–7,04 и 5,47; 95% ДИ: 2,10–14,26) [36].
Gullu U. et al. обследовали 320 детей в возрасте от 0 до 18 лет (средний возраст 10,46±5,77 лет) с COVID-19. Всем пациентам определяли уровни cTnI. Значение cTnI ≥0,03 мг/л прогнозировало развитие синдрома мультисистемного воспаления с чувствительностью 60% и специфичностью 99,2% (площадь под кривой ошибок (AUC) 0,794: 0,524–1,0) [37]. Аналогичные данные получены и в европейском многоцентровом исследовании, проведенном Valverde I. et al. [38].
Majure D. et al. проанализировали данные 11 159 пациентов, госпитализированных с COVID-19; 6247 из них определяли тропонины в течение 48 ч: cTnI с верхним референсным пределом 99-го процентиля (верхней границей нормы, ВГН) 0,045 нг/мл; сердечный тропонин I с ВГН 0,056 нг/мл; cTnТ с ВГН 0,01 нг/мл и hs-cTnT с ВГН 19 нг/л. Для сравнения сгруппированных анализов тропонина были нормализованы значения до 99-го перцентиля (ВГН) каждого отдельного анализа и представлены результаты в виде соотношений. Далее классифицировали соотношение тропонинов как нормальное (≤1 × ВГН), умеренно повышенное (от> 1 до ≤3 × ВГН) и сильно повышенное (> 3 × ВГН). Авторы констатировали, что лица с повышенным уровнем тропонинов имели достоверно более высокий риск смертности, и этот риск не зависел от сопутствующих ССЗ [39].
Ozyılmaz S. et al. были ретроспективно рассмотрены и проанализированы медицинские карты 105 пациентов с COVID-19. Авторы заключили, что у пациентов с диагнозом COVID-19 повышенный уровень тропонина I >7,8 пг/мл можно рассматривать как независимый фактор риска смертности [40].
Целью исследования Peiro O. et al. был анализ прогностической ценности различных биомаркеров у пациентов с COVID-19. Всем участникам определяли уровни cTnI, D-димера, CРБ и лактатдегидрогеназы (ЛДГ). Было показано, что cTnI ≥21 нг/л, D-димер ≥1112 нг/мл, CPБ ≥10 мг/дл и ЛДГ ≥334 Ед/л при поступлении были связаны с повышенным риском смерти в течение 30 дней (ОР 4,30; 95% ДИ: 1,74–10,58; p=0,002; ОР 3,35; 95% ДИ: 1,58–7,13; p=0,002; ОР 2,25; 95% ДИ: 1,13–4,50; p=0,021; ОР 2,00; 95% ДИ: 1,04–3,84; p=0,039 соответственно). AUC cTnI составляла 0,825 (95% ДИ: 0,759–0,892), CРБ (0,685; 95% ДИ: 0,600–0,770; p=0,009), ЛДГ (0,643; 95% ДИ: 0,534–0,753; p=0,006), D-димер (0,756; 95% ДИ: 0,674–0,837; p=0,115). Авторы резюмировали, что у пациентов с COVID-19 повышенные концентрации D-димера, CPБ, ЛДГ и особенно cTnI связаны с краткосрочной смертностью [41].
В итальянское ретроспективное одноцентровое исследование включило 189 пациентов с COVID- 19, которым в течение первых 24 ч после поступления в стационар определили уровень hs-cTnI. Авторы пришли к выводу, что оценку этого маркера можно позиционировать как лабораторный инструмент прогнозирования тяжести заболевания, потребности в ИВЛ и больничной летальности [42].
Ruge M. et al. представили данные ретроспективного исследования, охватившего 772 пациентов с COVID-19. 69 (8,9%) из них имели умеренное повышение cTn (от> 1 до <2 × ВГН), а у 46 (6,0%) отмечено значительное повышение cTn (≥2 × ВГН). Независимо от исходных данных, наличия сопутствующих заболеваний и исходных концентраций CРБ, ЛДГ и ферритина, повышение cTn было предиктором тяжелого течения COVID-19: для умеренного повышения – скорректированное OШ 3,00; ДИ: 1,51–6,29, p <0,01; для значительного повышения – скорректированное OШ 9,96; ДИ: 2,75–64,23; p <0,01. Значимое повышение cTn также явилось предиктором госпитальной летальности (скорректированное OШ 2,42; ДИ: 1,10–5,21; p <0,05) и 60-дневной смертности (скорректированное OШ 2,45; ДИ: 1,13–5,25; p <0,05) [43].
Проспективное одноцентровое когортное исследование Zwaenepoel B. et al. было направлено на оценку сердечных биомаркеров у 100 больных COVID-19, находящихся в критическом состоянии (средний возраст 63,5 года, 66% мужчин). Лабораторная диагностика включала анализ hs-cTnT и NT-proBNP при поступлении в отделение интенсивной терапии (уровни hs-cTnT ≥14 пг/ мл и NT-proBNP ≥ 450 пг/мл считались повышенными). На момент поступления в отделение интенсивной терапии 47% пациентов имели повышенный уровень hs-cTnT и 39% – NT-proBNP; фракция выброса левого желудочка (ФВ ЛЖ) была ниже 50% у 19,1% пациентов. Повышенные сердечные биомаркеры (значение p hs-cTnT <0,001, значение p NT-proBNP = 0,001) и ФВ ЛЖ (значение p=0,011) были значимо связаны со смертностью, в то время как другие биомаркеры (D-димер, ферритин, CPБ) и показатели динамической оценки органной недостаточности по шкале SOFA (Sequential Organ Failure Assessment) существенно не различались у выживших и умерших лиц. Оптимальное пороговое значение для прогнозирования повышенного риска 30-дневной смертности от всех причин составляло 16,5 пг/ мл для hs-cTnT (OШ 8,5; 95% ДИ: 2,9–25,0) и 415,5 пг/ мл для NT-proBNP (OШ 5,1; 95% ДИ: 1,8–14,7) [44].
Manocha K. et al. выполнили наблюдательное когортное исследование, включившее 1053 пациентов с COVID-19 (средний возраст 65,0±15,2 лет, 65,3% мужчин). Всем пациентам определяли следующие биомаркеры – cTnI, натрийуретический пептид B-типа (BNP), CRP, ферритин и D-димер (n=446). Первичной конечной точкой служила 30-дневная госпитальная летальность. Для построения оценки риска смертности использовалась многовариантная логистическая регрессия. Проверка оценки риска осуществлялась с использованием независимой когорты пациентов (n=440). Среди протестированных маркеров cTnI (≥0,34 нг/мл) был единственным независимым предиктором 30-дневной смертности (скорректированное OШ 4,38; p <0,001) [45].
По данным ретроспективного когортного исследования, проведенного Ali J. et al. (466 пациентов, 69% мужчин), у большинства больных имели место АГ и СД, у одной трети при поступлении в стационар отмечено повышение уровня cTnI. Из 466 пациентов 266 были выписаны, 200 выжили. У 168 (36,05%) пациентов зарегистрировано повреждение миокарда, из них 38 (22,61%) выжили, а остальные 130 (77,39%) умерли. Результаты исследования показали, что показатели смертности были выше у лиц с высоким уровнем cTnI (ОР 3,61) при поступлении [46].
ЗАКЛЮЧЕНИЕ
Биологические маркеры острого повреждения миокарда показали свое значение в качестве лабораторного прогностического инструмента у пациентов с COVID-19. Повышенные уровни cTnT и cTnI в сыворотке крови коррелируют с ухудшением состояния и повышенной смертностью у больных как с ССЗ, так и без них. Является ли повреждение миокарда причиной ухудшения COVID-19 или следствием прогрессирования этого заболевания, до конца не понятно; в представленном нами обзоре выделены лишь возможные механизмы.
При анализе доступной на данный момент литературы по COVID-19 становится совершенно очевидной необходимость дальнейших многоцентровых исследований. Кроме того, опубликованные к настоящему времени статьи включают лишь исследования со слишком коротким сроком наблюдения. Следовательно, данные имеют неполные конечные точки, что недостаточно для полноценной интерпретации их результатов. Более того, представленные результаты касаются только пациентов, находившихся в стационаре, вследствие чего необходимы исследования, включающие и амбулаторных больных.



