ВВЕДЕНИЕ
Пандемия COVID-19 послужила ярким примером вызова, с которым столкнулось здравоохранение при обеспечении медицинской помощи пациентам с хроническими неинфекционными заболеваниями. Первоначально представление о болезни формировалось как об инфекционном процессе, сопровождающемся поражением легких с высокой заболеваемостью и смертностью, но на настоящий момент установлено, что при COVID-19 наблюдается нарушение функции и многих других органов [1–3].
Для инфекции, вызываемой SARS-CoV-2, характерен широкий спектр клинических проявлений, свидетельствующий о полиорганном поражении, что подтверждается патологоанатомическими исследованиями [4–6]. Если легкие обычно являются «полем боя», то почки зачастую становятся одним из ключевых органов-мишеней при коронавирусной инфекции [4, 7]. Вовлечение различных органов и степень их поражения можно считать надежными прогностическими факторами неблагоприятных исходов у пациентов с COVID-19 [8]. Почечный тропизм служит потенциальным объяснением частого поражения почек у пациентов с COVID-19, причем даже у пациентов, которые не относятся к критически тяжелым больным [9].
По мере накопления данных стало известно, что вирус SARS-CoV-2 поражает клетки, имеющие рецепторы ангиотензинпревращающего фермента II типа (АПФ2) [10]. Рецептор АПФ2 и ген мембраносвязанной сериновой протеазы 2 (TMPRSS2) экспрессируются на границе клеток проксимальных канальцев, что способствует инфицированию SARS-CoV-2, причем экспрессия рецептора АПФ2 в почках потенциально выше, чем в легких [11].
Проникновение вируса в почки происходит через рецептор АПФ2. Было показано, что коронавирус использует его в качестве рецептора входа в клетку, который идентичен рецептору SARSCoV [12]. Считается, что при связывании вируса и рецептора АПФ2 повышается доступность ангиотензина II для связывания с рецептором ангиотензина II типа 1. Активация ренин-ангиотензин-альдостероновой системы (РААС) приводит к повреждению почек через активацию воспаления и фиброза. Таким образом, РААС выступает важным участником повреждения почек [13].
При проведении исследования биоптата почек пациентов, причиной смерти которых стал COVID-19, в 60% случаев было обнаружено присутствие в них РНК SARS-CoV-2. При остром повреждении почек (ОПП) РНК вируса определялась чаще. Это позволяет говорить о прямой связи между экстрареспираторным, в частности почечным, тропизмом SARS-CoV-2 и тяжестью течения COVID-19. Полагают, что поражение почек при COVID-19 обусловлено нефротропным и цитопатическим воздействием вируса на канальцевый эпителий почек [9].
У пациентов с COVID-19 при развитии ОПП уровень креатинина выше, чем у пациентов с ОПП, не связанным с COVID-19. Эти наблюдения подтверждают идею о том, что у пациентов с COVID-19 развивается более тяжелое поражение почек [14–16].
Данные о частоте поражения почек при COVID-19 довольно противоречивы и менялись в зависимости от региона мира и по мере прогрессирования пандемии. Распространенность ОПП среди госпитализированных пациентов с COVID-19, несмотря на наличие единых критериев KDIGO (Kidney Disease Improving Global Outcomes) 2012 г., значимо варьировали между странами и внутри стран. В публикациях из США частота ОПП по критериям KDIGO 2012 г. составляла более 15%, причем в некоторых сериях случаев эти показатели приближались к 60% среди госпитализированных пациентов [17, 18]. При обследовании 5449 госпитализированных пациентов в Нью-Йорке у 36,6% госпитализированных развилось ОПП [19]. Фактором риска развития ОПП является хроническая болезнь почек (ХБП). У пациентов с ХБП, скончавшихся от COVID-19, в 61% случаев развивалось ОПП [20].
Имеются данные о том, что патология почек как установленная ранее, так и развивающаяся de novo, выступает важным фактором риска тяжелого течения COVID-19 и сопряжена с высокой летальностью [21, 22]. По данным, опубликованным в Италии (2020), установлено, что у пациентов, умерших от COVID-19, ХБП является одной из наиболее частых сопутствующих патологий (23,1%), наряду с такими заболеваниями, как артериальная гипертензия (66%), сахарный диабет 2-го типа (29%), ишемическая болезнь сердца (27,9%) [23].
Henry B.M. и Lippi G., выполнив в 2020 г. анализ 1389 госпитализированных пациентов, выявили статистически значимую связь между ХБП и тяжелым течением COVID-19 с отношением шансов 3,03 [24]. D’Marco L. et al. (2019) также установили, что риск тяжелого течения COVID-19 в 3 раза выше у больных с ХБП [25]. По данным Cheng Y. et al. (2020), у 13% больных с новой коронавирусной инфекций в анамнезе имела место ХБП, а у 40% наблюдались такие признаки поражения почек, как протеинурия (43,9%), гематурия (26,7%), развитие ОПП (5,1%), снижение скорости клубочковой фильтрации (СКФ) менее 60 мл/мин (13,1%). Независимыми факторами риска смерти у пациентов оказались возраст старше 65 лет, мужской пол, наличие сопутствующей патологии (ХБП, хронической обструктивной болезни легких, артериальной гипертензии, сахарного диабета, онкологических заболеваний) [13].
Цель исследования – изучить состояние почечной функции у пациентов при коронавирусной инфекции COVID-19 и ее связь с исходами заболевания.
МАТЕРИАЛ И МЕТОДЫ
В исследование случайным методом были включены 182 пациента, госпитализированных в БУ «Больница скорой медицинской помощи» (г. Чебоксары) в 2021 г. с подтвержденным диагнозом COVID-19, из которых 100 пациентов были выписаны домой, 82 скончались. Диагноз коронавирусной инфекции выставлялся на основании положительного результата лабораторного исследования на наличие РНК коронавируса с применением методов амплификации нуклеиновых кислот и/или антигена SARS-CoV-2 при помощи иммунохроматографического анализа вне зависимости от клинических проявлений [26].
Критериями для госпитализации считались сатурация кислорода в артериальной крови (SpO2) <95%; температура тела ≥38 °С; частота дыхательных движений (ЧДД) >22/мин. [27].
Не включались в исследование пациенты, поступившие на лечение из другого стационара или переведенные в другой стационар, которые не имели данных о содержании креатинина и мочевины в течение года, предшествовавшего заболеванию. Все пациенты при поступлении дали информированное согласие на лечение, обследование и использование данных в научных исследованиях.
При осмотре участникам измеряли SpO2, ЧДД, артериальное давление (АД), частоту сердечных сокращений (ЧСС), проводили компьютерную томографию органов грудной клетки (КТ ОГК), общий анализ крови, общий анализ мочи, коагулограмму, развернутый биохимический анализ крови. Данные лабораторных исследований анализировались на 1, 3, 7, 14-й дни госпитализации и на момент выписки. Рассчитывалась скорость клубочковой фильтрации (СКФ) по формуле CKD-EPI. ОПП и его стадия определялись по критериям KDIGO 2012 г. [28]. Критерии диуреза не учитывались в связи с частым отсутствием соответствующих данных в истории болезни пациентов. Обследование и лечение пациентов осуществлялось в соответствии с актуальными методическими рекомендациями по лечению COVID-19 [26]. Для дифференцировки ОПП и ХБП у пациентов использовались данные креатинина и мочевины в течение предшествующего года.
Статистическая обработка данных выполнялась при помощи программ STATISTICA 10.0, MedCalc 19.0 c расчетом относительного риска летального исхода (ОР) и его 95% доверительного интервала (ДИ). В связи с неправильным распределением данных при описании указывали медиану, нижнюю и верхнюю квартили – Ме {Q1–Q3}. Статистическую значимость различий (р) считали значимой при вероятности ошибки (р) менее 0,05 и определяли с использованием критерия хи-квадрат (рх2) для относительных величин и критерия Манна–Уитни – для количественных данных (рm–u).
РЕЗУЛЬТАТЫ
На момент госпитализации после изучения данных анамнеза ОПП было выявлено у 32 человек (17,6%), в том числе у 17 человек – ОПП 1-й стадии (ОПП-1), у 9 – ОПП-2, у 6 – ОПП-3.
Доля пациентов с ОПП была выше среди лиц пожилого и старческого возраста по сравнению с лицами молодого и среднего возраста (20,5 и 28% против 7,7 и 2,2%; p <0,05 во всех случаях). У больных с ХБП ОПП развивалось чаще, чем у лиц без этого заболевания – 25 случаев против 9,3% (рх2=0,005).
В группе больных с ОПП, по сравнению с пациентами без ОПП, были выше показатели ЧДД (23 {20–24} против 19,5 {18–22}; р <0,001), частоты нарушения сознания (43,8 против 17,3%; p=0,001), ниже SpO2 (93,5 {92–94,5} против 95 {94–97}%; p <0,001), выше баллы по шкале NEWS 2 (7 {5–9,5} против 3 {1–6} баллов; p <0,001).
Доля пациентов с ОПП, имеющих значительное повреждение легких (более 50% поражения по КТ ОГК), оказалась выше, чем в группе без ОПП (37,5 против 15,3%; p=0,004). Также при ОПП была выше доля пациентов, находящихся на кислородотерапии (84,4 против 58%; p=0,005), им чаще требовалась искусственная вентиляция легких (87,5 против 31,5%; p <0,001).
Летальность от новой коронавирусной инфекции у лиц без ОПП составила 35,3%, тогда как у пациентов с ОПП – 90,6% (ОР 2,57; ДИ: 2,18–3,02), причем в подгруппе с ОПП-1 этот показатель составил 82,4%, а с ОПП-2 и ОПП-3 – 100%. Ни у одного из пациентов развитие ОПП не было непосредственной причиной смертельного исхода; это свидетельствует о том, что ОПП является одним из индикаторов тяжелого течения болезни.
ХБП была зарегистрирована у 96 пациентов из 182 (52,7%), в том числе ХБП 1-й степени (ХБП-1) – у 14, ХБП-2 – у 43, ХБП-3 – у 36, ХБП-4 – у 3 человек. Среди больных с ХБП была выше доля пациентов пожилого и старческого возраста – 78,1 против 57,0% (рх2=0,002). Кроме того, у пациентов с ХБП закономерно чаще встречались такие сопутствующие патологии, как артериальная гипертензия, ишемическая болезнь сердца (ИБС), хроническая сердечная недостаточность, сахарный диабет (табл. 1).

У пациентов с ХБП по сравнению с пациентами без ХБП чаще встречались повышение температуры тела >37 °C (87,2 против 78,1%; p <0,001) и одышка (49 против 35%; p <0,001). Не было выявлено различий в клинических показателях шкалы NEWS 2 при поступлении между пациентами, имеющими и не имеющими ХБП (табл. 2).
По результатам анализа при поступлении в стационар, у пациентов с ХБП в сравнении с больными без этой болезни оказались закономерно хуже показатели почечной функции, также у них сильнее были выражены лимфопения и выше уровень интерлейкина 6 (табл. 3).
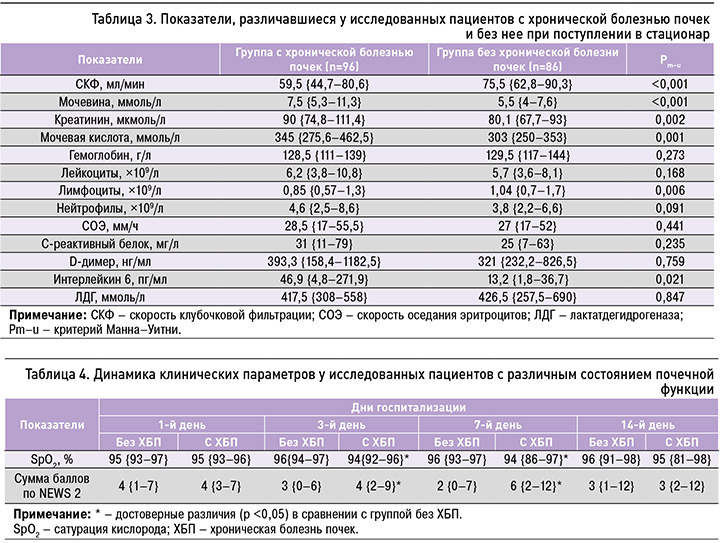
У пациентов с ХБП наблюдались более высокие показатели суммы баллов по шкале NEWS 2 и более низкие показатели сатурации кислорода, начиная с 3-го дня госпитализации (табл. 4).
Также у пациентов с ХБП отмечалась худшая регрессия лимфопении, нейтрофилеза, и уровня С-реактивного белка (табл. 5).
Летальность в группе без ХБП составила 33,7%, с ХБП – 52,7%. В целом для больных с ХБП ОР смерти был равен 1,64 (ДИ: 1,1–2,30; р=0,004). При детализации по стадиям ХБП летальность составила при ХБП-1 – 28,6%, ХБП-2 – 51,2%, ХБП-3 – 75% (р <0,001). Среди пациентов с ХБП-4 (n=3) умерших не было, больные с этой стадией заболевания имели низкий риск смерти по шкале NEWS 2.

Также нами была выполнена оценка влияния сопутствующей патологии на исходы с помощью индекса коморбидности (ИК) Чарлсона, который учитывает наличие сопутствующих заболеваний и возраст. Для его расчета производилось суммирование баллов, соответствующих определенным сопутствующим заболеваниям: если возраст пациента превышает 40 лет, то на каждую декаду жизни также добавляется по одному баллу [29]. Наряду с этим проводилась оценка модифицированного ИК Чарлсона. При его расчете в случае наличия у пациента ОПП и/или СКФ менее 60 мл/мин к итоговой сумме добавлялись 2 балла [30, 31] (табл. 6). При оценке суммы баллов модифицированный ИК Чарлсона у пациентов с ХБП был выше, чем у лиц без ХБП – 7 {5–9} против 4 {2–6} баллов (p <0,001). Показатели оригинального ИК Чарлсона в группе ХБП оказались также оказались выше – 6,5 {4–7} против 4 {2–6} баллов у больных без ХБП (p <0,001).
Количество баллов по шкале NEWS 2 при поступлении было ожидаемо выше у пациентов с высоким уровнем коморбидности, как в группе с ХБП, так и без нее. При сопоставимом ИК различий между пациентами с ХБП и без ХБП по этому параметру выявлено не было (табл. 7).
При оценке летальности у пациентов с высокой коморбидностью по оригинальному ИК Чарлсона она составила 75% в группе без ХБП и 73,2% – с ХБП (ОР 0,967; ДИ: 0,48–1,97; p=0,861), а в группе с низкой коморбидностью – 13,8 и 30% соотвтетственно (ОР 2,175; ДИ: 1,24–3,81; p=0,050; табл. 8).

При высокой коморбидности по модифицированному ИК Чарлсона летальность у пациентов без ХБП составила 75,9%, с ХБП – 73,0% (ОР 0,962; ДИ: 0,47–1,96; p=0,773); при низкой коморбидности соответствующие показатели равнялись 21,2 против 12,3% (ОР 1,727; ДИ: 0,99–2,99; p=0,260).
ОБСУЖДЕНИЕ
Таким образом, в ходе проведенного анализа выявлено, что распространенность ХБП среди госпитализированных пациентов с COVID-19 составила 52,7%, что превышает распространенность ХБП в российской популяции в целом (13,4%) [32]. ОПП при этом развилось у 17,6% исследованных пациентов.
Среди пациентов с ХБП и СOVID-19 чаще встречались больные с сопутствующими патологиями, такими как артериальная гипертензия, ИБС, хроническая сердечная недостаточность, сахарный диабет, также среди них была выше доля пациентов пожилого и старческого возраста (см. табл. 1), что согласуется с данными российского «Анализа динамики коморбидных заболеваний у пациентов, перенесших инфицирование SARS-CoV-2» (регистр АКТИВ, n=9364) [33].
У пациентов с ХБП были выше уровни интерлейкина 6 и С-реактивного белка, ниже уровень лимфоцитов. При анализе динамики клинических данных было установлено, что с 3-го дня заболевания у пациентов с ХБП регистрировались достоверно худшие клинические показатели.
Летальность в группе без ХБП составила 33,7%. Для больных с ХБП ОР смерти в целом составил 1,64 (ДИ: 1,17–2,30; р=0,004). При этом не было отмечено повышения летальности для пациентов с ХБП-1. ОПП развивалось у лиц с ХБП в 25% случаев против 9,3% у лиц без ХБП (рх2=0,005). Летальность от новой коронавирусной инфекции у лиц без ОПП составила 35,3%, у пациентов с ОПП – 90,6% (ОР 2,57; ДИ: 2,18–3,02). Представленные данные также согласуются с данными отечественных исследователей [33].
У пациентов с ХБП и COVID-19 оказалась выше сумма баллов как оригинального, так и модифицированного ИК Чарлсона (при наличии ХБП, начиная с 3-й стадии, наличии ОПП) по сравнению с пациентами без ХБП. Высокая коморбидность (ИК Чарлсона более 5 баллов) чаще наблюдалась у пациентов с ХБП, чем у пациентов без ХБП.
ИК, безусловно, обуславливает тяжесть состояния пациентов при COVID-19. Баллы шкалы NEWS были достоверно выше при высоком ИК независимо от наличия или отсутствия ХБП.
Летальность при COVID-19 напрямую связана с высокой коморбидностью пациентов; в нашем исследовании при высоком ИК она оказалась очень высока – 73,2% у больных с ХБП и 75% без нее. При этом оценка ИК не отменяет необходимости учета ХБП. Так, при низкой коморбидности летальность у больных с ХБП равнялась 30 против 13,8% у пациентов без ХБП (р=0,050). Добавим также, что использование модифицированного ИК существенно не меняет потребность в учете ХБП. Часть пациентов при применении модифицированного ИК в нашем исследовании перешла в более тяжелую категорию, при этом в оставшейся подгруппе больных с низким ИК летальность снизилась, составив 21,2% у пациентов с ХБП и 12,3% без ХБП (рх2=0,260).
В целом надо отметить, что ХБП при новой коронавирусной инфекции сочетается с другими факторами риска летального исхода (как правило, сопряженными со старением), служит отражением тяжелого соматического статуса больного и требует особого внимания со стороны врача. В свою очередь, развивающееся ОПП при COVID-19 не является непосредственной причиной смерти, но отражает тяжесть течения инфекции и риск летального исхода.
ЗАКЛЮЧЕНИЕ
Будучи респираторным заболеванием, COVID-19 может иметь и внелегочное течение, в частности вызывать или усугублять патологию почек. Нарушение функции почек рассматривается как следствие целого ряда механизмов, которые напрямую или косвенно индуцированы вирусом SARS-CoV-2. Выявлено, что среди пациентов с ХБП и ОПП при COVID-19 выше доля лиц пожилого и старческого возраста; в сочетании с сопутствующими патологиями при ХБП (артериальной гипертензией, ИБС, хронической сердечной недостаточностью, сахарным диабетом) это может быть предиктором неблагоприятных исходов.
Лица с ХБП и COVID-19 имеют более выраженные изменения лабораторных параметров, в том числе и отражающих почечную функцию и худшую динамику клинических показателей. Дальнейшее изучение факторов риска неблагоприятного исхода позволит эффективно влиять на состояние пациентов с нарушением функции почек и COVID-19.



