На XXIII ежегодном научном конгрессе Американской ассоциации эндокринологов (2014) было предложено рассматривать ожирение как «хроническое заболевание, обусловленное избыточным накоплением жировой ткани» («adiposity based chronic disease») [1]. Примерно с 70–80 гг. XX в. прогрессивное увеличение числа людей с избыточной массой тела и ожирением среди населения экономически развитых стран выдвинуло эту проблему в разряд социально значимых. В XXI в. тенденция перехода от нормальной массы тела к избыточной и ожирению наблюдается уже в странах с низким и средним уровнем дохода, что позволило Всемирной организации здравоохранения (ВОЗ) признать ожирение «неинфекционной эпидемией». Совсем недавно в научной литературе появился термин globesity (Global + obesity), подчеркивающий общемировую значимость проблемы [2]. Так, по данным ВОЗ, в 2016 г. более 1,9 млрд взрослых старше 18 лет имели избыточный вес, из них свыше 650 млн страдали ожирением. При этом в ближайшем десятилетии прогнозируется увеличение распространенности этого заболевания еще на 40% [3].
В целом в мире число людей с ожирением превышает количество людей с пониженной массой тела: такая картина наблюдается во всех регионах, кроме некоторых районов Африки к югу от Сахары и Азии. Ранее наибольшая распространенность ожирения наблюдалась в США, в настоящее же время лидирующие позиции занимают островные государства (Гаити, Тонга), Объединенные Арабские Эмираты, Мексика. Россия занимает 19-е место по распространенности ожирения и 4-е место по числу больных с этим диагнозом [4]: избыточный вес в нашей стране имеется у 60% женщин и 50% мужчин старше 30 лет, при этом 22% россиян страдают ожирением.
Патологическое увеличение объема жировой ткани в организме выходит далеко за рамки сугубо эстетической проблемы и служит причиной развития целого ряда тяжелых, инвалидизирующих и приводящих к смерти заболеваний [5, 6]. Особую опасность в плане органного поражения представляет тяжелое, так называемое морбидное ожирение, которое диагностируется при индексе массы тела (ИМТ) ≥40 кг/м2 или же при ИМТ ≥35 кг/м2 с наличием серьезных осложнений, обусловленных ожирением.
Поражение почек – одно из прогностически неблагоприятных системных проявлений ожирения. Это обусловлено прогрессирующим течением ассоциированной с ожирением хронической болезни почек (ХБП) с развитием терминальной почечной недостаточности и тесно связанным с ХБП возрастанием сердечно-сосудистых осложнений [6].
ВАРИАНТЫ ПОРАЖЕНИЯ ПОЧЕК ПРИ ОЖИРЕНИИ
При ожирении наблюдаются разнообразные варианты поражения почек (рис.). Ожирению сопутствуют артериальная гипертония (АГ) и целый ряд метаболических нарушений, таких как инсулинорезистентность (ИР), дислипидемия, гиперурикемия, метаболический синдром (МС), сахарный диабет (СД): все они выступают факторами риска развития хронической болезни почек (ХБП). Поражение почек при ожирении может быть результатом коморбидных состояний, обусловленных вышеназванными метаболическими и гемодинамическими нарушениями, с развитием диабетической, гипертонической, ишемической, подагрической нефропатий [6].
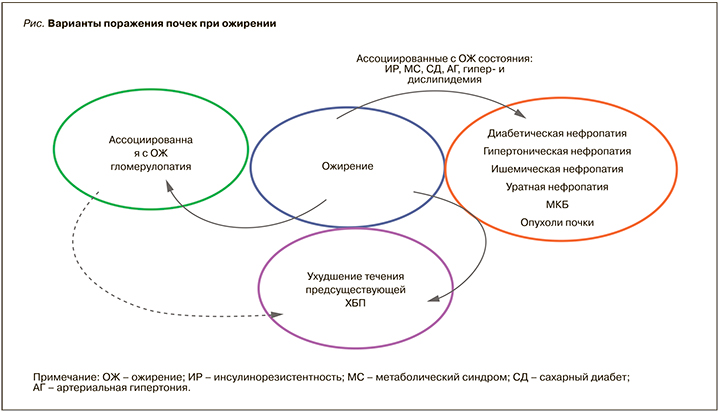
Помимо этого, возможно развитие специфического поражения почек – так называемой ассоциированной с ожирением гломерулопатии (ОЖ–ГП), которая характеризуется развитием протеинурии у больных с ИМТ >30 кг/м2 в отсутствие каких-либо других причин поражения почек [7, 8, 9].
Ожирение ассоциировано с рядом факторов риска, вносящих вклад в более высокую заболеваемость и распространенность нефролитиаза, рака почки [6].
Патологические изменения почек при ожирении также включают эктопическое отложение жира [7, 10].
Клиническая картина поражения почек при ожирении характеризуется медленным и постепенным развитием альбуминурии, невысокой протеинурией; примерно у 1/3 больных с ожирением (как правило, при ОЖ–ГП) развивается массивная протеинурия, но без формирования нефротического синдрома. В течение болезни постепенно формируется дисфункция почек, более быстро при коморбидных состояниях (СД, сердечно-сосудистая патология) [6]. При собственно ОЖ–ГП снижение скорости клубочковой фильтрации (СКФ) развивается медленно (ХБП 4–5 стадии наблюдается через 20–30 лет течения болезни).
МЕХАНИЗМЫ ПОРАЖЕНИЯ ПОЧЕК ПРИ ОЖИРЕНИИ
Поражение почек при ожирении – сложный многофакторный процесс. Сам факт, что не у всех лиц с ожирением развивается ХБП (до 25% лиц с ожирением считаются «метаболически здоровыми»), свидетельствует о том, что как таковое увеличение массы тела недостаточно для индукции повреждения почек [6].
Гемодинамические нарушения
Существенное значение в поражении почек при ожирении имеют гемодинамические нарушения, а именно развитие внутриклубочковой гипертензии, проявлением которой на ранних стадиях выступает гиперфильтрация [7, 8, 12, 13]. Основная роль в этом процессе принадлежит дисбалансу тонуса приносящей (афферентной) и выносящей (эфферентная) артериол клубочка. В норме диаметр приносящей артериолы приблизительно в 2 раза больше, чем выносящей, за счет чего и создается градиент внутриклубочкого давления, обеспечивающего процесс ультрафильтрации.
Основным пусковым механизмом дилатации афферентных артериол при ожирении служит деактивация обратной тубулогломерулярной связи. Так, увеличение проксимальной канальцевой реабсорбции натрия вследствие активации ренин-ангиотензин-альдостероной системы (РААС), симпатической нервной системы, гиперинсулинемии и снижение вследствие этого поставки натрия к хемосенсорам в macula densa приводят к уменьшению тонуса приносящей артериолы и ее расширению. В то же время выносящая артериола сужается вследствие воздействия различных вазоконстрикторов, прежде всего активированной РААС. Дилатация афферентных и констрикция эфферентных артериол приводят к повышению величины фильтрационной фракции и внутриклубочкового транскапиллярного гидравлического давления, что проявляется гиперфильтрацией. Усилению внутриклубочковой гипертензии способствуют сопутствующая ожирению системная АГ, поддерживаемая задержкой натрия и гиперсимпатикотонией, а также свойственная ожирению диета с высоким потреблением белка и соли [6, 14]. Повышение постгломерулярного онкотического давления вследствие увеличения фильтрационной фракции усиливает канальцевый ток ультрафильтрата и активирует механосенсоры эпителиальных клеток, что, в свою очередь, способствует активной канальцевой реабсорбции натрия, участвующей в поддержании внутриклубочковой гипертензии.
Увеличение потока фильтрата в отдельных нефронах приводит к растяжению стенки клубочковых капилляров, развитию shear-стресса эндотелиоцитов, растяжению гломерулярной базальной мембраны и механическому воздействию на подоциты, что лежит в основе развития альбуминурии/протеинурии [7, 15, 16]
Механотрансдукция повышенного внутриклубочкового давления на подоциты через экспрессию в них ангиотензина II, рецептора ангиотензина II 1 типа, трансформирующего фактора роста β и его рецепторов, инициируют ранний компенсаторный ответ – гипертрофию, которая в силу своей неадекватности и активации механизмов апотоза способствует слущиванию подоцитов в мочевое пространство с развитием альбуминурии и протеинурии. При значительном же слущивании подоцитов характерно образование очагового, а потом и глобального гломерулосклероза [15, 16].
Основную роль в формировании и поддержании системной АГ при ожирении отводят ретенции натрия и воды в условиях гиперинсулинемии. Инсулино-обусловленная стимуляция β1-адренорецепторов сопровождается увеличением внутриклеточного циклического аденозинмонофосфата, что запускает синтез и выделение ренина в юкстагломерулярных клетках почек. Повышение концентрации последнего ведет к активации всей цепочки ренин-ангиотензиновой системы с увеличением уровня ангиотензина II (АТII), последующим выделением альдостерона корковым слоем надпочечников и задержкой натрия и воды в почках [7, 13]. В результате наблюдаются возрастание объема циркулирующей крови, увеличение сердечного выброса и общего периферического сопротивления сосудов, что способствует развитию АГ.
Относительная олигонефрония
Ожирение ведет к формированию относительного дефицита нефронов по отношению к объему выполняемой почками работы по депурации и поддержанию гомеостата. У человека с ожирением, имеющего исходно нормальное число нефронов, постепенно развивается снижение доли массы почек по сравнению с общей массой тела – состояние относительной олигонефронии (относительного дефицита массы нефронов). При ожирении общая площадь фильтрационной поверхности обычного числа нефронов не способна длительно выдерживать на адекватном уровне нагрузку избытком метаболитов. В таких условиях действие гормонов и факторов роста, продуцируемых жировой тканью, направлено на формирование гипертрофии клубочков и гиперплазии всех клеток нефронов: мезангиальных, эндотелиальных, подоцитарных, что ведет к увеличению коэффициента ультрафильтрации и, как следствие, общей почечной фильтрации на поверхность тела [7, 8, 13]. По-видимому, первоначально данный механизм носит компенсаторный характер для адекватного обеспечения депурационной функции почек. Для его поддержания также происходит подключение почечного резерва за счет функционально мало активных нефронов.
Прямая липотоксичность
Выделяют целый ряд механизмов, связанных с непосредственным влиянием жировой ткани на почки [6, 7, 9, 13, 17]. В настоящее время доказано, что жировая ткань, помимо выполнения таких функций, как накопление энергии, термоизоляция и механическая защита, служит мощным гормональным органом, продуцирующим адипоцитокины – гормоны с локальным (аутокринным) и системным (эндокринным) эффектами. Адипоцитокины принимают участие в неоваскуляризации и формировании новых адипоцитов из перицитов микроциркуляторного русла, перестройке стромы, в результате их действия запускается целый ряд процессов, включая воспаление, оксидативный стресс, нарушение метаболизма липидов, активацию РААС, увеличение продукции инсулина и формирование инсулинорезистентности [6, 7, 9, 13, 17].
Жировая ткань содержит разные типы клеток, включая преадипоциты, адипоциты и стромальные васкулярные клетки. При ожирении на фоне увеличения объемов жировой ткани происходит рост количества кровеносных сосудов, фибробластов, развивается дефицит преадипоцитов, отмечается инфильтрация жировой ткани на ранних этапах нейтрофилами и Т-лимфоцитами, на поздних – макрофагами. Субклиническое хроническое воспаление в жировой ткани, индуцированное адипоцитами, расценивается как одно из патогенетических звеньев развития и хронизации ожирения. Макрофаги способствуют гипертрофии адипоцитов, которые усиленно секретируют хемокины и их рецепторы, стимулируя приток новых клеток воспаления, что вызывает дальнейшую гипертрофию адипоцитов, сохранение и усиление воспалительной реакции [9, 17–19].
Перечень известных адипоцитокинов продолжает пополняться: лептин, адипонектин, фактор некроза опухоли альфа, интерлейкин-6, резистин, висфатин, оментин, васпин, ингибитор активатора плазминогена 1 типа, моноцитарный хемотаксический протеин 1, трансформирующий фактор роста β1. Адипоциты продуцируют компоненты РААС (АТII, альдостерон), факторы ангиогенеза (ангиопоэтины и эндотелиальный сосудистый фактор роста), факторы, влияющие на тонус сосудов (NO, простагландин Е2, асимметричный D-метиларгинин) и др. [7, 17–20].
Сегодня адипоцитокинам посвящено много обзоров, остановимся лишь на наиболее важных и изученных.
Рецепторы лептина активно экспрессируются в клубочках почек. Высокая концентрация лептина в крови оказывает прямое воздействие на эндотелий петель клубочка, вызывая его дисфункцию, активирует экспрессию трансформирующего фактора роста бета (TGF-β), стимулирующего образование коллагена I и IV типа, как в эндотелиальных и мезангиальных клетках, активирует апоптоз эпителиальтных клеток. Кроме того, он стимулирует симпатическую нервную систему, активирует РААС, способствует задержке натрия, индуцирует перекисное окисление липидов. Все эти факторы, воздействуя одновременно, напрямую приводят к повреждению почек – развитию протеинурии и снижению СКФ [5, 7, 9, 19–21].
Адипонектин – цитокин, обладающий, в отличие от лептина, протективными (противовоспалительными, антиатерогенными) свойствами, а также способностью снижать инсулинорезистентность, предотвращать окислительный стресс, апоптоз, оказывает протективное действие на подоциты, канальцевые эпителиоциты (опосредованно через снижение активности внутрипочечной РААС, уменьшение проявлений оксидативного стресса). При ожирении продукция адипонектина снижается, активность РААС возрастает, что сопряжено с патологическими воздействиями как на внутрипочечную гемодинамику, так и на функцию подоцитов, почечных канальцев, способствующими развитию протеинурии и почечной дисфункции [7, 18, 20–22].
Вследствие дополнительной продукции жировой тканью компонентов РААС (АТII, альдостерон) возможно усиление системной и внутриклубочковой АГ, воспалительных и пролиферативных процессов, усугубление инсулинорезистентности, активация продукции лепина [7, 12, 17, 23].
Существенную роль в поражении почек при ожирении играет эктопическое отложение жира, т.е. скопление липидных гранул вне жировой ткани с формированием так называемой жировой почки [7, 10, 12]. Липидные включения выявляют в цитоплазме мезангиальных клеток, подоцитах и эпителиальных клетках почечных канальцев вокруг сосудов почек. Включение липидов в мезангиальные клетки вызывает снижение их контрактильности, нарушение формы капиллярных петель, способствует гломеруломегалии и гиперфильтрации [10]. Внедрение липидных гранул в подоциты стимулирует развитие их инсулинорезистентности, гипертрофии, активирует процессы апоптоза с постепенным слущиванием подоцитов с базальной мембраны, что ведет к развитию протеинурии и гломерулосклероза. Отложение липидов в почечных канальцах также способствует развитию их инсулинорезистентности, тубулярной атрофии и тубулоинтерстициального фиброза [7, 10]. Периваскулярные отложения липидов могут проявлять механический эффект (сдавление вен и лимфатических сосудов), поддерживающий развитие гиперфильтрации [10]. Было показано, что жировые накопления в синусе почек самостоятельно влияют на развитие альбуминурии, выраженность накопления жира в синусе прямо коррелирует с показателем альбуминурии [24].
Инсулинорезистентность и гиперинсулинемия
В настоящее время основную роль в развитии ожирении отводят инсулинорезистентности и гипергиперинсулинемии, оказывающим системное воздействие на органы. В частности, они активируют симпатическую нервную систему и РААС, способствуют задержке натрия, вызывают повышение чувствительности сосудистой стенки к действию вазоконстрикторов, усугубляя, таким образом, развившиеся гемодинамические нарушения. Гиперинсулинемия повышает биологическую активность факторов роста фибробластов, способствуя развитию фиброза сосудов [7, 10]
Характерные для ОЖ инсулинорезистентность, низкие значения рН мочи и повышенная экскреция с мочой оксалатов, уратов повышают риск камнеобразования [6, 25, 26].
Инсулинорезистентность, гиперинсулинемия, увеличение продукции инсулиноподобного фактора роста увеличивают риск образования рака почки [6, 27].
АССОЦИИРОВАННАЯ С ОЖИРЕНИЕМ ГЛОМЕРУЛОПАТИЯ
Параллельно с мировой эпидемией ожирения увеличивается и заболеваемость ОЖ–ГП [6, 7]. Этот вариант поражения почек у больных ожирением клинически протекает без АГ и метаболических нарушений, наиболее часто (у 50–90%) проявляется субнефротической протеинурией. Нефротический синдром (НС) при этом развивается редко (только у 5%) даже на фоне массивной протеинурии. Для ОЖ–ГП типично медленное прогрессирование дисфункции почек; 5-летняя почечная выживаемость составляет 75%, 10-летняя – 50% [5, 7, 8, 12].
При морфологическом исследовании почечной ткани у больных ОЖ–ГП выявляют компенсаторную гипертрофию клубочков и канальцев почек [5, 7, 28] (диаметр клубочка >250 микрон в 1,5 раза больше, чем у здоровых и при первичном фокально-сегментарном гломерулосклерозе) и низкую плотность клубочков (олигонефрония). Пролиферация мезангиальных клеток не выражена. Отмечают фокально-сегментарный гломерулосклероз (ФСГС), перихиллярный вариант, расположенный в области ворот (hilus) клубочка [9, 28]. Фокусы склероза обнаруживают примерно в 6–12% клубочков. Распластывание ножек подоцитов наблюдается на <50% поверхности гломерул (меньше, чем при первичной ФСГС). В склерозированных сегментах при иммунофлюоресцентном исследовании ткани почки, как правило, отсутствует свечение иммуноглобулинов и комплемента [9, 28].
К основным реакциям почек на ожирение при ОЖ–ПГ относятся увеличение СКФ, почечного плазмотока, фильтрационной фракции и канальцевой реабсорбции натрия. Адипоцитокины и эктопическое накопление липидов в почках способствуют дезадаптивности реакции почечных клеток на механические силы гиперфильтрации, приводя к истощению подоцитов, развитию протеинурии, ФСГС и интерстициальному фиброзу [6, 7].
Причинами развития гиперфильтрации при ОЖ–ПГ являются относительная олигонефрония (несоответствие массы почки и массы тела больного с ожирением), гиперактивация РААС и симпатоадреналовой системы, повышенная продукция адипокинов, системная АГ, гиперинсулинемия, повышенное потребление белка [5, 7, 8, 12].
Лабораторно гиперфильтрация проявляется при сохранной функции почек следующими признаками:
- высокими значениями СКФ (>150 мл/мин);
- величиной фильтрационной фракции >22% (отношение величины клубочковой фильтрации к почечному плазмотоку в процентах по данным изотопной реносцинтиграфии);
- отсутствием почечного функционального резерва, выявленного с помощью пероральной нагрузкой мясным белком или инфузии аминокислот (снижение СКФ или ее повышение менее чем на 10% от исходного уровня).
Морфологическими признаками гиперфильтрации служат гипертрофия (компенсаторная) клубочков и канальцев почек.
ЗАКЛЮЧЕНИЕ
Ожирение и избыточная масса тела признаны неинфекционными эпидемиями XXI в. Имеется ассоциация между показателями ожирения и развитием поражения почек.
Патогенез поражения почек многофакторный. Выделяют прямые, непосредственно связанные с ожирением факторы, определяющие развитие специфической, ассоциированной с ожирением гломерулопатии, а также целый ряд сопутствующих ожирению состояний (ИР, МС, СД, дислипидемия, гиперурикемия, АГ), выступающие факторами риска развития ХБП.
Ассоциированная с ожирением гломерулопатия имеет ряд особенностей. Клинически она характеризуется медленным и постепенным развитием альбуминурии, протеинурии субнефротического уровня и медленно прогрессирующей дисфункции почек у больных с ИМТ >30 кг/м2 (в отсутствие каких-либо других причин поражения почек, в первую очередь СД, АГ). Морфологическая картина представлена низкой плотностью клубочков в почке, их большими размерами, развитием перихилярного фокально-сегментарного гломерулосклероза без свечения иммунных комплексов, повреждением подоцитов с распластыванием их ножек на небольшой (<50%) поверхности гломерул.
Ведущим патофизиологическим механизмом поражения почек при ожирении является нарушение внутрипочечной гемодинамики с развитием гиперфильтрации и ее последствий, обусловленные наличием относительной олигонефронии, активацией ренин-ангиотензин-альдостероновой системы. Важная роль принадлежит непосредственному влиянию жировой ткани на почки, связанному с эндокринной активностью продуцируемых адипоцитами веществ – адипоцитокинами. Адипоцитокины запускают воспаление, оксидативный стресс, апоптоз, активируют РААС. Токсическое действие на почки оказывают и эктопические отложения жира в ткани почек.
Терапевтические вмешательства должны быть направлены на ведущие патогенетические механизмы поражения почек: коррекцию веса, нивелирование неблагоприятных эффектов активированной РААС, воздействие на метаболические нарушения.



