ВВЕДЕНИЕ
Нарушения когнитивных функций представляют значимую проблему современного здравоохранения как вследствие своих социально-экономических последствий, так и продолжающегося роста распространенности. По актуальным оценкам, в мире насчитывается более 55 млн пациентов, страдающих деменцией, а к 2050 г. ожидается увеличение численности лиц, страдающих этой патологией, до 139 млн человек [1]. На долю сосудистых причин деменции приходится не менее 20% и вплоть до 40% всех установленных случаев, при этом все больше данных указывает на то, что среди пожилого населения наиболее часто когнитивные нарушения (КН) обусловлены комбинацией нескольких патологических состояний [2, 3]. Цереброваскулярная патология не только является самой частой после болезни Альцгеймера причиной развития деменции, но и находится в сложной взаимосвязи с нейродегенеративными заболеваниями головного мозга [4]. Так, по данным недавнего клинико-патологического популяционного исследования, в которое вошли 1079 участников, только в 9% случаев болезнь Альцгеймера встречалась изолированно [5].
МЕТАБОЛИЧЕСКИЕ И КОГНИТИВНЫЕ РАССТРОЙСТВА
Метаболические нарушения, такие как сахарный диабет (CД) и ожирение, связаны с повышенным риском развития КН, в первую очередь из-за сосудистой патологии головного мозга [7, 8]. Сосудистая деменция – это клиническая деменция, вызванная повреждением тканей головного мозга под воздействием факторов цереброваскулярных заболеваний. С общим ростом распространенности цереброваскулярных патологий из года в год увеличивается и заболеваемость сосудистыми КН [8].
Метаанализ 122 исследований (n = 9 359 005) показал, что СД обусловливал 1,25–1,91-кратный избыточный риск развития когнитивных расстройств (КН и деменции). У лиц с предиабетом также отмечается более высокий риск деменции [9, 10]. Отдельного внимания заслуживают результаты кросс-секционного исследования КН у больных СД (524 пациента с СД 2-го типа (СД 2), медиана возраста 58 лет). Возраст, образование, окружность талии, избыточный вес, ожирение, эпизод гипогликемии в течение 3 мес. и цереброваскулярные заболевания были факторами, влияющими на возникновение КН у госпитализированной популяции больных с СД 2 [11]. Сочетание повышенных значений индекса массы тела (ИМТ) и окружности талии может выступать предиктором КН у больных СД, усугубляя течение цереброваскулярной патологии. Исходы сосудистых заболеваний головного мозга находятся во взаимосвязи с характеристиками абдоминального ожирения и метаболическими параметрами [12].
Все это позволило предложить концепцию цереброметаболического здоровья, предусматривающую взаимовлияние и взаимоотягощение церебральных процессов при сопутствующей метаболической патологии с увеличением вероятности КН [13]. В настоящее время в рамках концепции цереброметаболического нездоровья и развития КН малоизученной, но представляющей интерес можно назвать ассоциацию ожирения и дистиреоза.
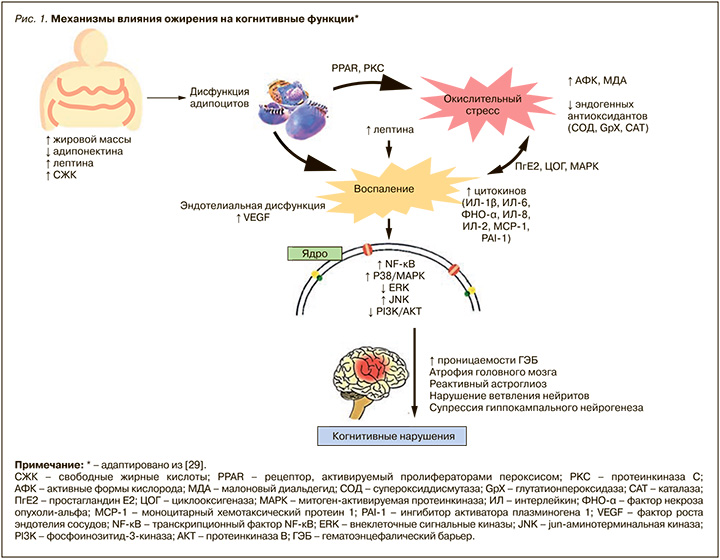
Ожирение – распространенное хроническое состояние, напрямую связанное с КН в зрелом возрасте и повышенной опасностью развития деменции у пожилых в связи с ускоренным старением головного мозга [14–16]. Проведенный в 2021 г. метаанализ, основанный на 21 крупном исследовании с вовлечением более 5 млн человек, подтвердил, что центральное ожирение ассоциировано с метаболической дисфункцией и структурными аномалиями головного мозга – двумя факторами риска КН и деменции [17]. При ожирении отмечено уменьшение общего объема мозга, изменения коннективности белого вещества, при этом височная доля, особенно гиппокамп, обычно более уязвимы, что имеет решающее значение для формирования тормозных реакций, а также эпизодической памяти и пространственного восприятия [18–20]. Ожирение, независимо от другой метаболической дисфункции, на протяжении всей жизни ухудшает когнитивные способности у людей, особенно в доменах внимания, памяти, скорости обработки данных и исполнительных функций [21, 22].
Среди механизмов, лежащих в основе формирования КН, анализ литературных данных позволяет выделить нейровоспаление, нарушение целостности гематоэнцефалического барьера, изменения в активности нейротрофических факторов и нейрогенезе [23]. Индукция слабовыраженного системного воспаления и выработка провоспалительных медиаторов – основные физиологические изменения, наблюдаемые при ожирении; помимо прочего, они связаны с развитием инсулинорезистентности, также ассоциированной с повышенной вероятностью снижения когнитивных способностей и возникновения деменции [24, 25].
Адипоциты активно вырабатывают различные гормоны – цитокины и хемокины, которые участвуют в метаболическом гомеостазе и служат основным источником провоспалительных сигналов при ожирении. Цитокины, вырабатываемые белыми адипоцитами, такие как интерлейкин 6 (ИЛ-6) и фактор некроза опухоли-альфа (ФНО- α), снижают активность местной липопротеинлипазы, уменьшая поглощение свободных жирных кислот адипоцитами. Эти цитокины также неадекватно привлекают мигрирующие провоспалительные макрофаги, которые, в свою очередь, сами выделяют провоспалительные цитокины, повышая резистентность жировой ткани к инсулину, и увеличивают количество циркулирующих провоспалительных маркеров. Таким образом, ожирение связано с усилением системных и центральных провоспалительных сигналов, что способствует нарушению когнитивных функций [26].
Одним из основных хемокинов, секретируемых увеличивающейся белой жировой тканью, является лептин. Сообщается о негативном влиянии на когнитивные функции как слишком низких, так и слишком высоких уровней циркулирующего лептина [27, 28]. Ожирение также сопряжено с повышенной проницаемостью гематоэнцефалического барьера, и эти изменения увеличивают риск возрастного снижения когнитивных способностей и деменции.
Механизмы влияния ожирения на когнитивное здоровье представлены на рисунке 1.
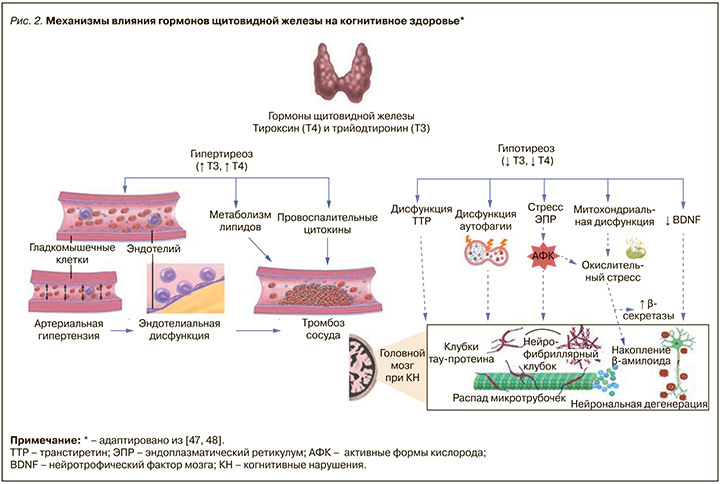
Щитовидная железа (ЩЖ) выделяет тиреоидные гормоны (ТГ), которые участвуют в регуляции обмена веществ, роста и развития, а также оказывают значимое влияние на функции сердечно-сосудистой и нервной систем. Распространенность гипо- и гипертиреоза достигает 30 и 10% соответственно, при этом дисфункция ЩЖ, включая клинический и субклинический гипер- и гипотиреоз, во многих исследованиях ассоциирована с повышенным риском КН [30, 31].
Гипотиреоз значимо увеличивает угрозу развития ишемического инсульта, а низкие значения трийодтиронина связаны с худшими исходами инсульта. Гипертиреоз ассоциирован с более высоким, чем в популяции, риском кардиоэмболического инсульта, тогда как наличие аутоантител к ЩЖ может быть связано с худшими прогнозами течения ишемического инсульта. Дисфункция ЩЖ способствует ремоделированию артериальной стенки и повышению сердечно-сосудистого риска [32–34].
Нарушение функции ЩЖ в течение многих лет также считается потенциальной причиной снижения когнитивных способностей. В различных исследованиях, в том числе метаанализах, наиболее часто сообщалось о повышенном риске развития деменции, особенно у пожилых пациентов, а также о нарушениях внимания, концентрации, вербальной памяти и исполнительных функций при манифестном гипертиреозе [31, 35, 36].
В свою очередь, при манифестном гипотиреозе, представляющем собой состояние, при котором показатели тиреотропного гормона (ТТГ) превышают референсные значения, а уровни свободных трийодтиронина и тироксина (Т4) находятся ниже нормы, наиболее часто регистрируются нарушения вербальной памяти. Также сообщается о связи между гипотиреозом и нарушениями общих когнитивных функций, памяти, внимания, концентрации, восприятия, речи, скорости психомоторных реакций и исполнительных функций [37, 38]. Еще одним фактором, влияющим на прогрессирование КН при гипотиреозе, в том числе субклиническом, можно считать поведенческие нарушения, сходные с теми, которые наблюдаются при первичных депрессивных и тревожных расстройствах, что может влиять на приверженность к лечению [39, 40].
Ожирение, СД и дисфункция ЩЖ имеют тесные ассоциации. Ожирение значимо связано с повышенным риском гипотиреоза (относительный риск (ОР) 1,86; 95% доверительный интервал (ДИ): 1,63–2,11, р < 0,001); после стратификации рисков дополнительно показано, что в популяции с ожирением увеличен риск явного (манифестного) гипотиреоза (ОР 3,21; 95% ДИ: 2,12–4,86, р < 0,001) и субклинического гипотиреоза (ОР 1,70; 95% ДИ: 1,42–2,03, р < 0,001). Кроме того, ожирение ассоциировано с аутоиммунной реактивностью и значимо связано с уровнем антител к тиреоидной пероксидазе (ОР 1,93; 95% ДИ: 1,31–2,85, р = 0,001) [41]. Таким образом, перечисленные заболевания тесно взаимосвязаны и могут синергично повышать вероятность нарушения когнитивных функций.
Влияние гормонов ЩЖ на центральную нервную систему – процесс крайне сложный и комплексный. Оно реализуется как через геномные механизмы, затрагивающие активацию ядерных рецепторов ТГ, так и через негеномные, в которых задействованы рецепторы, расположенные на клеточной мембране, в цитоплазме или в митохондриях. При гипотиреозе происходит снижение метаболизма с последующей дегенерацией клеток головного мозга в долгосрочной перспективе, что может приводить к возникновению деменции. В некоторых исследованиях сообщается, что дефицит трийодтиронина усугубляет митохондриальную дисфункцию, сказываясь на нарушениях метаболизма глюкозы и общих метаболических процессах в головном мозге, что может способствовать развитию КН [42]. В экспериментальных исследованиях было показано разнонаправленное действие ТГ на образование активных форм кислорода вследствие активации как катаболических, так и анаболических процессов, а также на окислительный стресс в целом, в том числе благодаря воздействию на фосфолипидный состав мембран митохондрий и их восприимчивость к атаке свободных радикалов [43]. Сообщалось, что гипотиреоз единовременно способствует как защите от окислительного стресса путем уменьшения продукции активных форм кислорода, так и снижению антиоксидантной активности и увеличению окислительного повреждения кислород-чувствительных клеток, в то время как гипертиреоз связан с окислительным стрессом и снижением уровня антиоксидантных метаболитов, способствуя процессам нейродегенерации и гибели нейронов головного мозга [44]. Доказано важное влияние ТГ, в особенности трийодтиронина, на работу таких ионно-обменных насосов, как натрий-калиевая и кальциевая аденозинтрифосфатаза, отвечающих за ионный баланс нейронов и нормализацию кислотности внутриклеточной среды. В экспериментальных исследованиях также продемонстрирована роль ТГ в модулировании цитоскелета астроцитов и нейронов, формировании нейронных отростков, генерации новых синаптических связей, что может быть перспективной точкой приложения при разработке терапевтических подходов к стимуляции нейропластичности [45, 46]. Механизмы воздействия ТГ на когнитивные функции приведены на рисунке 2.
ПОДХОДЫ К ТЕРАПИИ КОГНИТИВНЫХ НАРУШЕНИЙ
Неуклонно возрастающее бремя нейрокогнитивных расстройств является вызовом для медицинского сообщества в течение длительного времени. Разработано множество традиционно используемых в клинической практике доказательных подходов, основанных на снижении общего сердечно-сосудистого риска, профилактике цереброваскулярных катастроф и лечении коморбидных состояний. Наслоение и взаимопотенцирующее действие сосудистой патологии головного мозга и заболеваний метаболического спектра (СД, ожирение, дистиреоз) способствовало созданию концепции цереброметаболического здоровья [49]. С учетом представленного разнообразия патогенетических механизмов, располагающих к развитию КН у пациентов с сосудистой патологией мозга и такими сопутствующими заболеваниями, как СД, дистиреоз и ожирение, наиболее целесообразна мультимодальная терапия, воздействующая на различные звенья протекающих патологических процессов. Отдельная проблема – низкая приверженность больных с сосудистыми заболеваниями головного мозга к рекомендациям по модификации образа жизни [50], что осложняет их курацию.
Терапия хронической цереброваскулярной патологии должна проводиться с позиций мультиморбидности. Для правильного определения патогенетической стратегии терапии КН при хронических цереброваскулярных заболеваниях следует принимать в расчет такие аспекты, как тяжесть когнитивного дефицита, факторы риска и наличие сопутствующих заболеваний и соматических осложнений. Принципы лечения могут быть различными в зависимости от того, достигают ли нарушения памяти степени деменции, при этом терапия должна включать как лекарственные, так и немедикаментозные методы и быть нацеленной на коррекцию не только когнитивных, но и некогнитивных (поведенческих, эмоционально-аффективных) расстройств. Всем пациентам с КН для улучшения повседневной активности рекомендуется выполнять упражнения для стимуляции когнитивных функций (когнитивный тренинг), по возможности сохранять высокую профессиональную и социальную активность. Не рекомендуется рутинное назначение антихолинэстеразных средств (ингибиторов холинэстеразы – ривастигмина, донепизила), а также ингибиторов глутаматных NMDA-рецепторов (мемантина) у пациентов с легкими формами КН сосудистого генеза [51]. В связи с этим в комплексном лечении данной категории больных применяются следующие группы лекарственных средств: дезагрегантные, антигипертензивные и гиполипидемические средства, антиоксиданты и антигипоксанты, вазоактивные препараты. Одной из стратегий лечения сосудистых заболеваний головного мозга наравне с необходимой коррекцией коморбидных патологий и модификацией образа жизни служит нейропротекция – защита клеток головного мозга от повреждающего действия сосудистых и метаболических процессов. Распространенность и социальная значимость КН, относящихся к основным проявлениям хронических цереброваскулярных заболеваний, определяют востребованность в клинической неврологической практике препаратов нейропротективного ряда.
В мировой практике накоплен большой опыт безопасного применения различных нейропротекторов, включая Церебролизин [52].
Церебролизин является одним из хорошо зарекомендовавших себя в течение многолетней практики препаратов с потенциальным плейотропным воздействием на ряд ключевых факторов развития КН. Он представляет собой пептидный препарат, способный, благодаря своей низкой молекулярной массе (не более 10 тыс. Дальтон), проникать через гематоэнцефалический барьер и обладающий нейропротекторными, нейрорегенеративными и нейротрофическими свойствами. Церебролизин получают в результате биотехнологического процесса из очищенных белков свиного мозга. Препарат широко используется в клинической практике при лечении КН, деменции, острых и хронических цереброваскулярных заболеваний [53, 54].
Церебропротекторные свойства Церебролизина связаны с содержащимися в нем короткоцепочечными нейротрофическими факторами, которые, помимо прочего, обладают противовоспалительными свойствами. Было показано, что Церебролизин эффективно снижает индуцированную глутаматом эксайтотоксичность, а также уменьшает повреждение нейронов, вызванное окислительным стрессом и перекисным окислением липидов [55]. Исследование, проведенное в 2022 г., показало антиоксидантную активность препарата, а также его способность снижать уровень воспалительных цитокинов [56]. Известно, что Церебролизин взаимодействует с ФНО-α, фактором роста нервов (NGF), инсулиноподобным фактором роста (IGF- 1) и фактором роста эндотелия сосудов (VEGF). Среди благоприятных эффектов Церебролизина также можно отметить способность уменьшать астроглиоз, усиливать нейронеогенез, синаптическую регенерацию и улучшать выживаемость нейронов [55]. Благодаря продемонстрированному в серии клинических и экспериментальных исследований мультимодальному действию Церебролизин нашел широкое применение в практике медицинских работников более чем 50 стран мира. В 2023 г. эксперты провели обзор исследований и метаанализов эффективности и безопасности применения этого лекарственного средств у пациентов с различными формами КН, за исключением тяжелой деменции. В двух метаанализах было установлено положительное влияние Церебролизина на общий уровень когнитивных функций и функциональный статус, причем нежелательные явления соответствовали таковым в группе контроля, что позволяет говорить о безопасности применения препарата [57, 58]. Также эксперты достигли консенсуса в отношении схемы применения Церебролизина и рекомендованных к использованию дозировок, что особенно важно с практической точки зрения. На ранних, додементных стадиях КН (легкие и умеренные КН) они рекомендовали использовать дозировки 5–10 мл ежедневно в течение 10 дней с повторением курса терапии 2 раза в год. Исключение составили умеренные КН с высоким риском конверсии в деменцию, на который могут указывать наличие коморбидной патологии, амнестический вариант когнитивного дефицита с ранним нарушением семантической памяти и речи, низкий балл по шкале MMSE при выполнении когнитивного тестирования. В этом случае, по мнению экспертов, целесообразно назначение высоких доз Церебролизина (20 мл/сут.) [59].
Учитывая мультитаргетное воздействие Церебролизина на процессы окислительного стресса и воспаления, которые, согласно множеству клинических и экспериментальных исследований, вносят существенный вклад в развитие КН у коморбидных пациентов с цереброваскулярной патологией, ожирением и/или заболеваниями ЩЖ, включение в схему терапии инфузий этого препарата представляется логичным и обоснованным решением для врача-клинициста. Ниже представлены два клинических наблюдения из реальной практики ведения пациентов с КН в ФГБНУ «Научный центр неврологии» (НЦН, Москва).
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ № 1
Пациентка М., 71 год, поступила в НЦН с жалобами на выраженное снижение памяти на недавние и отдаленные события, ограничение бытовой активности из-за снижения памяти.
Из анамнеза известно, что она более 20 лет страдает артериальной гипертензией с максимальными повышениями артериального давления до 190/110 мм рт. ст., постоянно принимает комбинированную антигипертензивную терапию. Имела избыточную массу тела в течение 25 лет (при росте 168 см весила 89 кг, индекс массы тела 31,5 кг/ м2), за последние 5 лет прибавила в весе более 10 кг. Убедительных указаний на наличие СД в анамнезе нет.
В последние 5 лет М. отмечала прогрессирующее ухудшение памяти, была вынуждена переехать на постоянное жительство к родственникам в связи с необходимостью постороннего контроля и ограничений в быту (со слов дочери, начала забывать, принимала ли таблетки, стала хуже ходить).
Масса тела на момент осмотра составляла 103 кг при росте 168 см (индекс массы тела 36,49 кг/м2).
Неврологический статус: в месте и собственной личности ориентирована правильно, несколько дезориентирована во времени. Со стороны черепных нервов – без патологии. Парезов в руках и ногах нет, объем движений в норме, мышечный тонус не изменен, сухожильные рефлексы с рук и ног снижены, рефлексы орального автоматизма с двух сторон. Координаторные пробы выполняет с дисметрией, в позе Ромберга неустойчива. Страдает неустойчивостью при ходьбе.
При нейропсихологическом тестировании – значительное снижение непосредственного воспроизведения в тесте на запоминание 10 слов и объема отсроченного воспроизведения. Объем зрительной памяти умерено сужен. Значительно снижен темп умственных операций в решении серийного счета (допускались ошибки), сенсомоторных реакций распределяемости внимания. В предметном гнозисе фиксируется хаотичность восприятия, в зрительно-пространственном гнозисе – метрические и проекционные ошибки при копировании объемной фигуры и в самостоятельном рисунке. В процессе чтения замедлен темп, пациентка невнимательна. Для усвоения моторной серии требовалось увеличение количества проб, не сразу находилась правильная поза по кинестетическому образцу. В пробе на графический стереотип наблюдались склонность к персеверациям, смещение графического узора. Отмечено снижение мотивации, эмоционального фона при обнаружении трудностей. Таким образом, на первом плане у М. пребывали модально-неспецифические нарушения памяти в умеренно выраженной степени, снижение распределяемости внимания, неустойчивость психомоторного темпа, дефицит зрительно-конструктивной, пространственной деятельности и дефицит динамического и кинестетического компонента. В эмоционально-личностной сфере обнаружены выраженная депрессия, умеренно выраженная реактивная и личностная тревожность, причем депрессия оказывала влияние на полученные результаты в когнитивной сфере в звене мотивации.
Данные количественного анализа с использованием клинических шкал: по шкале HADS показатели тревоги – 8 баллов, депрессии – 9 баллов; результат по шкале депрессии Бека – 30 баллов; по шкале уровня самооценки тревожности показатели реактивной тревожности – 40 баллов, личностной – 35 баллов. Сумма баллов по шкале MoCA – 20/30, по Адденбрукской шкале оценки когнитивных функций – 76/100.
Данные лабораторного обследования: дислипидемия (гиперхолестеринемия, повышение уровня триглицеридов, холестерина липопротеидов низкой плотности (ЛПНП)), гипергликемия натощак – 7,3 ммоль/л, уровень гликированного гемоглобина – 6,8%.
Данных в пользу дистиреоза получено не было. По данным нейровизуализации (магнитно-резонансная томография головного мозга) – картина многочисленных очагов сосудистого генеза (Fazekas 2–3).
При дуплексном сканировании брахиоцефальных артерий обнаружен атеросклероз магистральных артерий с максимальным стенозом обеих внутренних сонных артерий до 55%.
По совокупности анамнестических данных, клинической картины, результатов инструментального и лабораторного дообследования установлен основной клинический диагноз: цереброваскулярное заболевание: дисциркуляторная энцефалопатия, декомпенсация. Отмечены фоновые и сопутствующие заболевания: ожирение 2-й степени, СД 2. В рамках комплексных лечебных мероприятий пациентке были даны рекомендации по модификации образа жизни, проводилась антигипертензивная, гиполипидемическая, сахароснижающая терапия, с целью коррекции КН было осуществлено курсовое лечение препаратом Церебролизин 20 мл + 200 мл 0,9% NaCl внутривенно капельно в течение 10 дней.
При оценке когнитивного статуса пациентки через 2 мес. после курса лечения наблюдалось улучшение счета, некоторое увеличение объема кратковременной памяти (воспроизводила 3 из 5 слов), уменьшение выраженности зрительно-конструктивных и пространственных нарушений. Оценка по шкале MoCA составила 18/30 баллов, по Адденбрукской шкале оценки когнитивных функций – 79/100 баллов.
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ № 2
Пациентка А., 66 лет, поступила в НЦН с жалобами на снижение концентрации внимания и памяти, головокружение и шаткость при ходьбе.
Из анамнеза известно, что пациентка более 5 лет страдает редкими повышениями артериального давления до 140/90 мм рт. ст., антигипертензивную терапию на постоянной основе не принимала. В последние 3 года А. стала отмечать возникновение головокружения, шаткости при ходьбе, снижения концентрации внимания и памяти, однако по поводу этих жалоб ранее к медицинским работникам не обращалась. В течение последних 2 мес. до обращения произошло усиление указанных симптомов с присоединением сонливости, что стало затруднять повседневную активность пациентки и негативно сказываться на качестве жизни.
В анамнезе – более 7 лет первичный гипотиреоз в исходе хронического аутоиммунного тиреоидита. По поводу гипотиреоза А. принимает терапию препаратом левотироксина.
Неврологический статус: пациентка контактна, несколько некритична к своему состоянию. Со стороны черепных нервов – без патологии. Двигательная сфера без отклонений от нормы. Координаторные пробы пациентка выполняет с дисметрией, в пробе Ромберга неустойчива. Отмечаются шаткость при ходьбе, выраженное затруднение при тандемной ходьбе.
При нейропсихологическом тестировании – тенденция к замедлению выполнения темпа заданий, неравномерная работоспособность, снижение внимания. Слухоречевая и зрительная память снижены в средней степени. В изображении фигуры с переворотом – легкие координатные ошибки. Таким образом, у пациентки наблюдались умеренное снижение памяти по модально-неспецифическому типу (с преобладанием нарушений отсроченного воспроизведения), элементы оптико-пространственных нарушений, негрубые нейродинамические расстройства.
Данные количественного анализа с использованием клинических шкал: по шкале HADS показатели тревоги – 9, депрессии – 12 баллов; по шкале уровня самооценки тревожности показатели реактивной тревожности – 47, личностной – 57 баллов. Сумма баллов по шкале MoCA – 23/30, по Адденбрукской шкале оценки когнитивных функций – 85/100.
Результаты лабораторного дообследования: гиперхолестеринемия, повышение фракции ЛПНП (гиперхолестеринемия, повышение уровня триглицеридов, ЛПНП), субклинический гипотиреоз (ТТГ – 5,9 мкМед/мл, свободный Т4 – 13,1 пмоль/л, антитела к тиреопероксидазе – 300 МЕ/мл). Данных в пользу нарушения углеводного обмена получено не было.
По данным нейровизуализации (магнитно-резонансная томография головного мозга) – картина сосудистого поражения головного мозга (Fazekas 1).
При дуплексном сканировании магистральных артерий головы выявлен атеросклероз магистральных артерий с максимальным стенозом левой наружной сонной артерий до 50%.
При ультразвуковом исследовании ЩЖ отмечены диффузные изменения паренхимы.
С учетом выявленной коморбидной патологии А. была подобрана антигипертензивная терапия, проведена консультация эндокринолога. На основе совокупности анамнестических данных, клинической картины, результатов инструментального и лабораторного дообследования установлен диагноз: цереброваскулярное заболевание – дисциркуляторная энцефалопатия, декомпенсация.
Пациентке было назначено комплексное лечение: для коррекции сопутствующей патологии – гиполипидемическая, антигипертензивная терапия, для воздействия на имеющиеся КН – курс внутривенных инфузий Церебролизина 10 мл + 200 мл 0,9% NaCl внутривенно капельно в течение 10 дней.
Цели терапии гипотиреоза у пожилых больных обсуждаются. Нормальный уровень ТТГ у таких пациентов несколько выше, чем у лиц моложе 65 лет, и в качестве целевого значения, согласно современным рекомендациям, может быть выбран более высокий уровень этого гормона [60]. Пациентке были рекомендованы продолжение заместительной терапии гипотиреоза без коррекции дозы, дальнейшее наблюдение эндокринолога по месту жительства.
При повторном неврологическом осмотре А. через 2 мес. после проведенного курса стационарного лечения наблюдалось уменьшение выраженности вестибуло-атактического синдрома и шаткости при ходьбе, при нейропсихологическом тестировании – снижение выраженности когнитивных и психоэмоциональных нарушений: оценка по шкале MoCA составила 26/30 баллов, по Адденбрукской шкале оценки когнитивных функций – 89/100 баллов, по госпитальной шкале тревоги и депрессии HADS – 7/4 баллов.
ЗАКЛЮЧЕНИЕ
Широкая палитра клинических проявлений цереброметаболического нездоровья включает и когнитивную дисфункцию. КН у пациентов с сосудистой патологией головного мозга зачастую развиваются в условиях коморбидности, что делает и без того сложную проблему борьбы с когнитивной дисфункцией у подобной когорты пациентов еще более комплексной, требующей междисциплинарного подхода. Изучение механизмов развития когнитивных расстройств у таких пациентов, находящихся на стыке неврологии и эндокринологии, является перспективной областью развития мультитаргетной терапии, способной влиять сразу на несколько «точек» патогенетических каскадов, ведущих к снижению когнитивных функций. Исходя из описанных выше механизмов действия Церебролизина, хорошего профиля безопасности, данных научных публикаций и исследований, посвященных изучению препарата, а также обширного опыта его использования, назначение этого препарата представляется патогенетически оправданным с точки зрения персонифицированного подхода к лечению данной категории пациентов.
Информированное согласие
От пациенток было получено письменное добровольное информированное согласие на публикацию результатов обследования и лечения.



