1) Tyumen State Medical University of the Ministry of Healthcare of Russia;
2) Tyumen Cardiological Research Center – a branch of Tomsk National Research Medical Center of the Russian Academy of Sciences
Abstract. Chronic kidney disease (CKD) through cardiovascular risks and end-stage renal disease development affects the global morbidity and mortality burden worldwide.
The aim of the study is to characterize the indicators of systemic inflammation in correlation with cardiovascular system changes in CKD patients.
Material and methods. 150 patients with CKD were examined. All participants of the research were divided into 2 groups: patients with CKD without cardiovascular disease (CVD, n=75); and CKD patients with CVD (n=75). The groups differed significantly in SBP, DBP, HR, BMI (p <0,001). Special research methods included the determination of the level of interleukins (IL-1, IL-6, IL-8), TNF-α, fibroblast proliferation factor (TgFb1) and highly sensitive CRP.
Results. In examined patients with CKD and CVD, there was found an increase in the level of IL-1, IL-6, TNF-α, as well as a tendency for increase of TgFb1 level and decrease of IL-8 comparatively with CKD patients without CVD. It was fixed an increase of cystatin C level and microalbuminuria among patients with CVD comparatively with the group without CVD.
Conclusion. Pathological processes laying in CKD basis are accompanied by an increase in the level of pro-inflammatory cytokines. The results obtained can serve as a prerequisite for improving the pathogenetic therapy of CKD with cardiovascular manifestations.
chronic kidney disease
systemic inflammation
cardiovascular changes
АКТУАЛЬНОСТЬ
Хроническая болезнь почек (ХБП) через сердечно-сосудистые риски и развитие терминальной почечной недостаточности напрямую влияет на глобальное бремя заболеваемости и смертности во всем мире. Прогрессирующие структурно-функциональные изменения в сердечно-сосудистой системе в случае ХБП обусловливают плохой прогноз заболевания [1, 2]. Среди многочисленных «почечных» факторов сердечно-сосудистого риска при ХБП существенное значение имеют цитокиновый статус и показатели системного воспаления. К цитокинам относятся интерфероны, колониестимулирующие факторы, хемокины, трансформирующие ростовые факторы, фактор некроза опухоли альфа (ФНО-α), интерлейкины (ИЛ) и др. Повреждающие эффекты цитокинов проявляются при их избыточной, долговременной и генерализованной продукции, при нарушении равновесия между про- и противовоспалительными типами цитокинов [3]. При ХБП начало воспалительного ответа и основные этапы его развития происходят с участием иммунокомпетентных клеток в присутствии цитокинов, которые продуцируются клетками иммунной системы в ответ на стимуляцию инфекционными антигенами, в том числе вирусами, и играют весьма важную патогенетическую роль в возникновении сердечно-сосудистых осложнений [4].
Субклиническое воспаление эндотелия сосудистой стенки рассматривается как важное звено патогенеза артериальной гипертензии (АГ), атеросклероза и, возможно, прогрессирования ренальной дисфункции [3–5]. Поэтому изучение показателей системного воспаления и его взаимосвязи со структурно-функциональными изменениями сердечно-сосудистой системы при ХБП остается актуальной задачей для оценки прогноза заболевания и эффективности рено- и кардиопротективной терапии.
Цель исследования – дать характеристику показателям системного воспаления во взаимосвязи с изменениями сердечно-сосудистой системы у больных с ХБП.
МАТЕРИАЛ И МЕТОДЫ
Проведено клиническое наблюдение и обследование 150 пациентов с ХБП. Наблюдение и обследование больных осуществлялось на базе Тюменского кардиологического научного центра и Тюменского ГМУ (кафедра пропедевтической терапии). Пациенты с ХБП были разделены на 2 группы: 1-я – лица без сердечно-сосудистых заболеваний (n=75); 2-я – лица, имеющие сердечно-сосудистые заболевания (n=75).
Возраст участников исследования составил 57 [51,00; 63,00] лет в группе без сердечно-сосудистых заболеваний (ССЗ) и 58 [52,00; 63,00] лет – в группе c CCЗ. Среди кардиоваскулярных заболеваний 54,4% пациентов во второй группе имели АГ, 16,5% – ишемическую болезнь сердца (ИБС), 32,1% – нарушения ритма сердца; сердечная недостаточность 1–2 ст. по NYHA имелась у 68,3% человек. Группы значимо различались по уровню систолического (САД), диастолического артериального давления (ДАД), частоте сердечных сокращений (ЧСС), индексу массы тела (р <0,001 для всех параметров), с более высокими показателями во 2-й группе. По стадиям ХБП пациенты распределились следующим образом: С1 – 56,4%, С2 – 43,6% в группе без ССЗ; С1 – 52,5% и С2 – 47,5% в группе с ССЗ.
Всем больным было выполнено клиническое, лабораторное и инструментальное обследование (суточное мониторирование АД, эхокардиография). Участники исследования были осмотрены терапевтом, кардиологом, нефрологом.
Специальные методы исследования включали определение уровня ИЛ-1, ИЛ-6, ИЛ-8, ФНО- α, фактора пролиферации фибробластов (TgFb1) и высокочувствительного С-реактивного белка (вчСРБ) иммунотурбидиметрическим методом на полуавтоматическом анализаторе открытого типа Clima MC-15 (Испания), а также Д-димера, фибриногена, ферритина, натрийуретического пептида (NT-proBNP), цистатина С, микроальбуминурии (МАУ) на анализаторе Destiny Plus (Ирландия). Скорость клубочковой фильтрации (СКФ) рассчитывалась по формуле CKD-EPI.
Статистический анализ проводился с помощью пакета прикладных программ IBM SPSS Statistics 21. В зависимости от распределения при сравнении показателей в двух независимых группах использовался t-критерий Стьюдента или U-критерий Манна–Уитни. При нормальном распределении данные представлены как среднее М и стандартное отклонение (SD), при распределении, отличном от нормального, – в виде медианы (Me) и интерквартильного размаха [25%; 75%]. С помощью парного критерия Стьюдента или критерия Вилкоксона рассчитывалась динамика между связанными группами. Результаты оценивались как статистически значимые при двухстороннем уровне р <0,05.
РЕЗУЛЬТАТЫ
Как показали проведенные исследования (табл. 1), у наблюдаемых больных с ХБП и ССЗ отмечается повышение уровня ИЛ-1 (p <0,003), ИЛ-6 (p <0,001), ФНО-α (p <0,004), а также тенденция к повышению уровня TgFb1 (p <0,702) и снижению уровня ИЛ-8 (p <0,301) по сравнению с больными ХБП без ССЗ. Кроме того, у пациентов с ССЗ выявлено значительное (более чем в 2 раза) повышение уровня вчСРБ, а также в меньшей степени Д-димера, фибриногена и ферритина, по сравнению с больными ХБП без ССЗ.
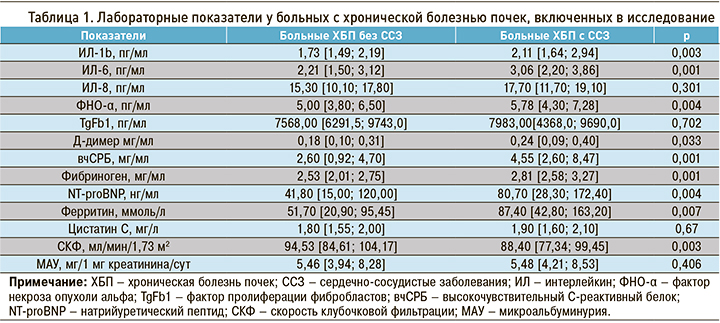
Уровень NT-proBNP у наблюдаемых больных с ССЗ оказался почти в 2 раза выше, чем у пациентов без ССЗ (р <0,004), а СКФ – ниже на 6,5% (p <0,003). Это свидетельствует о наличии сердечной и почечной недостаточности в группе больных ХБП с ССЗ. Кроме того, нами отмечена тенденция к увеличению уровня цистатина С (p <0,67) и МАУ (p <0,406) в группе больных с ССЗ по сравнению с группой без ССЗ.
Суточное мониторирование АД показало более высокие значения у наблюдаемых больных с кардиоваскулярными заболеваниями среднего САД (161±3,8 против 131±2,6 мм рт.ст. у пациентов без ССЗ, р <0,001) и ДАД (96,2±2,8 против 83,2±1,8 мм рт.ст., р <0,001), а также скорости утреннего подъема САД (19,4±1,4 против 13,1±1,2 мм рт.ст., р <0,001) и ДАД (14,1±0,7 против 9,2±0,5 мм рт ст., р <0,001).
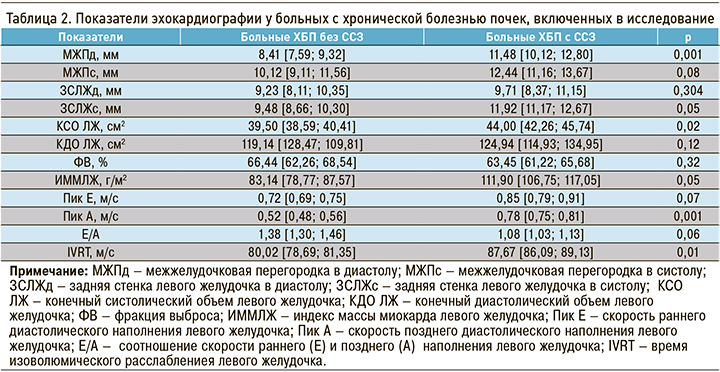
По данным эхокардиографического исследования (табл. 2) у пациентов с ХБП и ССЗ, по сравнению с больными ХБП без сердечно-сосудистой патологии, наблюдалось увеличение толщины межжелудочковой перегородки в диастолу, задней стенки левого желудочка в систолу, индекса массы миокарда левого желудочка, а также конечно-систолического объема левого желудочка. При сравнении показателей трансмитрального кровотока в наблюдаемых группах были получены достоверные различия: у пациентов с ССЗ скорость позднего наполнения левого желудочка и время изоволюмического расслабления были существенно выше, чем в группе без кардиоваскулярных заболеваний (см. табл. 2). Это свидетельствует о нарушении диастолической функции ЛЖ у больных ХБП с ССЗ.
ОБСУЖДЕНИЕ
При ХБП начало воспалительного ответа и основные этапы его развития проходят с участием иммунокомпетентных клеток. Известно, что ренин-ангиотензин-альдостероновая система (РААС) может стимулировать продукцию ряда цитокинов, способствующих прогрессированию нефросклероза и присоединению сердечно-сосудистых осложнений. Кроме того, установлено, что уровень провоспалительных цитокинов коррелирует с активностью ХБП и степенью морфологических изменений в почечной ткани [5, 6].
К настоящему времени установлено, что такие провоспалительные цитокины, как ИЛ-1, ИЛ-6, ФНО-α, ассоциируются с высокой частотой развития осложнений при ХБП и рассматриваются в качестве иммунологических маркеров сердечно-сосудистого риска [7]. Кроме того, ФНО-α является сильным активатором перекисного окисления липидов и системы свертывания крови, усиливает тромбогенную и вазоконстриктивную активность эндотелия, снижает синтез оксида азота, что в конечном итоге приводит к прогрессированию эндотелиальной дисфункции, повышению жесткости артериального русла и формированию сердечно-сосудистых осложнений [8]. Было обнаружено, что у пациентов с АГ и гипертрофией левого желудочка повышалось содержание ФНО-α и ИЛ-6 без существенного повышения концентрации СРБ и ИЛ-1 [10]. В наших ранее проведенных исследованиях [11, 12] также было выявлено существенное нарушение состояния сердечно-сосудистой системы у наблюдаемых больных с изменением морфометрических показателей сердца, нарушением диастолической функции левого желудочка, а также показателей суточного мониторирования АД, что может рассматриваться как предиктор неблагоприятного течения и прогноза заболевания.
ЗАКЛЮЧЕНИЕ
Таким образом, патологические процессы, лежащие в основе ХБП, сопровождаются возрастанием уровня провоспалительных цитокинов и показателей системного воспаления, что способствует ускорению кардиоваскулярных осложнений посредством эндотелиальной дисфункции. Полученные нами результаты могут служить предпосылкой для совершенствования патогенетической терапии ХБП с кардиоваскулярными проявлениями, в основе которой может быть применение препаратов с противовоспалительным эффектом – дапаглифлозина, биофлавоноидов (эскузан), аденозилметионина, омега-3 жирных кислот (эйкозапентаеновой и декозагексаеновой, обладающих противовоспалительными свойствами за счет снижения выработки эйкозаноидов и цитокинов), а также модуляция микробиоты кишечника [13].
Следовательно, существует настоятельная необходимость разработки новых методов ведения пациентов с ХБП и ССЗ, в том числе рекомендаций по применению новых противовоспалительных препаратов и методов нефро-и кардиопротекции.
1. Мухин Н.А. Нефрология. Национальное руководство. Краткое издание. М.: ГЭОТАР-Медиа 2016; 606 с. [Mukhin N.A. Nephrology. National leadership. Short edition. Moscow: GEOTAR-Media. 2016; 606 pp. (In Russ.)]. ISBN 978-5-9704-3788-9
2. Yuan J., Zou X.R., Han S.P. et al. Prevalence and risk factors for cardiovascular disease among chronic kidney disease patients: results from the Chinese cohort study of chronic kidney disease (C-STRIDE). BMC Nephrol. 201; 18(1): 23. https://dx.doi.org/10.1186/s12882-017-0441-9.
3. Муркамилов И.Т., Фомин В.В., Айтбаев К.А. с соавт. Цитокиновая модель развития сердечно-сосудистых осложнений при хронической болезни почек. Клиническая нефрология. 2017; (2): 71–75. [Murkamilov I.T., Fomin V.V., Aytbaev K.A. et al. Cytokine model for the development of cardiovascular complications in chronic kidney disease. Klinicheskaya nefrologiya = Clinical Nephrology. 2017; (2): 71–75 (In Russ.)]. EDN: YTYAEN.
4. Cheung C.M., Wright J.R., Shurrab A.D. Epidemiology of renal dysfunction and patients outcome in atherosclerotic renal occlusion. J. Am Soc Nephr.2002; 13(1): 149–57. https://dx.doi.org/10.1681/ASN.V131149.
5. Chan R.W., Lai F.M., Li E.K. et al. Urinary mononuclear cell and disease activity of systemic lupus erythematosus. Lupus. 2006: 15(5): 262–67. https://dx.doi.org/10.1191/0961203306lu2287oa.
6. Бобкова И.Н., Чеботарева Н.В., Козловская Н.В. с соавт. Экскреция с мочой моноцитарного хемотаксического протеина-1 и трансформирующего фактора роста b1 как показатель прогрессирования хронического гломерулонефрита. Терапевтический архив. 2006; 78(5): 9–14. [Bobkova I.N., Chebotareva N.V., Kozlovskaya N.V. et al. Urinary excretion of monocytic chemotactic protein-1 and transforming growth factor b1 as an indicator of progression of chronic glomerulonephritis. Terapevticheskiy arkhiv = Therapeutic Archive. 2006; 78(5): 9–14 (In Russ.)]. EDN: HUGPKB.
7. Кетлинский С.А., Симбирцев А.С. Цитокины. СПб. 2008; 552 с. [Ketlinskiy S.A., Simbirtsev A.S. Cytokines. Saint Petersburg. 2008; 552 pp. (In Russ.)]. ISBN: 978-5-93929-171-2.
8. Жмуров В.А., Осколков С.А., Казеко Н.И. Хронический пиелонефрит у жителей различных климато-географических регионов. Тюмень. 2006; 304 с. [Zhmurov V.A., Oskolkov S.A., Kazeko N.I. Chronic pyelonephritis in residents of various climatic and geographical regions. Tyumen. 2006; 304 pp. (In Russ.)].
9. Радаева О.А., Симбирцев А.С. Клинико-патогенетические особенности взаимодействия системы интерлейкина 1 и классических вазопрессорных факторов у больных эссенциальной артериальной гипертензией. Цитокины и воспаление. 2015; 14(3): 83–89. [Radaeva O.A., Simbirtsev A.S. Clinical and pathogenetic features of interleukin 1 system interaction and classical vasopressor factors in patients with essential arterial hypertension. Tsitokiny i vospalenie = Cytokines and Inflammation. 2015; 14(3): 83–89 (In Russ.)]. EDN: WIDSFX.
10. Адаменко Г.П., Головко Е.С., Скребло Е.И. Маркеры внутрисосудистого воспаления и профиль цитокинов при артериальной гипертензии. Проблемы здоровья и экологии. 2014; (2): 40–44. [Adamenko G.P., Golovko E.S., Skreblo E.I. Intravascular inflammation markers and cytokine profile in hypertension. Problemy zdorov’ya i ekologii = Issuess of Health and Ecology. 2014; (2): 40–44 (In Russ.)]. EDN: TSLEDT.
11. Жмуров Д.В., Жмуров В.А., Петров И.М. с соавт. Динамический контроль состояния сердечно-сосудистой системы и функции почек у пациентов с хронической болезнью почек, перенесших COVID-19. Клиническая нефрология. 2022; 14(4): 13–18. [Zhmurov D.V., Zhmurov V.A., Petrov I.M. et al. Dynamic monitoring of cardiovascular health and renal function in patients with chronic kidney disease who have undergone COVID-19. Klinicheskaya nefrologiya = Clinical Nephrology. 2022; 14(4): 13–18 (In Russ.)]. https://dx.doi.org/10.18565/nephrology.2022.4.13-18. EDN: GRRCQU.
12. Жмуров Д.В., Жмуров В.А., Петров И.М. с соавт. Цитокиновый профиль и состояние сердечнососудистой системы пациентов с хронической болезнью почек, перенесших COVID-19. Клиническая нефрология. 2022; 14(3): 15–19. [Zhmurov D.V., Zhmurov V.A., Petrov I.M. et al. Cytokine profile and cardiovascular status of patients with chronic kidney disease who have undergone COVID-19. Klinicheskaya nefrologiya = Clinical Nephrology. 2022; 14(3): 15–19 (In Russ.)]. https://dx.doi.org/10.18565/nephrology.2022.3.15-19. EDN: DNZVGG.
13. Бобкова И.Н., Камышова Е.С. Терапия иммуноглобулин А-нефропатии: что помимо иммуносупрессии? Клиническая нефрология. 2022; 14(4): 43–48. [Bobkova I.N., Kamyshova E.S. Immunoglobulin A therapy-nephropathy: What about immunosuppression? Klinicheskaya nefrologiya = Clinical Nephrology. 2022; 14(4): 43–48 (In Russ.)]. https://dx.doi.org/10.18565/nephrology.2022.4.43-48. EDN: VSMNSO.
Denis V. Zhmurov, PhD in Medical Sciences, associate professor of the Department of propaedeutics of internal diseases, Tyumen State Medical University of the Ministry of Healthcare of Russia. Address: 625023, Tyumen, 54 Odesskaya Str. E-mail:
zhmdenis@yandex.ru. ORCID: https://orcid.org/0000-0003-3167-5310
Vladimir A. Zhmurov, MD, professor, head of the Department of propaedeutics of internal diseases, Tyumen State Medical University of the Ministry of Healthcare of Russia. Address: 625023, Tyumen, 54 Odesskaya Str. E-mail:
zhmurovva@yandex.ru. ORCID: https://orcid.org/0000-0002-7228-6197
Ivan M. Petrov, MD, associate professor, head of the Department of medical informatics and biological physics with the UNESCO bioethics network section, Tyumen State Medical University of the Ministry of Healthcare of Russia. Address: 625023, Tyumen, 54 Odesskaya Str.
Tatyana I. Petelina, MD, leading researcher at the Department of arterial hypertension and coronary insufficiency of the scientific Department of clinical cardiology, Tyumen cardiological Research Center – a branch of Tomsk National Research Medical Center of the Russian Academy of Sciences. Address: 625026, Tyumen, 111 Melnikaite Str.
Lyudmila I. Gapon, MD, professor, head of the scientific Department of clinical cardiology, scientific director of the Department of arterial hypertension, Tyumen Cardiological Research Center – a branch of Tomsk National Research Medical Center of the Russian Academy of Sciences. Address: 625026, Tyumen, 111 Melnikaite Str.
Elena I. Yaroslavskaya, MD, head of the Laboratory of instrumental diagnostics, Tyumen Cardiological Research Center – a branch of TOMSK NATIONAL RESEARCH MEDICAL CENTER of the Russian Academy of Sciences. Address: 625026, Tyumen, 111 Melnikaite Str.
Yulianna A. Petrova, PhD in Medical Sciences, associate professor of the Department of propaedeutics of internal diseases, Tyumen State Medical University of the Ministry of Healthcare of Russia. Address: 625023, Tyumen, 54 Odesskaya Str.
Sergey A. Oskolkov, MD, professor of the Department of propaedeutics of internal diseases, Tyumen State Medical University of the Ministry of Healthcare of Russia. Address: 625023, Tyumen, 54 Odesskaya Str.
Ekaterina A. Zhmurova, 2nd year attending physician at the Department of internal medicine, polyclinic therapy and family medicine, Tyumen State Medical University of the Ministry of Healthcare of Russia. Address: 625023, Tyumen, 54 Odesskaya Str.
Evgeniy Ya. Vanuito, postgraduate student of the Department of propaedeutics of internal diseases, Tyumen State Medical University of the Ministry of Healthcare of Russia. Address: 625023, Tyumen, 54 Odesskaya Str.
Anna A. Ermakova, institute of clinical medicine, 6th year student, Department of propaedeutics of internal diseases, Tyumen State Medical University of the Ministry of Healthcare of Russia. Address: 625023, Tyumen, 54 Odesskaya Str.
Polina A. Ermakova, institute of clinical medicine, 6th year student, Department of propaedeutics of internal diseases, Tyumen State Medical University of the Ministry of Healthcare of Russia. Address: 625023, Tyumen, 54 Odesskaya Str.





