ВВЕДЕНИЕ
Подагра является заболеванием с хорошо изученной эпидемиологией и высокой медико-социальной значимостью, актуальность которого не вызывает сомнений. Распространенность подагры среди взрослого населения колеблется в европейских странах от 0,9 до 2,5%, а в США достигает 3,9%. В Великобритании встречаемость подагры возросла с 1,5% в 1997 г. до 2,5% в 2012 г. [1].
Подагра – самая частая разновидность артрита с неуклонным ростом заболеваемости. Пик заболеваемости у мужчин фиксируется возрасте 40–50 лет, женщин – после 60 лет (в постменопаузальном периоде). Традиционно считается, что подагрой болеют преимущественно мужчины: соотношение пациентов мужского и женского пола молодого возраста с этим диагнозом находится на уровне 7:1 [2]. Заболеваемость подагрой варьирует в различных популяциях от 5 до 70 на 1000 среди мужчин и 1–10/1000 среди женщин. Средний возраст мужчин, страдающих подагрой, составляет 61 год, женщин – 71 год [3, 4]. Среди населения в возрасте до 65 лет распространенность подагры у мужчин в 4 раза выше, чем у женщин. Среди жителей США в целом соотношение мужчин и женщин с этим заболеванием – 20:1, однако в возрастной когорте старше 65 лет эта пропорция снижается до 3:1 [5, 6].
Облигатным фактором развития подагры служит гиперурикемия (ГУ), т.е. повышение сывороточного уровня мочевой кислоты (МК) выше 420 мкмоль/л, при котором у части пациентов происходит образование кристаллов моноурата натрия (МУН). Чем выше сывороточный уровень МК, тем выше риск развития подагры. Формирование кристаллов возможно и при более низком уровне этого показателя (360 мкмоль/л), прежде всего у женщин [7]. К основным причинам ГУ относятся генетические факторы, приводящие к повышению реабсорбции и снижению экскреции МК с мочой либо к ее гиперпродукции, избыточная масса тела и ожирение, повышение артериального давления (АД), прием алкоголя, потребление большого количества животного белка, применение мочегонных препаратов, а также ряд других заболеваний и состояний [8].
Ниже представлено клиническое наблюдение подагры наследственного генеза у молодой женщины, особенность которого – раннее начало заболевания с быстрым прогрессированием на фоне неадекватной уратснижающей терапии вследствие непереносимости аллопуринола, обусловившей тяжелое течение заболевания с инвалидизацией.
ОПИСАНИЕ КЛИНИЧЕСКОГО НАБЛЮДЕНИЯ
Пациентка Д., 44 лет, поступила в 2019 г. в Областной ревматологический центр ГБУЗ «Самарская областная клиническая больница им. В.Д. Середавина» с жалобами на выраженную дефигурацию суставов рук и ног с нарушением их функции, сниженную способность к самообслуживанию, болезненные узлы в области пястно-фаланговых, плюснефаланговых и левого локтевого суставов, язвенный дефект на латеральной поверхности левой стопы, повышение АД до 230–260/120 мм рт.ст.
По профессии пациентка – бухгалтер, не работает, с 2006 г. имеет инвалидность 2-й группы. Мать больной страдала тофусной подагрой, умерла от инсульта.
Пациентка считает себя больной с 2002 г., когда в возрасте 27 лет при сроке беременности 25 нед у нее появились припухлость, боль и ограничение движения в левом коленном суставе. Была проконсультирована ревматологом, который поставил диагноз «реактивный артрит». После проведенного лечения (антибактериальная терапия, антигистаминные препараты) припухлость левого коленного сустава уменьшилась, но функция сустава полностью не восстановилась (сустав полностью не разгибался). В течение последующего года приступообразные боли и припухлость возникали в разных группах суставов: мелких суставах кистей, стоп, лучезапястных и голеностопных суставах. Тем не менее к врачу пациентка не обращалась, так как у нее наступало улучшение. С 2005 г. она стала отмечать эпизоды повышения АД до 180/100 мм рт.ст., самостоятельно применяла каптоприл.
В 2006 г. пациента обследовалась в клиниках Самарского государственного медицинского университета. К тому времени у нее сформировалась стойкая деформация 2-го пястно-фалангового сустава правой кисти, имел место синовит левого коленного сустава. Уровень МК в крови составил 7,2 мг/дл (430 мкмоль/л).
Пациентке была выполнена диагностическая пункция левого коленного сустава, и в синовиальной жидкости методом поляризационной микроскопии выявлены игловидные кристаллы с двойным лучепреломлением – кристаллы МУН. В результате был поставлен диагноз: подагра, подагрический артрит. Хроническая болезнь почек (ХБП) С1 ст. После этого пациентке впервые был назначен аллопуринол в дозе 100 мг/сут.
С 2006 по 2009 приступы болей в суставах с припухлостью и покраснением возникали у пациентки в пястно-фаланговых, плюснефаланговых, локтевых и коленных суставах с интервалами в 3–5 мес. Неоднократно госпитализировалась в ревматологическое отделение Городского ревматологического центра МСЧ № 12, где получала лечение нестероидными противовоспалительными препаратами (НПВП), бетаметазоном внутрисуставно, аллопуринолом в суточной дозе 100 мг. Уровень МК в этот период был стабильно высоким – 8,4–11,76 мг/дл (500–700 мкмоль/л). Прием аллопуринола в суточной дозе 100 мг больная была вынуждена прерывать в связи с возникновением кожного зуда.
С 2011 г. у пациентки стали появляться уплотнения в толще мягких тканей с желтовато-белесым содержимым (тофусы) в области левого локтевого, пястно-фаланговых и плюснефаланговых суставов. К 2013 г. сформировались анкилозы коленных суставов, и больной последовательно были проведены операции по эндопротезированию этих суставов (в 2013 и 2014 гг.). С 2014 г. при приступах болей в суставах к лечению был добавлен колхицин. С 2017 г. тофусы в области суставов стали изъязвляться, но пациентка к врачу не обращалась.
Значительное ухудшение состояния наблюдалось с июля 2019 г.: у пациентки наблюдались появление язвы по наружной поверхности левой стопы, повышение АД до 230–260/120 мм рт.ст. При этом она продолжала лечиться амбулаторно (колхицин, НПВП). Однако октябре 2019 г. пациентка из поликлиники по месту жительства впервые была направлена в ревматологическое отделение областной больницы ГБУЗ «Самарская областная клиническая больница им. В.Д. Середавина» на стационарное лечение.
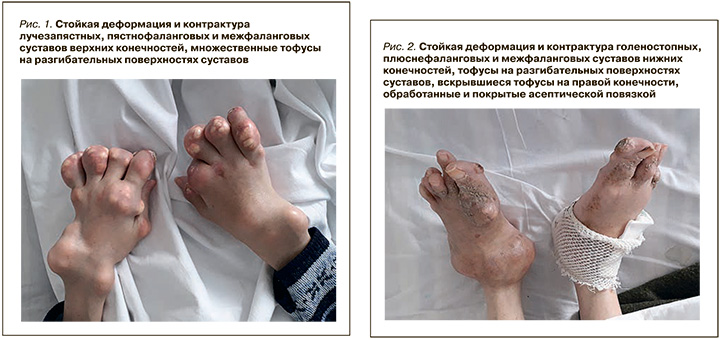
Данные обследования пациентки при поступлении в стационар: объективно состояние ближе к среднетяжелому за счет выраженной локомоторной дисфункции. Рост 150 см, вес 42 кг. Кожные покровы обычной окраски, сухие, с участками шелушения. В области левого локтевого сустава, пястно-фаланговых и плюснефаланговых суставов – множественные тофусы с признаками изъязвлений в прошлом. По наружной поверхности правой голени и левой стопы отмечаются язвенные дефекты размерами 2,5×3 и 2×3 см соответственно. Мускулатура гипотрофичная. Левый локтевой сустав, пястно-фаланговые, плюснефаланговые суставы деформированы и дефигурированы за счет пролиферативных изменений, синовитов и тофусов (рис. 1 и 2). Объем движений в суставах всех групп ограничен: неполное сжатие кистей в кулак (4 см), анкилозы локтевых суставов: разгибание левого до 130 , правого – до 145 , объем движений в голеностопных суставах при сгибании-разгибании стопы слева и справа до 30 и 40 соответственно, эндопротезы коленных суставов. Кифосколиоз. АД 180/100 мм рт. ст.
В общем анализе крови обращало на себя внимание снижение уровня гемоглобина до 97 г/л. В общем анализе мочи – снижение удельного веса 1,007, белок – 0,29 г/л, лейкоциты – 10–15 в поле зрения. У пациентки были выявлены увеличение уровня МК в сыворотке крови до 11,34 мг/ дл (675 мкмоль/л) при норме для женщин менее 6 мг/ дл (360 мкмоль/л), снижение скорости клубочковой фильтрации (СКФ) до 50 мл/ мин/1,73 м2 (CKD-EPI).
На электрокардиограмме определялись признаки гипертрофии левого желудочка.
На рентгенограмме кистей (рис. 3) наблюдались выраженный диффузный остеопороз, сгибательные контрактуры, кистовидные просветления и краевые узуры, подвывихи.
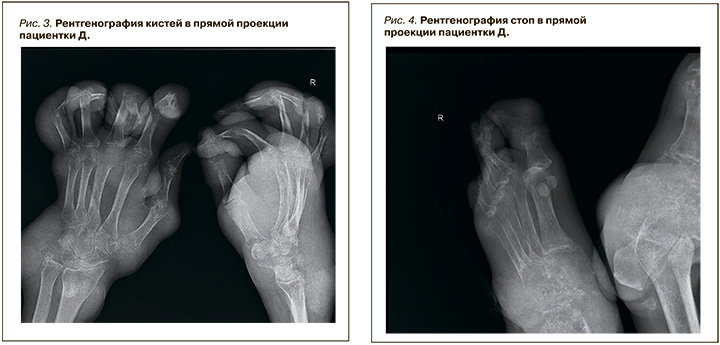
Данные рентгенограммы стоп: диффузный остеопороз, сужение суставных щелей, кистовидные просветления в костях, краевые узуры, вывихи и подвывихи в межфаланговых суставах (рис. 4).
При ультразвуковом исследовании органов брюшной полости были выявлены признаки нефросклероза обеих почек (правая почка 73×28 мм, паренхима 11 мм, левая почка 70×25 мм, паренхима 9 мм).
Данные эхокардиографии: высокой степени гипертрофия левого желудочка с диастолической дисфункцией его по 1-му типу без обструкции выходного тракта с уменьшением его полости, что соответствует гипертензивному сердцу II стадии.
На основании полученных данных был подтвержден следующий клинический диагноз:
- подагра, тофусная форма, стадия обострения. Подагрический артрит. Вторичный остеоартроз. Эндопротезирование коленных суставов (в 2013 г. – левого, в 2014 г. – правого). Функциональная недостаточность (ФН) III;
- хронический тубулоинтерстициальный нефрит смешанного генеза (дисметаболический, лекарственный). ХБП 3А, СКФ 50 мл/мин/1,73 м2 (CKD-EPI). Артериальная гипертензия, II стадия, 3 степень, риск III. Хроническая полифакторная анемия умеренной степени. Лекарственная непереносимость аллопуринола (кожный зуд).
Пациентке было назначено следующее лечение: колхицин в первый день 1,5 мг, затем – по 0,5 мг 2 раза/сут в течение 7 дней; ацеклофенак 100 мг 1 раз/сут; антигипертензивная терапия лозартаном 100 мг/сут, амлодипином 5 мг/сут, моксонидином 0,4 мг/сут. На фоне проводимой терапии состояние пациентки улучшилось: значительно уменьшились болевой синдром и синовиты в суставах, увеличился объем движений в суставах, наметилась тенденция к снижению АД. После купирования острого подагрического процесса с учетом непереносимости аллопуринола больной впервые был назначен фебуксостат 80 мг 1 раз/ сут. На фоне проводимой терапии к моменту выписки уровень МК снизился до 7,97 мг/дл (475 мкмоль/л).
Дальнейшая лечебная тактика у нашей пациентки предполагает постепенное титрование дозы фебуксостата до 120 мг/сут, при этом целевым значением в данном случае следует считать уровень МК в сыворотке крови ниже 5 мг/дл (300 мкмоль/л). Больной рекомендовано контролировать уровень МК в сыворотке крови не реже 1 раза/мес. С целью профилактики обострений суставного синдрома предписано продолжить прием колхицина по 0,5 мг 2 раза/сут длительностью до 6 мес. Также рекомендовано достижение целевых уровней АД менее 130/80 мм рт.ст. с помощью комбинированной антигипертензивной терапии под наблюдением кардиолога.
Имеющиеся на сегодняшний день данные о результатах лечения фебуксостатом позволяют надеяться на стабилизацию состояния нашей пациентки.
ОБСУЖДЕНИЕ
Хорошо известно, что подагра чаще встречается у мужчин, чем у женщин до наступления менопаузы, что связано с эстроген-обусловленным повышением канальцевой экскреции уратов [11]. Средний возраст появления подагры у женщин на 10 лет выше, чем у мужчин [12]. К факторам риска развития подагры у молодых женщин относятся ранняя менопауза или аменорея любого генеза, прием диуретиков (в трети случаев необоснованный) [13, 14], алкоголизм, резкое снижение индекса массы тела, анорексия, злоупотребление слабительными [15], регулярное искусственное провоцирование у себя рвоты в связи с расстройством пищевого поведения [16]. Два последних фактора обусловлены рядом патологических механизмов: во-первых, хроническое обезвоживание вызывает почечную недостаточность и снижает почечный клиренс мочевой кислоты, во-вторых, функциональная гипоталамическая аменорея приводит к уменьшению уровня эстрогенов, которые активируют почечную экскрецию МК.
У наблюдаемой нами пациентки в анамнезе не было ни одного из перечисленных выше факторов, но имеется указание на заболевание тофусной подагрой у матери. По всей видимости, ранний дебют подагрического артрита у молодой женщины обусловлен наследственной предрасположенностью, роль которой подтверждена в крупных исследованиях. Так, в полногеномном ассоциативном исследовании (GWASs) были установлено 10 генов, которые кодируют уратные транспортеры, связанные с сывороточным уровнем МК; мутации этих генов могут повлечь за собой развитие ГУ и подагры. Одна из наибольших корреляций с развитием подагры принадлежит гену ABCG2, анализ репликационных когорт которого подтвердил связь именно ранней подагры с конкретным T-аллелем ABCG2 rs2231142 [17].
Известно, что развитие хронической тофусной подагры зависит главным образом от уровня МК и длительности заболевания, а значит, и от своевременно назначенной уратснижающей терапии. Однако, по данным отечественных ревматологов [18], в реальной клинической практике время от дебюта болезни до постановки диагноза составляет в среднем 6–8 лет. В приведенном нами клиническом случае суставной синдром в дебюте заболевания у молодой женщины не имел каких-либо характерных черт, поэтому диагноз подагрического артрита был верифицирован через 4 года.
Согласно современным представлениям, подагра является «курабельным заболеванием» со стратегией раннего назначения уратснижающих препаратов, среди которых препаратом первого ряда считается аллопуринол [19]. К сожалению, у нашей пациентки назначение аллопуринола не стало переломным моментом в торможении прогрессирования заболевания из-за развития непереносимости этого лекарственного средства в виде появления кожного зуда. Как следствие, лечение пациентки в последующие годы было исключительно симптоматическим, что и привело к развитию тяжелой хронической тофусной подагры с поражением почек. В этой ситуации препаратом второго ряда с подтвержденной эффективностью является фебуксостат, своевременное назначение которого в рассмотренном случае могло предотвратить дальнейшее прогрессирование болезни.
В связи с этим показательны результаты исследования FOCUS, которое показало последовательное стабильное снижение МК под влиянием фебуксостата: в первый год лечения препаратом целевого уровня достигли 78%, на второй год – 76%, на третий и четвертый год – 84 и 90% пациентов с подагрой соответственно. Также у них снизилась потребность в противовоспалительной терапии, сократилась частота обострений в течение первых 2 лет. У 76,9% больных с тофусами на момент включения в исследование через 4 года наблюдалось их полное рассасывание [20]. Кардинальная положительная динамика картины тяжелой, инвалидизирующей подагры была отмечена и в ходе наблюдения отечественными ревматологами пациентов, получавших фебуксостат [21].
Отдельный интерес представляет риск повторных возникновений кожных нежелательных реакций (КНР) у пациентов с подагрой, возникших на фоне аллопуринола, после перехода на прием фебуксостата. В работе Bardin T. et al. был проанализирован 101 пациент с подагрой, которые последовательно получали аллопуринол и фебуксостат [22]. У 22 пациентов КНР первично возникли при использовании аллопуринола. После перехода на фебуксостат только у 9% из них КНР были ассоциированы с приемом фебуксостата. Еще у 2 из 79 пациентов (в 2,5%), леченных аллопуринолом без кожных проявлений, развитие КНР было обусловлено последующим лечением фебуксостатом. Авторы заключили, что риск КНР на фебуксостат представляется умеренно увеличенным у пациентов с КНР на аллопуринол в анамнезе, что не является свидетельством перекрестной непереносимости этих препаратов.
Необходимо добавить, что нежелательные реакции при применении аллопуринола, ограниченные нетяжелыми кожными проявлениями, являются довольно частыми, но исчезают после отмены препарата и не требуют госпитализации. Напротив, тяжелые КНР с системными проявлениями, среди которых наиболее известны синдромы Стивенса–Джонсона, токсический эпидермальный некролиз, лекарственная реакция с эозинофилией и системными симптомами (DRESS-синдром), связаны с высоким риском смертельных исходов. Например, в Тайванском национальном регистровом ретроспективном исследовании, где изучался риск КНР, ассоциированных с приемом аллопуринола и фебуксостата, в общей сложности было выявлено 526 таких реакций. Из них с аллопуринолом было связано 487, тогда как с фебуксостатом – только 39 (частота – 15,37 против 3,48 на 1000 пациенто- лет). Прием аллопуринола ассоциировался с более высоким относительным риском (ОР) возникновения всех КНР в сравнении с фебуксостатом (ОР 5,55): КНР легкого течения (ОР 1,86), тяжелых КНР (ОР 16,75) и фатальных КНР (ОР 16,18) [23].
Говоря об уратснижающей терапии, следует отметить также необходимость эффективного контроля АД, атерогенных форм дислипидемии, принимая во внимание отсутствие абсолютной кардиобезопасности как у фебуксостата, так и аллопуринола [24].
Согласно данным последней версии рекомендаций Американской коллегии ревматологов (ACR) по лечению подагры (2020), у пациентов с изнуряющей, тяжелой хронической тофусной подагрой и низким качеством жизни, у которых невозможно достичь целевого сывороточного уровня МК при назначении любых других доступных лекарственных средств в максимальной терапевтической дозе (включая комбинации), возможно использование пеглотиказы [24]. Пеглотиказа представляет собой продукт пегилированной уриказы, синтезируемый генетически модифицированным штаммом Escherichia coli и стимулирующий окисление МК в аллантоин. Этот препарат может быть рассмотрен при рефрактерности к ингибиторам ксантиноксидазы, урикозурикам и их комбинации. В исследовании Sundy J.S. et al. препарат позволил достичь целевого уровня МК у 42% больных подагрой [25]: такой результат позволяет надеяться, что пеглотиказа после официальной регистрации поможет пациентам с этим заболеванием в нашей стране.
ЗАКЛЮЧЕНИЕ
Особенностью рассмотренного клинического случая была нетипичная клиническая картина артрита в дебюте подагры с вовлечением крупных (левый коленный сустав), а затем мелких суставов верхних конечностей у молодой женщины, с последующим развитием деформаций, обусловивших тяжелое течение болезни и потерю пациенткой трудоспособности. После установления диагноза подагры требуется обязательное назначение гипоурикемических средств, которые должны рассматриваться как наиболее эффективная патогенетическая терапия, улучшающая качество жизни и предотвращающая развитие локомоторной дисфункции, что в конечном счете позволяет снизить риск как общей смертности, так и кардиоваскулярных и церебральных осложнений. Необходим настойчивый подбор уратснижающей терапии при развитии непереносимости одного из назначенных препаратов с титрованием дозы до достижения целевых значений МК.



