ВВЕДЕНИЕ
Во всем мире среди патологий кишечника преобладают заболевания с аутоиммунным типом воспаления – язвенный колит (ЯК), болезнь Крона, осложненные формы которых занимают лидирующие позиции в структуре гастроэнтерологической патологии. К возможным осложнениям неспецифического язвенного колита относится колоректальный рак, зачастую встречающийся у пациентов среднего и молодого возраста. Поэтому своевременная диагностика воспалительных заболеваний кишечника (ВЗК) на латентной стадии – крайне важная и актуальная задача медицинской практики.
Нормальные процессы функционирования кишечника связаны с количественным составом определенных бактерий. Именно динамические изменения родового и видового состава кишечных микроорганизмов, а также их численности служат предикторами развития ВЗК [1, 2]. Существует ряд причин, обусловливающих развитие таких изменений на ранней стадии; среди них особенности формирования кишечной микробиоты, а также преобладание определенных кластеров микроорганизмов с последующим формированием биотипа, определение которых способно диагностировать заболевание на латентной стадии. Эти данные указывают на исследование кишечной флоры как на эффективный способ профилактики развития ЯК, а также предотвращения возникновения тяжелых форм и осложнений, что способно значительно улучшить качество жизни пациентов с данной патологией [3, 4].
Цель исследования – оценка родовидового биоразнообразия кишечной микробиоты у пациентов с ЯК в зависимости от степени его тяжести.
МАТЕРИАЛ И МЕТОДЫ
Выполнено 16s-РНК-секвенирование микробиома кишечника у 20 пациентов с подтвержденным (по результатам колоноскопии с прицельной биопсией) ЯК и у 20 соматически здоровых человек, сформировавших контрольную группу. Средний возраст обследуемых пациентов составил 42±3,5 лет.
У пациентов обеих групп было проведено исследование показателей общего (лейкоциты, лимфоциты, моноциты, скорость оседания эритроцитов) и биохимического (С-реактивный белок) анализа крови. Для последующей оценки биоразнообразия кишечной микробиоты (методом 16-S РНК секвенирования) был выполнен забор материала (кала) в стерильную емкость. Исследование проводилось согласно протоколу с помощью секвенатора (Zymo Research, Лос-Анджелес, Калифорния). Область V3 гена 16-S РНК была выбрана для подготовки библиотеки и дальнейшего секвенирования с использованием платформы Ion Torrent PGM, универсальных праймеров 337-F (50-GACTCC-TAC-GGG-AGG-CWG-CAG-30) и 518-R (50-GTA-TTA-CCG-CGG-CTG-CTG-30) и набора 5X Screen Mix-HS Master Mix Kit (Россия). После этого продукты ПЦР очищали с использованием магнитных частиц и приступали непосредственно к приготовлению библиотек для секвенирования. Далее осуществлялась статистическая обработка полученных данных методом прямого моделирования при помощи программ Microsoft Excel, Statistics.
РЕЗУЛЬТАТЫ
Среди пациентов с ЯК с учетом показателей индекса Мейо, отражающего степень тяжести патологии (количество дефекаций, наличие крови в стуле, состояние слизистой оболочки кишечника, общее состояние пациента), в 45% случаев имела место средняя (Индекс Мейо – 2 балла), в 25% – легкая (0,5 баллов) и в 40% – тяжелая (4 балла) степень заболевания. Исследуемые лабораторные показатели (лейкоцитарная формула, С-реактивный белок) участников из обеих групп исследования представлены в таблице 1. Отметим, что у пациентов с ЯК по сравнению с контрольной группой наблюдалось значимое увеличение лейкоцитов (11,4±0,68 г/л), с преобладанием нейтрофилов (74±2,1%), С-реактивного белка (9,6±1,5 мг/л).
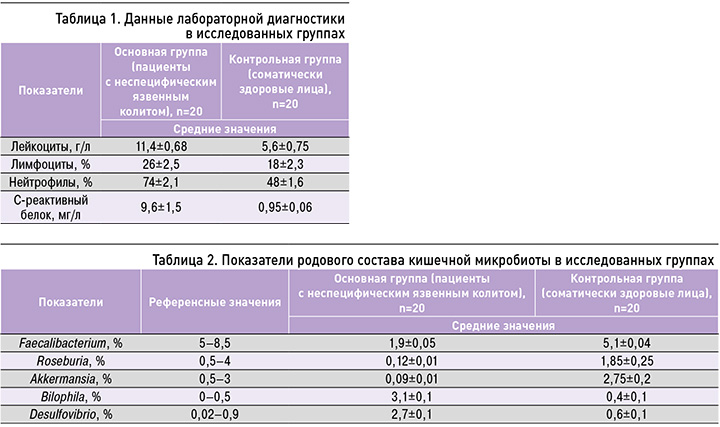
В результате секвенирования микробиома кишечника у пациентов с ЯК было выявлено значительное снижение показателей пробиотических штаммов бактерий – отсутствие или крайне низкое содержание (<0,02%) Bifidobacteium, Lactobacterium. Также у пациентов с ЯК было установлено снижение доли основных представителей нормальной микрофлоры кишечника по сравнению с контролем (табл. 2).
Стоит отметить низкие значения основных представителей кишечной микробиоты – Bacteroides, Faecalibacterium у пациентов с ЯК. Эти типы бактерий поддерживают нормальное функционирование кишечника, моделируют его функции, способствуют усвоению питательных веществ, диверсифицируют кишечную микробиоту.
Также среди исследуемых с подтвержденным диагнозом ЯК отмечалось увеличение показателей патогенных бактерий: Fusobacterium – 0,2±0,1% (при референтном значении 0–0,02%); Escherichia coli – 5,4±0,26% (0,01–1,0%); Campylobacter – 2,6±0,15% (0–0,02%); Clostridium sensu stricto – 3,4±0,62% (0–0,02%). Увеличение процентного содержания данных бактерий может свидетельствовать о повышенной выработке активных метаболитов, подавлении роста колоний микроорганизмов, представляющих нормальную микрофлору кишечника, и обусловленных этим нарушениях защитного и слизистого барьеров. Отдельного внимания заслуживает увеличение у пациентов с ЯК кластера сульфатредуцирующих бактерий (Bilophila – 3,1±0,1%, Desulfovibrio – 2,7±0,1%), что может определять тяжесть аутоиммунного воспаления вследствие массивной выработки ими активных метаболитов.
ОБСУЖДЕНИЕ
Бактерии нормофлоры (Bacteroides, Faecalibacterium) сдерживают колонизацию желудочно-кишечного тракта патогенами, способствуют формированию зрелой иммунной системы, правильному развитию иммунной толерантности. Эти бактерии помогают организму эффективно использовать питательные вещества, одновременно создавая условия для нормального функционирования других бактерий. В многочисленных исследованиях сообщалось о связи между ВЗК и нарушением баланса флоры Bacteroides. Низкий уровень этих представителей кишечной микробиоты может быть ассоциирован с развитием хронического воспаления, которое наблюдается у пациентов с ЯК [5]. Барьерная функция кишечника, особенно роль плотных межэпителиальных контактов, является важнейшей частью общей функции желудочно-кишечного тракта. Увеличение кишечной проницаемости служит патогенетическим механизмом, лежащим в основе аутоиммунных и воспалительных состояний. Определение повышенных значений патогенного кластера бактерий связано с их активностью и наличием множества дополнительных пангеномных последовательностей с факторами вирулентности, включая 44 аутотранспортера (система секреции V типа) и 13 адгезии, участвующих в потенциальном воспалении слизистой оболочки кишечника. Действительно, анализ транскриптома позволил установить, что такие специфичные дополнительные гены, как множественные T5SS, демонстрируют заметно повышенную экспрессию. Это означает, что рост числа данных бактерий может усиливать экспрессию потенциальных факторов вирулентности. Данный процесс приводит к повышенной выживаемости патогенов против других кишечных микроорганизмов и высокому риску поражения эпителия кишечника. При ЯК в развитии хронического воспаления участвуют клетки Th2 и Th17 с вовлечением интерлейкинов (ИЛ) различных типов. Ключевую роль во взаимодействии с кишечной микробиотой с целью поддержания гомеостаза и обеспечения защитных функций кишечного барьера, а также в регуляции адаптивного иммунитета и баланса Th17/Treg может играть ИЛ-33. При этом сигнальная ось ИЛ-33/ST2 (через индукцию ИЛ-4-зависимого иммунного ответа) вовлечена в развитие ВЗК, в том числе при ЯК: в активной фазе этих заболеваний растворимый стимулирующий фактор роста, экспрессируемый геном 2 (sST2), секретируется провоспалительными T-клетками кишечника, а количество защитных ST2 – экспрессирующих Treg, значимо уменьшается. Известно, что метаболиты сульфатредуцирующих бактерий способны напрямую воздействовать на этот механизм, что может определять тяжесть аутоиммунного воспаления в активной фазе заболевания, когда уже происходит образование язвенных дефектов в слизистой оболочке кишечника [6, 7].
ЗАКЛЮЧЕНИЕ
В проведенном исследовании было выявлено достоверное снижение показателей нормальной микрофлоры кишечника, а также значительное увеличение патогенного кластера бактерий у пациентов с ЯК. Установлено значимое уменьшение биоразнообразия кишечной микробиоты в группе пациентов с ЯК относительно группы контроля. При этом указанные изменения наблюдались у 15% пациентов на ранней стадии основного заболевания, что может служить новым диагностическим критерием для определения прогноза течения, а также фактором своевременной коррекции симптомов ЯК и улучшения качества жизни каждого конкретного пациента.



