По данным отечественного эпидемиологического исследования ЭССЕ-РФ, распространенность артериальной гипертензии (АГ) в нашей стране составляет 44%, а в отдельных регионах достигает 47%. По-прежнему частота достижения в России целевых значений артериального давления (АД) оставляет желать лучшего, составляя всего лишь 23% [1].
АГ является одним из основных компонентов метаболического синдрома (МС) наравне с абдоминальнм ожирением, нарушениями углеводного и липидного обмена. Наличие метаболических нарушений у больных АГ утяжеляет ее течение и уменьшает вероятность достижения контроля АД. Коморбидность АГ и МС неуклонно растет. Результаты исследования HealthSearchDatabase показали, что 40% больных АГ имеют 3 фактора сердечно-сосудистого риска, что значимо увеличивает вероятность преждевременной инвалидизации и смерти от кардиоваскулярных осложнений [2, 3].
Согласно проведенному метаанализу, в который вошли 19 международных контролируемых клинических исследований с участием более 44 тыс. больных, опубликованному в 2015 г., необходимо более жестко снижать АД, особенно у больных АГ с высоким риском сердечно-сосудистых осложнений [4]. В связи с вышеизложенным, коррекция АГ у пациентов с МС является одной из приоритетных задач ведения данной категории больных.
Установлено, что абдоминальное ожирение вносит значимый вклад в развитие и прогрессирование АГ через сложный каскад патологических реакций, среди которых ведущую роль играют инсулинорезистентность и гиперинсулинемия.
В развитии АГ весьма важную роль играет активация ренин-ангиотензин-альдостероновой системы (РААС), поэтому больным логично назначать препараты, блокирующие ее активность.
Фармакологическая блокада РААС обеспечивает не только антигипертензивное действие, но и эффекты, направленные на подавление инсулинорезистентности и улучшение метаболизма глюкозы. Повышение чувствительности к инсулину на клеточном уровне вследствие блокады РААС ассоциировано с увеличением активности белка-переносчика глюкозы (GLUT-4), который является ключевым энзимом метаболизма глюкозы в скелетных мышцах у лиц с ожирением [5, 6]. Предполагается, что лекарственное воздействие на активность тканевой РААС может усилить эффекты инсулина за счет подавления ингибиторных свойств ангиотензина II в отношении фосфатидилинозитол-3-киназы и протеинкиназы В. Ангиотензин II совместно с гиперинсулинемией и повышенным уровнем инсулиноподобного фактора роста оказывает мощное ремоделирующее действие на органы-мишени. Ингибиторы ангиотензинпревращающего фермента (ИАПФ) и блокаторы рецепторов ангиотензина II (БРА) подавляют эти неблагоприятные эффекты и тем самым улучшают метаболический статус и функциональное состояние сосудов [7–9].
У пациентов с АГ и хронической болезнью почек (ХБП) в качестве препаратов первой линии или основного компонента комбинированной антигипертенезивной терапии рекомендуется назначение ИАПФ или БРА [2, 3]. Данные группы препаратов обладают не только системным антигипертензивным действием, но и рядом локальных ренопротективных эффектов как за счет торможения продукции медиаторов почечного повреждения на уровне клубочков, канальцев и интерстиция, так и в результате снижения внутриклубочковой гипертензии. Поэтому ИАПФ или БРА рекомендуется назначать больным ХБП c индексами альбуминурии/протеинурии А2-А3 при отсутствии АГ. Это связано со способностью данных препаратов уменьшать альбуминурию/протеинурию и препятствовать развитию АГ за счет почечных механизмов [10]. По данным проспективных контролируемых исследований, у пациентов с диабетической и недиабетическими нефропатиями они достоверно снижают риск развития терминальной почечной недостаточности. Антипротеинурические и ренопротективные свойства ИАПФ и БРА проявляются на разных стадиях ХБП. Важно подчеркнуть, что максимальный нефропротективный эффект терапии этими препаратами у больных диабетической нефропатией и АГ развивается в случае достижения целевого уровня АД. Дозы ИАПФ и БРА, необходимые для достижения антипротеинурического действия, выше доз, вызывающих снижение АД. Оптимальная доза определяется путем титрации с учетом уровня альбуминурии/протеинурии и может достигать максимальной.
БЛОКАТОРЫ РЕЦЕПТОРОВ АНГИОТЕНЗИНА пРИ МС
БРА, наряду с ИАПФ, относятся к препаратам выбора для лечения АГ в сочетании с МС. Они подавляют активность РААС на тканевом уровне, на уровне специфических рецепторов ангиотензина II и не влияют на систему брадикинина. Хорошо изучены функции трех типов указанных рецепторов АII, посредством которых реализуются различные процессы в клетках. В сосудах, сердце, почках и коре надпочечников расположены АТ1-рецепторы, активация которых приводит к вазоконстрикции, пролиферации клеток, увеличению выработки альдостерона и катехоламинов, задержке натрия и воды, увеличению синтеза эндотелина-1. С другой стороны, активация АТ2-рецепторов способствует вазодилатации, антипролиферации клеток, увеличению выработки оксида азота и натрийурезу. Ингибирование активатора плазминогена 1 обусловлено воздействием на АТ4-рецепторы [11].
 Первый БРА саралазин был синтезирован в 1969 г. Препарат не получил широкого практического применения из-за наличия у него агонистических свойств и парентеральной формы введения. В 1995 г. на фармацевтическом рынке появился лозартан. В дальнейшем были созданы другие непептидные БРА – валсартан, ирбесартан, кандесартан, телмисартан, эпросартан и олмесартан. Лозартан и кандесартан являются пролекарствами и действуют через свои активные метаболиты, образующиеся в печени, остальные препараты являются непосредственно активными формами. По характеру взаимодействия с рецептором ангиотензина II различают конкурентные и неконкурентные БРА. Конкурентные БРА (лозартан и эпросартан) при повышении уровня ангиотензина II могут вытесняться из мест связывания с АТ1-рецепторами, а неконкурентные (ирбесартан, кандесартан, телмисартан, олмесартан) связываются с ними необратимо. Валсартан и ирбесартан являются частично конкурентными ингибиторами БРА. Различия между конкурентными и неконкурентными антагонистами зависят от длительности связывания с рецептором [12]. Классификация сартанов, зарегистрированных в России, по химической структуре представлена ниже.
Первый БРА саралазин был синтезирован в 1969 г. Препарат не получил широкого практического применения из-за наличия у него агонистических свойств и парентеральной формы введения. В 1995 г. на фармацевтическом рынке появился лозартан. В дальнейшем были созданы другие непептидные БРА – валсартан, ирбесартан, кандесартан, телмисартан, эпросартан и олмесартан. Лозартан и кандесартан являются пролекарствами и действуют через свои активные метаболиты, образующиеся в печени, остальные препараты являются непосредственно активными формами. По характеру взаимодействия с рецептором ангиотензина II различают конкурентные и неконкурентные БРА. Конкурентные БРА (лозартан и эпросартан) при повышении уровня ангиотензина II могут вытесняться из мест связывания с АТ1-рецепторами, а неконкурентные (ирбесартан, кандесартан, телмисартан, олмесартан) связываются с ними необратимо. Валсартан и ирбесартан являются частично конкурентными ингибиторами БРА. Различия между конкурентными и неконкурентными антагонистами зависят от длительности связывания с рецептором [12]. Классификация сартанов, зарегистрированных в России, по химической структуре представлена ниже.
- Гетероциклические:
- бефениловые тетразолы:
- олмесартан (Кардосал);
- лозартан (Козаар);
- кандесартан (Атаканд);
- ирбесартан (Апровель).
- небефиниловые тетразолы:
- телмисартан (Микардис).
- небифениловые нететразолы:
- эпросартан (Теветен);
- азилсартан (Эдарби).
- бефениловые тетразолы:
- Негетероциклические:
- валсартан (Диован).
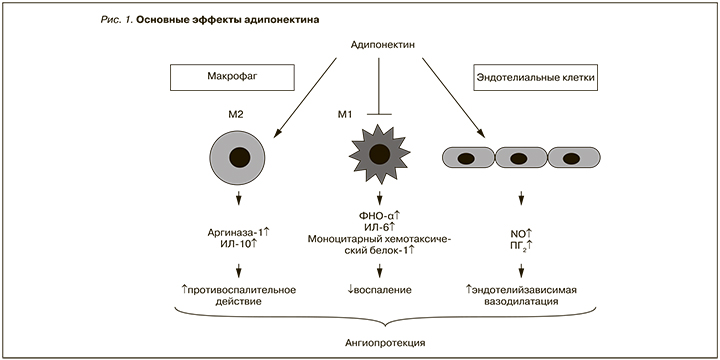
БРА не уступают ИАПФ по антигипертензивной эффективности, однако у них отсутствует «ускользание» гипотензивного действия, и они имеют лучший профиль переносимости. При использовании БРА, избирательно блокирующих АТ1-рецепторы, изменяется процесс дифференцировки преадипоцитов. Они переходят в «малые» адипоциты с высокой степенью дифференцировки, которые способны синтезировать значительные количества адипонектина, повышающего чувствительность тканей к инсулину и улучшающего эндотелиальную функцию (рис. 1) [13, 14].
БРА обладают выраженным кардионефро-ангиопротективным действием: предотвращают гипертрофию левого желудочка, уменьшают степень протеинурии и толщину интимы-медиа сонных артерий, замедляют прогрессирование сердечной и почечной недостаточности. Одним из значимых механизмов действия БРА является модуляция активности рецепторов, активируемых пролифераторами пероксисом (peroxisome proliferator-activated receptors – PPAR), которые участвуют в метаболизме глюкозы, липидов и регулировании уровня АД. В эксперименте показано, что стимуляция PPAR приводит к пролиферации пероксисом. PPAR относятся к ядерным гормональным рецепторам и при их активации лигандами регулируют транскрипцию генов. Выделяют три типа PPAR – PPAR-α, PPAR-β и PPAR-γ с разной локализацией в различных органах и тканях:PPAR-α наиболее распространены в печени, менее часто встречаются в скелетных мышцах и кардиомиоцитах; PPAR-β представлены во всех тканях организма; PPAR-γ наиболее распространены в белой и бурой жировой ткани, также встречаются в макрофагах и сосудистой стенке. PPAR-γ – наиболее активно изучаемая рецепторная субпопуляция. Лиганды PPAR-γ могут быть использованы для лечения таких заболеваний, как атеросклероз, сахарный диабет (СД), онкологические заболевания. PPAR-γ экспрессируется в двух изоформах, отличающихся по N-концевому участку. PPAR-γ2 в больших количествах обнаруживается в различных типах жировой ткани, в то время как PPAR-γ1 встречается в клетках кишечника, мозга, сосудов, а также иммунной системы [15]. Основная функция PPAR-γ заключается в контроле обмена жирных кислот. Они участвуют в регуляции липидного и углеводного обмена, чувствительности тканей к глюкозе, процессов воспаления, функции эндотелия. PPAR-γ перераспределяют свободные жирные кислоты из мышц и печени в периферическую жировую ткань, их активация способствуют дифференцировке адипоцитов, апоптозу крупных адипоцитов, повышению синтеза адипонектина. На фоне стимуляции PPAR-γ происходит уменьшение выработки фактора некроза опухоли α, высвобождение резистина из жирового депо, снижение инсулинорезистентности (повышение поглощения глюкозы скелетными мышцами и печенью), подавление глюконеогенеза. Данные эффекты клинически проявляются снижением АД, уровня глюкозы, инсулина и триглицеридов в крови. Кроме того, активация PPAR-γ ведет к противовоспалительным эффектам в виде снижения продукции провоспалительных цитокинов, молекул клеточной адгезии, фактора роста фибробластов. Препараты, обладающие свойствами агонистов ядерных PPAR-γ клеток жировой, мышечной тканей и гепатоцитов, уменьшают инсулинорезистентность, причем данный эффект сопоставим с действием пероральных гипогликемических препаратов [16–18]. Одной из групп лекарственных средств, влияющих на PPAR-γ, являются БРА. Вызываемая некоторыми представителями этой группы селективная блокада АТ1-рецепторов сопровождается последующей стимуляцией АТ2-рецепторов и PPAR-γ. Также БРА могут непосредственно связываться с PPAR-γ, активируя продукцию инсулиночувствительного протеина.
На основании результатов проведенных исследований был сделан вывод, что не все БРА одинаково воздействуют на PPAR-γ [17–18]. Так, на фоне приема ирбесартана и телмисартана активность транскрипции гена PPAR-γ достоверно повышалась в 3,4±0,9 и 2,6±0,6 раза, причем данный эффект был сходен с влиянием сахароснижающего препарата пиоглитазона, повышавшего данный показатель в 5,2±1,1 раза. Концентрация, обеспечивающая 50% уровень активности рецептора PPAR-γ, составляет для лозартана >50 мкмоль/л, для ирбесартана – 26,97 мкмоль/л, для телмисартана – 5,02 мкмоль/л, для пиоглитазона – 0,2 мкмоль/л.
В экспериментальном исследовании ирбесартан и телмисартан активировали PPAR-γ на клетках PC12W, не экспрессирующих АТ1-рецепторы. Было высказано предположение, что стимуляция PPAR-γ под воздействием БРА не связана с блокадой АТ1-рецепторов [18].
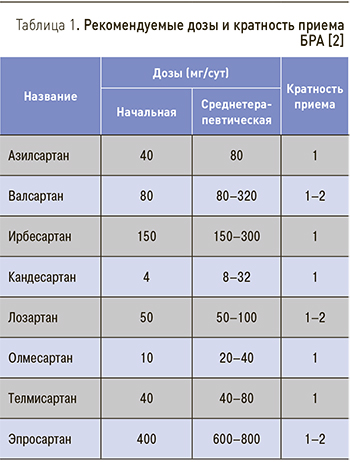
БРА отнесены к антигипертензивным препаратам первого ряда для лечения больных АГ, в том числе в сочетании с МС, благодаря высокой эффективности и отличной переносимости при длительном применении [2, 4]. Рекомендуемые дозы БРА и кратность их приема представлены в табл. 1.
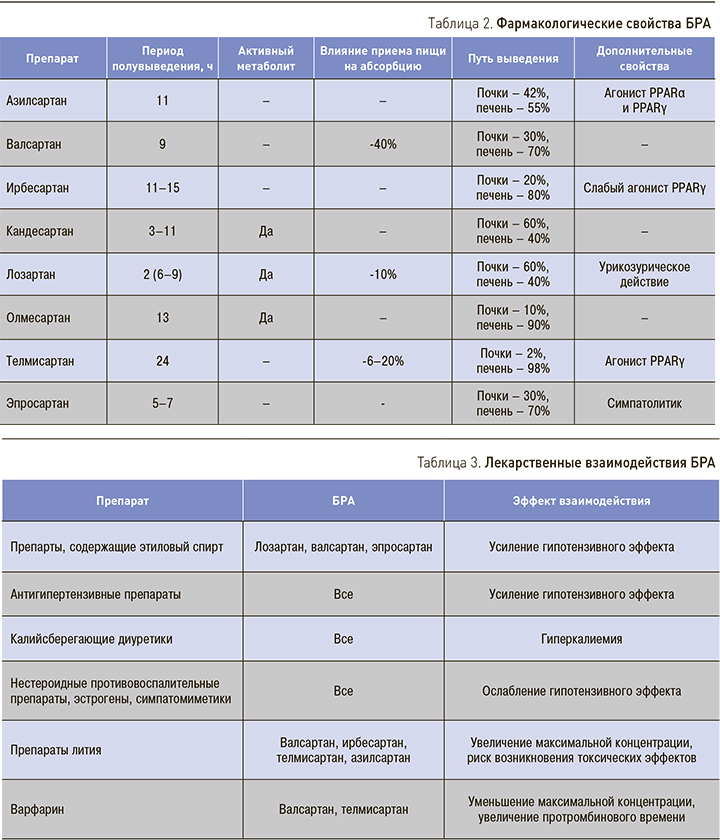
БРА не имеют дозозависимых побочных эффектов, что позволяет уже на начальном этапе лечения использовать средние или даже максимальные рекомендованные дозы без развития гипотонии. Прекращение приема БРАне вызывает развития синдрома отмены. Еще одним преимуществом БРА является отсутствие необходимости коррекции дозы при снижении скорости клубочковой фильтрации. Основные фармакодинамические свойства БРА представлены в табл. 2, лекарственные взаимодействия – в табл. 3.
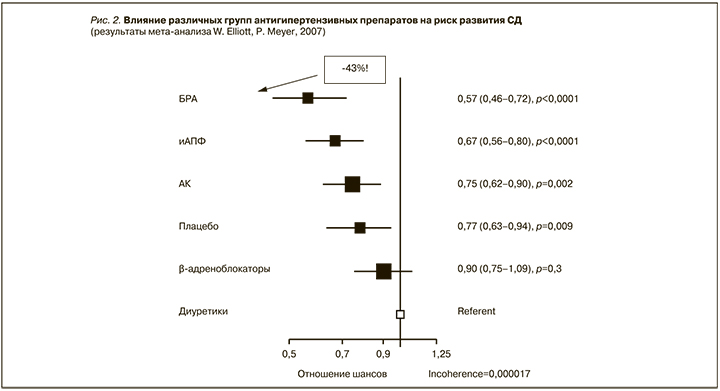
Сартаны не только эффективно снижают АД, но и, что важно в популяции больных МС, благоприятно влияют на углеводный обмен и течение СД. Доказано, что длительный прием БРА достоверно снижает риск развития СД (исследования LIVE, VALUE, CHARM, ALPIN) [19–26].Метаанализ 22 исследований, в которых участвовали 143 153 пациента, показал, что БРА в большей степени уменьшают вероятность развития новых случаев СД в сравнении с другими группами антигипертензивных препаратов (рис. 2) [27].
Кроме того, назначение БРА больных АГ с СД приводит к значимому снижению частоты развития сердечно-сосудистых осложнений (LIFE, IDNT, RENAAL) [19, 28, 29]. В рекомендациях Американского общества гипертензии (American Society of Hypertension) и Международного общества по изучению гипертензии (International Society of Hypertension) 2014 г. БРА (сартаны) отнесены кантигипертензивным препаратам первого ряда, которые в силу лучшей переносимости подходят для длительного применения. В США и Европе за последние годы частота применения сартанов увеличилась в 2 раза. Внашей стране частота использования сартанов возросла в 10 раз.
Таким образом, применение БРА для лечения АГ у больных с метаболическими нарушениями патогенетически обосновано. Несмотря на принадлежность к одному классу лекарственных средств, отдельные представители этой группы имеют свои особенности, определяющие их дополнительные свойства.



