ВВЕДЕНИЕ
Под антибиотик-ассоциированной диареей (ААД) понимают ≥3 эпизодов неоформленного стула в течение ≥2 последовательных дней на фоне приема антибактериальных препаратов (или в течение 4 нед после их отмены) [1].
Частота случаев ААД у взрослых колеблется от 7–33/100 у стационарных больных до всего лишь 2,5/100 000 человеко-лет у взрослых амбулаторных пациентов или смешанных стационарных и амбулаторных пациентов, получающих антибиотики (АБ) [2]. Стационарное лечение относят к существенному фактору риска развития ААД. Elseviers M.M. et al. (2015) при обследовании госпитализированных больных диагностировали ААД у 9,6%, в том числе у 4 пациентов была подтверждена инфекция Clostridium difficile (C. difficile). Авторы отмечают, что наиболее часто заболевание развивалось среди больных нефрологических (18,8%) и гериатрических (14,3%) отделений. Еще один фактор риска ААД – возраст госпитализированных больных. Так, у пациентов младше 65 лет ААД развивалась в 5,9%, 65–84 лет – в 11,3%, а в возрасте старше 85 лет – в 12,8% случаев. Вероятность формирования ААД значительно увеличивалась при использовании более одного АБ (ОШ 2,27; 95% ДИ: 1,30–3,98) и при приеме ингибиторов протонной помпы (ОШ 1,98; 95% ДИ: 1,15–3,43) [3]. Схожие результаты были получены в исследовании Я.Н. Ярушина с соавт. (2017) на российской популяции. К предикторам риска развития диареи, ассоциированной с C. difficile, помимо возраста, стационарного лечения и коморбидности, авторы отнесли анемию (ОШ 4,35; 95% ДИ: 1,98–9,54; р=0,0003), госпитализацию в ОРИТ длительностью более 1 сут (ОШ 10,59; 95% ДИ: 2,35–47,69; р=0,0002), оперативное вмешательство (ОШ=3,06; 95% ДИ 1,33–7,04; р=0,0120), проведение хронического диализа при хронической почечной недостаточности (ОШ=8,56; 95% ДИ: 1,05–69,69; р=0,0210) [4].
Вид АБ играет значительную роль в формировании ААД. Наиболее часто диарея развивалась при применении цефалоспоринов и пенициллинов [5]. Использование цефтриаксона увеличивало шансы появления диареи в 3,21 раза (ОШ 3,21; 95% ДИ: 1,51–6,82; р=0,0036) [4]. Многомерный регрессионный анализ, выполненный Litao G. et al. в 2018 г., подтверждает это положение: риск развития ААД при использовании АБ – ингибиторов ферментов возрастал практически в 2 раза (ОШ 1,889; 95% ДИ: 1,044–3,420; р=0,016) [6].
Существует несколько механизмов формирования диареи на фоне применения АБ.
1. Фармакологические эффекты собственно АБ. Препараты, содержащие клавулановую кислоту, усиливают перистальтику. Макролиды стимулируют мотилиновые рецепторы кишки, цефтриаксон и цефоперазон приводят к билиарной недостаточности, мальдигестии и также стимулируют перистальтику.
2. Развитие осмотической диареи в результате нарушения метаболизма желчных кислот и углеводов в кишечнике. На фоне применения АБ снижается количество анаэробов в кишечнике, что меняет метаболическую функцию микрофлоры. Нарушается расщепление и всасывание углеводов, синтез короткоцепочечных жирных кислот, деконъюгация желчных кислот. Это вызывает снижение абсорбции воды и электролитов. Увеличивается количество первичных желчных кислот, усиливается секреция воды в кишечнике. Для осмотической диареи характерен обильный, неоформленный стул до 3–4 раз/сут с непереваренными остатками пищи. Такая диарея купируется при голодании [7].
3. Инфекционная диарея при изменении состава микробиоты в кишечнике. Снижение колонизационной резистентности влечет за собой ослабление конкуренции с патогенами за рецепторы слизистой оболочки (СО) кишечника и снижение местного иммунитета. Усиливается рост патогенной флоры, токсины которой повреждают СО. Наиболее распространенные возбудители инфекционной ААД – C. difficile, C. perfringers, K. oxytoca и S. aureus. Результаты систематического обзора и метаанализа, опубликованного в 2021 г., свидетельствуют, что встречаемость C. difficile среди больных с ААД составляет 19,6% (95% ДИ: 15,1–25,1), C. perfringers – 14,9% (95% ДИ: 10,6–20,6), K. oxytoca – 27,0% (95% ДИ: 8,2–60,3), S. aureus – 5,2% (95% ДИ: 0,4–43,1). Распространенность всех этих четырех бактерий оказалась выше в Европе по сравнению с другими континентами [8].
ОСОБЕННОСТИ ААД РАЗЛИЧНОЙ ЭТИОЛОГИИ
Повреждающее действие C. difficile на эпителий толстой кишки обусловлено вырабатываемыми ей токсинами А (энтеротоксин) и В (цитотоксин). Возбудитель может передаваться от других пациентов, медперсоналом, через перчатки, кольца и т.д. Возбудитель уничтожается хлоргексидином, но устойчив к антисептикам, содержащим алкоголь. Вегетирующие формы C. difficile погибают под воздействием желудочного сока при рН 1–3,5 и выживают при рН >4. При низких значениях рН споры C. difficile не гибнут [9, 10].
Заболеваемость C. difficile-ассоциированной диареей у взрослых оценивается от 1–11/10 000 у амбулаторных пациентов до 4,3–131/10 000 у стационарных больных. Отмечается высокая распространенность C. difficile у новорожденных. До 67% новорожденных, доставленных в больницы, могут быть колонизированы бактерией, однако диарея у них возникает редко. Считается, что это связано с отсутствием в их толстой кишке рецепторов к токсину C. difficile или наличием материнских антител к токсинам А и B в грудном молоке. Симптоматическое заболевание у детей достигает пика в возрасте 4–5 лет [2].
Выделяют легкое/умеренное, тяжелое и осложненное течение C. difficile-ассоциированной болезни [11]. В первом случае наблюдается неоформленный стул ≥3 раз/сут в сочетании с болью в животе. Тяжелое течение заболевания характеризуется водянистой диареей с кровью, формированием гипоальбуминемии <30 г/л в сочетании с лейкоцитозом >15×109/л или болезненностью при пальпации живота. Наконец, осложненное заболевание диагностируется при наличии гипотензии, лихорадки ≥38,5 °С, илеуса, изменения сознания, лейкоцитоза >25×109/л, лейкопении <2×109/л или поражении других органов (легких, почек и т.д.). Для клостридиальной инфекции характерно рецидивирование процесса менее чем через 8 нед после окончания терапии [11].
К тяжелым проявлениям болезни относится формирование псевдомембранозного колита преимущественно в прямой и дистальных отделах ободочной кишки. При эндоскопическом исследовании СО имеет вид «вулканического поражения», появляются возвышающиеся узелки белесоватого или желтоватого цвета 2–10 мм в диаметре с ободком воспаления. Формируется особый морфологический субстрат заболевания – псевдомембраны, состоящие из фибрина, слизи, некротизированных эпителиальных клеток и лейкоцитов. Морфологическое исследование демонстрирует субэпителиальный отек с круглоклеточной инфильтрацией собственной пластинки СО, капиллярные стазы с выходом эритроцитов за пределы сосудов. Эпителиальный слой при этом приподнимается и местами отсутствует [9, 10].
Инфицированность C. perfingens среди всех пациентов с ААД составляет 2–15% (в среднем 14,9%) [8]. Бактерия является возбудителем пищевых отравлений, газовой гангрены. C. perfringens классифицируются на 7 типов, от А до G, на основе их способности продуцировать 6 основных токсинов. C. perfringens энтеротоксин (CPE) – положительный токсинотип А (в настоящее время называется «C. perfringens штамм типа F»), считающийся наиболее важным возбудителем ААД. Связываясь с эпителиальными клетками кишечника и попадая в клеточную мембрану, он изменяет ее проницаемость, способствует потере жидкости и ионов, что в конечном итоге проявляется диареей [12]. C. perfringens не приводит к образованию псевдомембран в кишке.
Общая распространенность K. oxytoca при ААД составляет 27,0% (95% ДИ: 8,2–60,3) [8]. Для клинической картины ААД, ассоциированной с K. oxytoca, типичны абдоминальные боли по типу кишечной колики, тенезмы, водянистый стул >10–15 раз/сут с примесью крови, лихорадка до 38,5 °С. Этот вид ААД в основном наблюдается у молодых и амбулаторных лиц после короткого лечения АБ из группы пенициллинов [13]. K. oxytoca выступает причиной геморрагического колита, впервые описанного в 1978 г. Недавно был выделен цитотоксин, который вызывает гибель клеток [14]. Для колита, обусловленного K. оxytoca, характерно правостороннее фрагментарное поражение ободочной кишки, сопровождающееся выраженным воспалением со сливающимися эрозиями и кровоизлияниями [8].
Штаммы S. aureus, продуцирующие энтеротоксин, могут вызывать диарею на фоне применения антибиотиков, при этом они устойчивы к метициллину [15]. Общая распространенность S. aureus у пациентов с ААД достигает 5,2% (95% ДИ: 0,4– 43,1). Клинические особенности ААД, обусловленной S. aureus, включают быстрое начало заболевания в течение 6–12 ч, учащение стула до 5–7 раз/ сут, иногда с примесью крови и слизи, боли в животе без четкой локализации, повышение температуры тела не выше 37,5 °С. Ассоциированный с AAД метициллинрезистентный S. аureus обнаруживают в крови некоторых пациентов, что делает колит вероятным источником сепсиса [8].
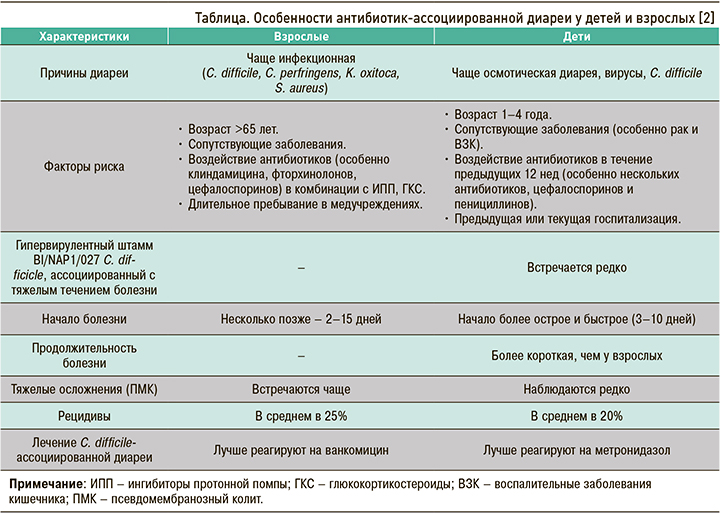
Развитие и течение ААД имеют некоторые особенности в зависимости от возраста, которые суммированы в таблице.
ААД И COVID-19
В современных реалиях диарея стала еще более актуальной проблемой в связи с ростом заболеваемости в условиях пандемии COVID-19. Установлено, что SARS-CoV-2 в кишечнике может изменять абсорбцию триптофана через АПФ2, приводя к снижению содержания антимикробного пептида и изменяя кишечную микробиоту. У пациентов с COVID-19 было вывлено снижение лакто- и бифидобактерий в кишечнике [16]. На этом фоне широкое применение АБ для лечения коронавирусной инфекции приводило к еще более существенному изменению кишечного микробиома с увеличением количества условно-патогенных микроорганизмов.
Наиболее распространенным возбудителем тяжелой ААД стал C. difficile. По данным Dong Z. et al. (2021), частота обнаружения бактерии составила 20,2% [17]. Maslennikov R. et al. (2021) на основе анализа 981 случая диареи у пациентов с COVID- 19 выделили раннюю и позднюю диарею. Ранняя диарея обусловлена действием SARS-CoV-2; она не влияла на смертность, и ее невозможно предотвратить. Для такой диареи характерно появление не позднее 5 дней от начала болезни, длительность ее в среднем составляет 5 (3–7) дней, C. difficile при этом отсутствует. Поздняя диарея формировалась после 5 дней от начала болезни (в среднем на 15-й день), длилась 6 (4–10) дней и в 70,5% случаев была ассоциирована C. difficile на фоне применения АБ. Факторами риска развития такой диареи стали применение амоксициллина/клавуланата (ОШ=2,23), перорального кларитромицина (ОШ=3,79), ГКС (ОШ=4,41). Поздняя диарея увеличивала риск смерти после 20 дней болезни в 4,7 раз. Критерием, предсказывающим формирование поздней диареи в ближайшие дни, было увеличение количества нейтрофилов >0,6×109/л (чувствительность 82%, специфичность 70,8%) [18].
ЛЕЧЕНИЕ И ПРОФИЛАКТИКА ААД
Лечение ААД предполагает отмену АБ, послужившего причиной диареи, если это возможно, а также изменение пищевого рациона. Для профилактики осмотической диареи рекомендуется избегать продуктов с большим количеством углеводов. В рамках медикаментозного лечения проводится оральная и внутривенная регидратация, рекомендуется прием энтеросорбентов.
Для этиологической терапии C. difficile-ассоциированной диареи используется метронидазол 500 мг 3 раза/сут перорально в течение 10 дней при легком/средней тяжести течения болезни. Если к 5–7-му дню терапии нет улучшения, показана смена метронидазола на ванкомицин в дозе 125 мг 4 раза/сут перорально в течение 10 дней. При тяжелом течении заболевания лечение проводится двумя этим препаратами в тех же дозах. При осложненном заболевании назначается метронидазол 500 мг внутривенно каждые 8 ч в комбинации с ванкомицином 500 мг 4 раза/ сут перорально и 500 мг 4 раза/сут ректально на протяжении 10 дней. В случае перфорации кишки, развития токсического мегаколона, илеуса или синдрома системной воспалительной реакции обсуждается вопрос о колэктомии. Маркером тяжести течения болезни может служить уровень лактата сыворотки (>5 ммоль/л) [11].
Для профилактики ААД необходимо использовать пробиотические препараты. Несколько метаанализов и систематических обзоров последних лет свидетельствуют о статистически значимом снижении риска ААД при приеме пробиотиков: на 39% (ОR 0,61; 95% ДИ: 0,47–0,79), 34% (ОR 0,66; 95% ДИ: 0,64–0,67), 51% (ОR 0,49; 95% ДИ: 0,36–0,67) [19–21]. Риск C. difficile-ассоциированной диареи уменьшался на 63% (ОR 0,37; 95% ДИ: 0,22–0,61) и 58% (ОR 0,42; 95% ДИ: 0,30–0,57). Отметим, что к более существенному снижению риска (OR 0,32; 95% ДИ: 0,22–0,48) приводило назначение пробиотиков в течение 2 дней от начала приема АБ в сравнении с использованием пробиотиков уже после окончания антибиотикотерапии (OR 0,70; 95% ДИ: 0,40–1,23; р=0,02) [19,22].
Во многих обзорах подчеркивается штамм-специфичность пробиотических препаратов для профилактики ААД. В метаанализе Goodman C. et al. (2021) показана эффективность таких штаммов, как L. аcidophilus, L. bulgaricus, L. сasei, L. рaracasei, L. rhamnosus, Lactobacillus spp., Saccharomyces boulardii, B. аnimalis ssp Lactis, B. Longum, B. licheniformis, B. subtilis, Bacillus clausii [23]. Научным сообществом по содействию клиническому изучению микробиома человека (НСОИМ) и Российской гастроэнтерологической ассоциацией (РГА) для профилактики ААД рекомендуются следующие штаммы пробиотиков: L. acidophilus, L. paracasei, L. rhamnosus GG, L. reuteri, L. casei, S. boulardii, B. animalis ssp Lactis, B. lactis Bi-07, Bi-04 [24].
ЗАКЛЮЧЕНИЕ
ААД – актуальная проблема в современных реалиях как для взрослой, так и детской популяций пациентов. Это обусловлено нерациональным использованием АБ, влиянием на кишечный микробиом пищевого рациона, хронических заболеваний, иммуносупрессивных лекарственных средств, подавляющих желудочную секрецию. Изменяют состав микрофлоры кишечника и вирусы, с которыми сталкивается человек, в том числе SARS-CoV-2, а дополнительное воздействие АБ приводит к бурному росту условно-патогенных микроорганизмов с повреждением СО кишки и появлением диареи.
Лечение ААД предусматривает прием энтеросорбентов и пробиотиков с первого дня антибиотикотерапии. Специфическое лечение при этом разработано лишь для C. difficile-ассоциированной болезни. Самым важным фактором профилактики ААД служит рациональный подход к назначению АБ.



