ВВЕДЕНИЕ
Тиазидные и тиазидоподобные диуретики служат краеугольным камнем в лечении артериальной гипертензии (АГ), обеспечивая эффективную начальную антигипертензивную монотерапию и являясь основой для многокомпонентной антигипертензивной стратегии [1–3]. Исследование антигипертензивного, кардио- и вазопротективного эффектов тиазидоподобного диуретика индапамида, в том числе в метаболически нейтральных дозах, выявило широкий спектр фармакодинамических механизмов его терапевтического действия при АГ [3, 4].
Сосуды сопротивления выступают плацдармом для реализации различных патогенетических механизмов АГ, а также одной из главных детерминант прогрессирования заболевания и поражения органов-мишеней [2, 5]. В связи с этим современная стратегия адекватной антигипертензивной терапии предполагает, наряду с прочим, достижение регресса ремоделирования сосудов и коррекцию дисфункции эндотелия [2, 6].
В многоцентровых рандомизированных клинических исследованиях доказаны безопасность и стабильный антигипертензивный эффект ретардной формы индапамида в дозе 1,5 мг/сут, адаптированной для лечения АГ, в том числе в рамках стартовой терапии [1, 2, 7–9]. Однако до сих пор остается дискуссионным вопрос о влиянии тиазидных диуретиков на вегетативный контроль сердечно-сосудистой системы: так, нередко допускается потенциально стимулирующее действие этого класса препаратов на симпатический отдел вегетативной нервной системы у пациентов с АГ [10]. В ранних публикациях, в том числе по результатам рандомизированных клинических исследований, была установлена нейтральность или стимулирующее влияние тиазидных и тиазидоподобных диуретиков в отношении симпатоадреналовой системы [11]. Также было подтверждено, что неблагоприятные метаболические эффекты при использовании данного класса антигипертензивных препаратов, обусловленные, помимо прочего, стимуляцией симпатической нервной системы, носят дозозависимый эффект [5, 12]. Необходимо отметить, что при использовании тиазидоподобных диуретиков в дозах, не обладающих заметным натрийуретическим/диуретическим действием, реципрокная активация симпатической нервной системы не наблюдается [1, 2, 13].
Как известно, общепринятая концепция создания ретардных форм лекарств или с пролонгированным действием требует увеличения дозы активного вещества в 2–3 раза. Однако в препарате индапамида ретард вместо 2,5 мг/сут индапамида с «немедленным высвобождением субстанции», рекомендованного первоначально для терапии АГ, предложено уменьшение дозы до 1,5/сут [3, 8]. Таким образом, несмотря на выявленные различные фармакодинамические механизмы, вазомоторные эффекты индапамида ретард у пациентов с АГ изучены недостаточно [3, 6, 7]. Также следует подчеркнуть, что связь вегетативной регуляции сердца с тяжестью эссенциальной АГ у пациентов, получающих длительную антигипертензивную терапию, недостаточно известна [13, 14]. Это представляет большой интерес в свете изучения антигипертензивной эффективности и влияния индапамида ретард на ремоделирование сердечно-сосудистой системы у пациентов с АГ в зависимости от исходного тонуса вегетативной нервной системы.
Целью представленного исследования стала оценка эффективности индапамида ретард в зависимости от наличия ремоделирования сосудов и вариабельности ритма сердца (ВРС) при неосложненном течении эссенциальной АГ.
МАТЕРИАЛ И МЕТОДЫ
В открытое клиническое исследование были включены 75 пациентов (43 мужчины и 32 женщины) с АГ I–II степени в возрасте от 48 до 60 лет (средний возраст 56,3±6,4 года). Необходимо отметить, что пациенты, вошедшие в исследование, ранее не получали антигипертензивные средства постоянно, используя короткодействующие препараты только для купирования эпизодов повышения артериального давления (АД). Кроме того, у отдельных пациентов имела место впервые выявленная АГ. Это позволило выполнять исходные инструментальные исследования непосредственно перед началом терапии изучаемым препаратом.
После скринингового обследования участников разделили на две группы: 1-я – 30 человек с нормальными структурно-функциональными показателями плечевой артерии (ПА), 2-я – 45 пациентов с признаками ремоделирования сосудистой стенки и/или нарушенной вазомоторной функцией, т.е. с толщиной комплекса интима-медиа (КИМ) ПА >0,9 мм и приростом величины эндотелий-зависимой вазодилатации <10% после пробы с реактивной гиперемией [2]. В обеих группах пациентам назначалcя индапамид ретард 1,5 мг/сут («Канонфарма», Россия).
Клиническая характеристика пациентов показала, что по гендерно-возрастному признаку, степени и давности АГ, а также по среднесуточным показателям систолического и диастолического АД (САД, ДАД) различия в сравниваемых группах были недостоверны (табл. 1). Однако во 2-й группе показатель толщины КИМ ПА по сравнению с 1-й группой оказался достоверно выше (в среднем 29,3%; p <0,001), а величина эндотелий-зависимой вазодилатации (ЭЗВД), наоборот, достоверно ниже.

Кроме того, у 29 пациентов (38,7%) диагностировалась гипертрофия левого желудочка (ГЛЖ), в том числе у 10 пациентов (33,3 %) в 1-й группе и у 22 пациентов (48,9%) во 2-й (χ2 = 1,78; p=0,182). По результатам суточного мониторирования АД (СМАД), у 32 пациентов (42,7%) был выявлен суточный профиль АД типа диппер, у 43 (57,3%) – нон-диппер. При этом в 1-й группе, по сравнению со 2-й, преобладали случаи суточного профиля АД с типом диппер (66,7 против 26,7%), а во 2-й, напротив, пациентов с типом нон-диппер было в 2 раза больше, чем в 1-й группе (73,3 против 33,3%). Факторы риска, такие как курение, дислипидемия и избыточная масса тела в группах различались недостоверно. Хроническая болезнь почек I–II стадии диагностировалась в 1-й группе у 23,3% пациентов, во 2-й – у 16,7%, а хроническая обструктивная болезнь легких в стадии вне обострения – у 10,0 и 8,9% пациентов соответственно. С учетом коморбидных состояний исследованные пациенты получали корригирующее лечение, в частности статины в рекомендуемых дозах.
В исследование не включались (критерии невключения) пациенты – «плацебо-реакторы», больные с наличием симптоматических АГ, АГ «белого халата», ассоциированными клиническими состояниями при АГ, сахарным диабетом, хронической сердечной недостаточностью выше IIА стадии и/или II функционального класса, постоянной формой фибрилляции предсердий и частой экстрасистолией.
Участникам исследования до и после 6 мес терапии индапамидом ретард 1,5 мг/сут проводились инструментальные исследования.
Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинской декларации Всемирной медицинской ассоциации «Рекомендации для врачей, занимающихся биомедицинскими исследованиями с участием людей». Протокол исследования был одобрен Этическим комитетом Пензенского института усовершенствования врачей – филиала ФГБОУ ДПО «РМАНПО» Минздрава России. До включения в исследование все больные подписывали письменное информированное согласие на участие в нем.
Допплер-эхокардиографическое исследование проводилось на аппарате Acuson X300 (Siemens-Acuson, Германия), оснащенном фазированным электронным датчиком, в режимах B- и М-сканирования по стандартной методике. Вычислялись следующие показатели [2]: конечный систолический и конечный диастолический объемы левого желудочка (КСО ЛЖ, КДО ЛЖ), толщина межжелудочковой перегородки (МЖП) и задней стенки (ЗСЛЖ), фракция выброса (ФВ), масса миокарда ЛЖ (ММЛЖ), сердечный индекс (СИ) и удельное периферическое сосудистое сопротивление (УПСС). Гипертрофия левого желудочка (ГЛЖ) диагностировалась при величине индекса ММЛЖ (ИММЛЖ) >115 г/м2 у мужчин и >95 г/м2 у женщин [1, 2].
С помощью ультразвукового допплеровского исследования плечевой артерии (ПА) до и после реактивной гиперемии определяли диаметр просвета ПА, толщину КИМ, отношение толщины КИМ к диаметру просвета ПА (индекс С/П) и максимальную (систолическую) линейную скорость кровотока (Vmax). Эндотелий-зависимую вазодилатацию (ЭЗВД) изучали с помощью метода реактивной гиперемии, предложенного Celemajer D.S. et al. [2], эндотелий-независимую вазодилатацию (ЭНЗВД) – по расширению сосуда после приема 0,5 мг нитроглицерина сублингвально.
СМАД выполнялось согласно отечественным рекомендациям по ведению пациентов с АГ [2] на аппарате BPLab (Россия). Регистрация АД осуществлялась с интервалом 30 мин днем и 1 ч ночью. Периоды бодрствования и сна выставлялись индивидуально в реальном времени, полученные данные анализировались с учетом дневников самонаблюдения. Вычислялись среднесуточные показатели САД и ДАД (САДср., ДАДср.), частота сердечных сокращений (ЧСС), степень ночного снижения (СНС) САД и ДАД, вариабельность САД и ДАД (САДвар., ДАДвар.), индексы времени «нагрузки давлением» (ИВ САД, ИВ ДАД), величина утреннего подъема (ВУП) САД и ДАД, соотношение остаточного гипотензивного эффекта к максимальному эффекту (индекс t/p, %). С учетом величины суточного индекса САД и ДАД определялись типы суточного профиля АД.
ВРС изучали при холтеровском мониторировании электрокардиограммы (ЭКГ) с помощью аппарата Astracard (Россия) [15]. Анализ показателей ВРС производился в 5-минутных отрезках при 24-часовой записи ЭКГ. Оценивались следующие временные показатели ВРС: 1) средняя продолжительность синусовых интервалов R–R (NN); 2) стандартное отклонение от средней длительности всех синусовых интервалов R–R (SDNN); 3) средняя для стандартных отклонений от средних значений интервалов NN на всех 5-минутных участках записи ЭКГ (SDNN index); 4) среднеквадратичное различие между продолжительностью соседних синусовых интервалов R–R (RMSSD); 5) процент от общего количества последовательных пар интервалов R–R, различающихся более чем на 50 мс (pNN50). Также мы определяли спектральные (частотные) показатели ВРС: высокочастотный компонент мощности (HF), низкочастотный компонент (LF), очень низкочастотный компонент (VLF), соотношение LF/HF. Также вычислялись нормализованные единицы частотных компонентов HF и LF (HFn, LFn.) для нивелирования влияния на них общей мощности.
Статистический анализ полученных данных проводился при помощи программы STATISTICA 8.0 для Windows. Нормальность распределения переменных определялась согласно тесту Колмогорова–Смирнова. Для определения центральной тенденции и разброса непрерывных переменных при распределении, близком к нормальному, вычислялись среднее арифметическое (M) и стандартное отклонение (SD). Достоверность различия переменных в двух группах оценивалась посредством параметрических или непараметрических методов в зависимости от нормальности распределения переменных. Для сравнения долей применялись точный критерий Фишера и критерий хи-квадрат (χ2) Пирсона. С целью изучения корреляции использовался метод ранговой корреляции Спирмена. Различия считали статистически значимыми при р <0,05.
РЕЗУЛЬТАТЫ
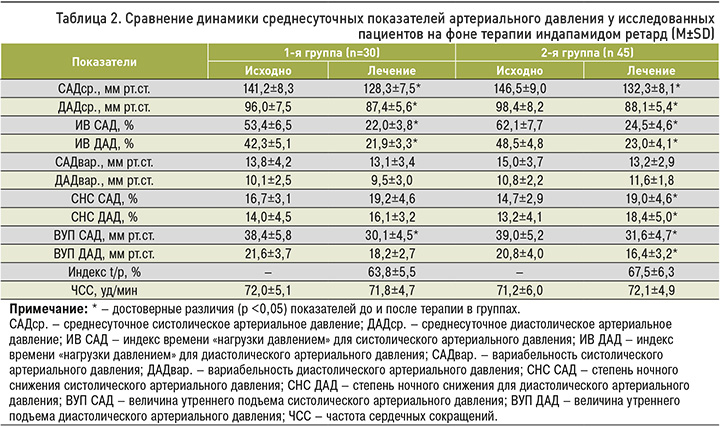
На фоне терапии целевые уровни АД в 1-й группе были достигнуты у 16 пациентов (53,3%), во 2-й группе – у 29 (64,4%). При этом у всех пациентов обеих групп наблюдалась нормализация АД (ниже 140/90 мм рт.ст.). Среднесуточные показатели САД и ДАД в группах снизились достоверно, однако различие между группами по этим показателям было недостоверно (табл. 2). Динамика показателей ИВ САД и ИВ ДАД в обеих группах оказалась сопоставимой и свидетельствовала о стабильном и надежном контроле АД в течение суток при приеме индапамида ретард. На фоне терапии также было отмечено достоверное снижение показателей ВУП САД и ВУП ДАД, которое оказалось более выраженным в 1-й группе. Это подтверждается и показателями индекса t/p >50%, которые свидетельствуют о достаточно выраженном пролонгированном антигипертензивном эффекте индапамида ретард в течение суток.
При оценке структурно-функциональных показателей сердца и сосудистой стенки через 6 мес терапии индапамидом ретард в группах исследования были выявлены некоторые различия (табл. 3). Так, уменьшение величин ИММЛЖ у пациентов с ГЛЖ, в основном за счет толщины стенок ЛЖ, в 1-й группе составило в среднем 10,2% (p=0,021), а во 2-й – 13,6% (p=0,007). Показатели насосной функции сердца – СИ и ФВ – на фоне проводившейся терапии изменились в группах незначительно и неоднозначно (p >0,05). В то же время во 2-й группе было выявлено достоверное снижение показателя УПСС, составившее в среднем 17,1% (p=0,002). Кроме того, только во 2-й группе отмечалась достоверная динамика показателей трансмитрального диастолического потока (Ve, Va, Ve/Va, ВИВР), свидетельствующая об улучшении релаксации миокарда ЛЖ, что, вероятно, связано с регрессом ГЛЖ на фоне терапии индапамидом ретард. На фоне терапии индапамидом ретард во 2-й группе произошли значительные сдвиги структурно-функциональных показателей ПА: в частности, толщина КИМ достоверно уменьшилась в среднем на 12,8 % (p=0,013), а величина ЭЗВД, наоборот, возросла в среднем на 25,4% (p <0,001). В результате во 2-й группе было установлено выраженное снижение постнагрузки – уменьшение показателя УПСС в среднем на 17,1% (p <0,001).

При сравнении исходных показателей ВРС в 1-й группе как временные, так и частотные параметры ВРС свидетельствовали о преобладании тонуса симпатической нервной системы, во 2-й группе наблюдалось снижение тонуса как симпатической, так и парасимпатической нервной системы по сравнению с 1-й группой (табл. 4). Также было установлено, что количество пациентов с критическими значениями показателей SDNN <50 мс и LF/HF >1,5, имеющих неблагоприятное прогностическое значение и подтверждающих повышенную активность симпатической нервной системы, в 1-й группе было достоверно выше, чем во 2-й: 56,7 против 31,1% (χ2=4,85; p=0,027) и 63,3 против 26,7% (χ2=9,98; p=0,002) соответственно. Необходимо отметить, что через 6 мес после терапии индапамидом ретард изменения показателей ВРС в группах оказались недостоверными (p >0,05), а также сохранялись межгрупповые различия показателей, что указывает на отсутствие модуляции нейрогуморальной регуляции сердечно-сосудистой системы при приеме этого препарата.

Также нами была выявлена прямая корреляция между показателями SDNN и ЭЗВД (рис.). При этом, несмотря на незначительные изменения показателя SDNN, величина ЭЗВД после терапии индапамидом ретард увеличилась существенно, что подтверждает роль прямого сосудистого эффекта препарата вне зависимости от вагосимпатического баланса у пациентов с АГ.
ОБСУЖДЕНИЕ
В контролируемых клинических исследованиях индапамид ретард в дозе 1,5 мг/сут снижал как среднее САД, так и ДАД у пациентов с эссенциальной гипертензией или изолированной систолической гипертензией [8, 9]. Снижение САД и ДАД при применении этой формы индапамида было таким же, как при использовании амлодипина 5 мг/сут, кандесартана 8 мг/сут и эналаприла 20 мг/ сут [3]. Полученные нами результаты исследования также показали достаточно высокое антигипертензивное действие индапамида ретард в дозе 1,5 мг/сут у пациентов с неосложненной АГ I–II степени. Также была выявлена автокорреляция степени регресса ремоделирования сосудистой стенки с исходными показателями, характеризующими выраженность эндотелиальной дисфункции и утолщения КИМ. Это подтверждается динамикой структурно-функционального ремоделирования сосудистой стенки на фоне терапии индапамидом ретард во 2-й группе. Таким образом, показано, что это лекарственное средство обладает таргетированным сосудистым эффектом у пациентов с АГ даже при наличии ранних субклинических признаков ремоделирования сосудов – гипертрофии медиа и/или эндотелиальной дисфункции.
Указанное вазопротективное действие препарата, вероятно, обусловлено способностью индапамида ретард стимулировать эндогенный синтез оксида азота эндотелием артерий [4, 6], а также снижением реактивности артериол на вазоконстрикторные агенты, включая катехоламины, вследствие снижения содержания ионов натрия в их стенке [7, 8]. Этому также способствует слабовыраженный натрийуретический эффект индапамида ретард по сравнению с обычным индапамидом в дозе 2,5 мг. По общепринятым клиническим рекомендациям, тиазидные и тиазидоподобные диуретики рекомендуются пациентам с изолированной систолической АГ, обусловленной повышенной ригидностью крупных артерий, как препараты первой линии терапии [1, 2].
Противоречивые данные получены в отношении корреляции вегетативной дисфункции с ремоделированием кардиоваскулярной системы и антигипертензивным действием индапамида ретард при АГ [13, 14]. Так, было установлено, что на ранних стадиях эссенциальной АГ, как правило, преобладает симпатическая активность, и это позволяет предположить, что нейрогормональная дисрегуляция может быть ключом к ее этиологии и прогрессированию, а также к выбору антигипертензивной терапии [10]. Mussalo H. et al. [11] по результатам сравнительной оценки ВРС у здоровых субъектов и пациентов с легкой и тяжелой степенью эссенциальной АГ показали, что вегетативная дисфункция, характеризующаяся преобладанием тонуса симпатической нервной системы, прямо коррелирует с тяжестью АГ. Также подчеркивается, что у пациентов с тяжелой степенью АГ четкой ассоциации между показателем SDNN и уровнем АД не обнаружено [3]. Как известно, длительное применение различных классов антигипертензивных препаратов может изменить корреляции показателей ВРС и уровней АД [7]. Так, выявлено, что корреляции показателей ВРС и уровней АД статистически более значимы для группы пациентов, не принимавших антигипертензивные средства [14].
Также следует отметить, что роль вегетативной дисфункции в ремоделировании сосудов у разных категорий пациентов с АГ изучена недостаточно. Нами показано, что в начальной неосложненной стадии АГ, т.е. в отсутствие ремоделирования сосудов и/или эндотелиальной дисфункции, симпатическая гиперактивность выражена более значительно, чем у пациентов со структурно-функциональным ремоделированием артерий мышечного типа и ГЛЖ. Это, возможно, объясняется тем, что на поздних стадиях АГ происходит истощение запасов нейромедиаторов симпатической нервной системы, и нередко наблюдается параллельное снижение вагусной и симпатической активности [10].
Изучение роли вегетативной дисфункции при различных стадиях эссенциальной АГ важно для выбора эффективных терапевтических стратегий антигипертензивной терапии [13]. Так, полученные нами результаты свидетельствуют об обратимости гипертрофии сосудистой стенки и улучшении эндотелиальной функции в группе пациентов, имевших признаки гипертензивного ремоделирования сосудов на фоне терапии индапамидом ретард. Выявленная прямая корреляция показателей SDNN и ЭЗВД свидетельствует о том, что увеличение вазодилатации на фоне терапии индапамидом ретард ассоциируется со сниженной симпатической активностью. Важно подчеркнуть, что на фоне терапии этим препаратом в дозе 1,5 мг/сут усиления симпатической активности вне зависимости от исходных нарушений вагосимпатического баланса нами выявлено не было.
Необходимо также отметить, что установлены различные фармакологические механизмы, подтверждающие первично сосудистые эффекты индапамида [3, 4, 8]. Так, индапамид вызывает усиление синтеза простагландина Е2 и простациклина, которые активируют депрессорное звено регуляции сосудистого тонуса [4]. Установлено, что вазодилатирующее действие этого тиазидоподобного диуретика связано с уменьшением внутриклеточной концентрации ионообменного кальция в гладкомышечных клетках артериол, которое напоминает эффект блокады медленных кальциевых каналов, характерный для дигидропиридиновых антагонистов кальция [6, 9]. Кроме того, подтверждена роль индапамида в стимуляции эндотелием синтеза оксид азота [3, 12]. Предполагается, что одним из возможных механизмов вазодилатирующего действия препарата является его агонизм в отношении калиевых каналов мембран гладкомышечных клеток [5]. Поэтому, исходя из фармакотерапевтических эффектов, индапамид расценивается специалистами как периферический вазодилататор. Все это позволяет рекомендовать широкое применение индапамида с «пролонгированным высвобождением субстанции» в качестве моно- и комбинированной терапии у всех категорий гипертоников.
ЗАКЛЮЧЕНИЕ
Таким образом, можно констатировать, что антигипертензивный, кардио- и вазопротективные эффекты индапамида ретард реализуются за счет различных фармакологических механизмов в зависимости от нарушений вагосимпатического баланса и ремоделирования сосудов сопротивления. Продемонстрировано, что в отсутствие структурно-функциональных изменений сосудов основным патогенетическим механизмом АГ выступает нарушение нейрогуморальной регуляции кровообращения, что характерно для начальных стадий заболевания. По мере прогрессирования АГ ремоделирование резистивных сосудов становится ведущим патогенетическим механизмом АГ при нормальной или даже сниженной симпатической активности. Широкий терапевтический диапазон индапамида позволяет рассматривать его как универсальный антигипертензивный препарат для адекватной коррекции АГ. Учитывая актуальность оценки нарушений вегетативной регуляции у пациентов, получающих длительно антигипертензивную медикаментозную терапию, необходимо проведение контролируемых клинических исследований для установления эффективности этого тиазидоподобного диуретика в виде монотерапии или комбинации с альтернативными антигипертензивными препаратами с учетом особенностей клинического течения и поражений сердечно-сосудистой системы.



