ВВЕДЕНИЕ
Борьба с анемией, в первую очередь среди женщин репродуктивного возраста и детей, является одной из приоритетных задач Всемирной организации здравоохранения (ВОЗ). В 2019 г. в мире анемия была выявлена у 29,6% небеременных и 36,5% беременных женщин репродуктивного возраста, при этом более 50% заболевания пришлось на железодефицитную анемию (ЖДА) [1]. Отметим, что встречаемость ЖДА среди женщин репродуктивного возраста варьирует в разных странах. Так, в государствах западной Европы частота ЖДА в этой категории пациенток составляет 2–5% случаев, а латентного дефицита железа (ЛДЖ) – 10–32% [2], тогда как в странах третьего мира их распространенность может превышать 50%. В России ввиду объективных причин актуальные данные о распространенности ЖДА и ЛДЖ в настоящий момент отсутствуют. Согласно данным Федеральной службы статистики, в 2020 г. в РФ было выявлено 1,57 млн пациентов различных групп с анемией (мужчин, женщин, лиц пожилого и старческого возраста и т.д.) [3]. При этом на момент 2020 г. в нашей стране проживал 41 млн женщин репродуктивного возраста [4], что позволяет сделать вывод о вероятной низкой выявляемости железодефицитных состояний (ЖДА и ЛДЖ) в России.
Железо – необходимый микроэлемент для продукции энергии, кислородного обмена и пролиферации клеток. В нашем организме отсутствует система его выведения; в сутки человек может выделить не более 0,05% общего количества железа. В результате единственным физиологически доступным способом изменения количества железа в организме является контроль над его всасыванием.
Несмотря на то что каждая клетка организма нуждается в железе, большая его часть содержится в клетках эритроидного ростка (около 80%). В норме железо после поглощения энтероцитами тонкой кишки транспортируется в костный мозг, где входит в состав молекулы гемоглобина. Эритроциты в конце своего существования подвергаются фагоцитозу макрофагами костного мозга, селезенки и печени, которые транспортируют практически все катаболизированное железо в костный мозг клеткам эритроидного ряда для их созревания [5]. Любой излишек железа остается внутри макрофагов и гепатоцитов [6]. Физиологические суточные потери железа минимальны и в отсутствие менструаций составляют 1–2 мг/сут: 22,5 мкг/л железа «уходит» при потовыделении [7], 0,05 мг – с мочой (в основном за счет слущенных клеток эпителия мочевых путей), остальные его потери приходятся на желудочно-кишечный тракт (ЖКТ) [8].
В настоящий момент разработан целый ряд лабораторных параметров, позволяющих выявлять наличие железодефицитных состояний. Эти параметры можно разделить на две категории. Первая включает лабораторные показатели, оценивающие систему межклеточного транспорта железа: общая и латентная железосвязывающая способность сыворотки крови, уровень сывороточного железа, коэффициент насыщения трансферрина, уровень трансферрина и растворимых рецепторов к трансферрину крови. Ко второй категории относятся параметры, позволяющие определить внутриклеточные запасы железа: уровень ферритина крови и (исторический метод) оценка запасов железа костного мозга путем окраски мазков аспирата костного мозга по Перлсу [9, 10]. Из всех перечисленных показателей сывороточный ферритин считается наилучшим лабораторным маркером дефицита железа по нескольким причинам: он обладает самой высокой чувствительностью и специфичностью, прямо пропорционален запасам железа в организме и, таким образом, указывает на наличие дефицита железа раньше, чем лабораторные параметры, оценивающие транспорт железа [11].
Железодефицитные состояния – результат отрицательного баланса железа, к которому могут привести четыре основных фактора: повышенная потребность в железе при росте организма, беременности или повышенной физической активности [12], недостаточное потребление железа с пищей, нарушение всасывания железа в ЖКТ (при ахлоргидрии, H. pylori-ассоциированного гастрите [13]), увеличение потери железа (при наличии источников хронической кровопотери, в том числе связанных с менструальным циклом). Что касается достаточного потребления железа с пищей, то женщины, питающиеся «европейской» диетой с регулярным наличием в рационе красного мяса, потребляют 12–14 мг железа в день [14, 15]. Стоит отметить, что всасывание железа сильно ограничено: из ЖКТ абсорбиуется не более 18% (до 2,5 мг) этого микроэлемента, поступившего с пищей [16]. При этом во время менструаций у женщин без нарушений менструального цикла дополнительно теряется от 0,006 до 0,025 мг/кг железа в сутки [17], что при отсутствии беременности и лактации увеличивает суточную потребность в железе в репродуктивном возрасте до 18 мг в день [18]. Разработанные многочисленные методики определения объема кровопотери в период менструации, к сожалению, не вошли в рутинную клиническую практику, и в диагностике нарушений менструального цикла рекомендуется использовать шкалу FIGO, где этот показатель определяется пациенткой субъективно [19].
В настоящий момент накоплены убедительные данные о более высокой частоте встречаемости ЛДЖ среди легкоатлетов по сравнению с основной популяцией, что в первую очередь обусловлено активацией депо железа на нужды гемопоэза [12, 20]. Стоит отметить, что когортные исследования о встречаемости ЛДЖ у спортсменок трудно сопоставить между собой ввиду отсутствия единого мнения о нижней границе нормы уровня ферритина, которая в разных исследованиях варьирует от 12 до 45 нг/мл [12, 20–23]. Оценка феррокинетики имеет особое значение при работе со спортсменами из-за негативного влияния физических упражнений на баланс железа. Атлеты могут быть особенно восприимчивы к дефициту железа по ряду причин, включая желудочно-кишечную кровопотерю, выделение железа с потом, ускоренный жизненный цикл эритроцитов, термический гемолиз и гемолиз при ударе ногой [22, 23]. У стайеров был обнаружен более низкий уровень ферритина в сыворотке крови по сравнению с бегунами на короткие и средние дистанции [24]. Таким образом, вышеперечисленные факторы приводят к повышенному риску развития железодефицитных состояний у женщин-легкоатлеток. До сих пор остается малоизученной степень изменения баланса железа при наличии ЛДЖ до периода интенсификации физических нагрузок.
Целью представленного исследования стала оценка влияния физических нагрузок на формирование железодефицитных состояний у спортсменок молодого возраста.
МАТЕРИАЛ И МЕТОДЫ
Проведено проспективное исследование женщин-легкоатлеток молодого возраста, участвовавших в спортивных сборах (основную долю физических нагрузок составляли аэробные нагрузки, кроссы объемом 50–70 км в неделю).
Критерием исключения из исследования было наличие острого воспалительного процесса (уровень С-реактивного белка >5,0 мг/л), аномальных маточных кровотечений (в соответствии со шкалой FIGO [19]).
Непосредственно перед началом спортивных сборов у участниц исследования были оценены общий анализ крови, уровень ферритина и С-реактивного белка крови (1-я точка исследования). Все образцы крови исследовались в одной лаборатории, на одинаковых анализаторах. Общий анализ крови выполнялся на анализаторе Medonic M20 («ЛАБ-Медика», Россия). Определение уровня ферритина крови проводилось методом твердофазного иммуноферментного анализа на анализаторе Fluorofot Charity («Пробнаучприбор», Россия). Время доставки каждой пробирки до анализатора составляло не более 1 ч.
Далее участницы исследования были разделены на 3 группы: «здоровые» женщины без дефицита железа (ферритин >30 мкг/л, гемоглобин >120 г/л); женщины с ЛДЖ (ферритин <30 мкг/л, гемоглобин >120 г/л); женщины с ЖДА (ферритин <45 мкг/л, гемоглобин <120 г/л). Группа с ЖДА была исключена из дальнейшего исследования; пациенткам из этой группы была назначена терапия препаратами железа согласно действующим клиническим рекомендациям. Спортсменки с ЛДЖ, в свою очередь, были дополнительно разделены на две группы методом рандомизации: группа с ЛДЖ, получавшая терапию препаратом железа (железа (III) гидроксид полимальтозат 200 мг/сут), и группа наблюдения, в которой препараты железа не применялись.
На 30-й день было проведено повторное исследование общего анализа крови и уровня ферритина крови (2-я точка исследования). Был выполнен межгрупповой сравнительный анализ распространенности железодефицитных состояний в 1-й точке исследования и внутригрупповой сравнительный анализ полученных результатов лабораторных исследований в 1-й и 2-й точках исследования в трех исследуемых группах («здоровые» женщины, женщины с ЛДЖ, не получавшие терапию, и женщины с ЛДЖ, получавшие терапию препаратом железа).
При статистической обработке полученных результатов оценка на нормальность внутри каждой группы осуществлялась с помощью теста Шапиро–Уилка. В каждой исследуемой группе распределение показателей отличалось от нормального, и дальнейший статистический анализ проводился посредством непараметрических методов. При описании групп использовались медиана, 25-й и 75-й центили. Для межгруппового сравнения полученных результатов между двумя независимыми группами применялся критерий Манна–Уитни, при сравнении результатов двух зависимых групп – критерий Уилкоксона. Отклонение нулевой гипотезы принималось при уровне критерия α <0,05. Межгрупповое сравнение между тремя группами выполнялось с использованием критерия Краскила–Уоллиса. При выявлении отклонений от нулевой гипотезы проводился апостериорный анализ при помощи критерия Манна–Уитни с поправкой Бонферрони (в таком случае отклонение нулевой гипотезы принималось при α <0,017).
РЕЗУЛЬТАТЫ
Всего в исследовании приняли участие 68 спортсменок в возрасте 18–21 года. Медиана возраста составила 18 лет [18; 18]. В 1-й точке исследования у 25 (36,7%) женщин был диагностирован ЛДЖ, у 16 (23,5%) – ЖДА (таблица). Во всех случаях была верифицирована ЖДА легкой степени, лишь у одной обследуемой уровень гемоглобина оказался ниже 100 г/л. Уровень С-реактивного белка у всех испытуемых был <5 мг/л (Ме 2,4 [Q 1,2; 3,1] мг/л). Ни у одной участницы не отмечалось нарушений менструального цикла, статистически значимых различий по длительности менструаций между исследуемыми группами обнаружено не было. Значения индекса массы тела (ИМТ) в исследуемых группах также были сопоставимы. При проведении апостериорного сравнительного анализа были выявлены сопоставимые показатели общего анализа крови между группами «здоровых» женщин и женщин с ЛДЖ (p >0,017). При этом не было установлено различий в уровне ферритина между группами участниц с ЛДЖ и ЖДА (p >0,017).
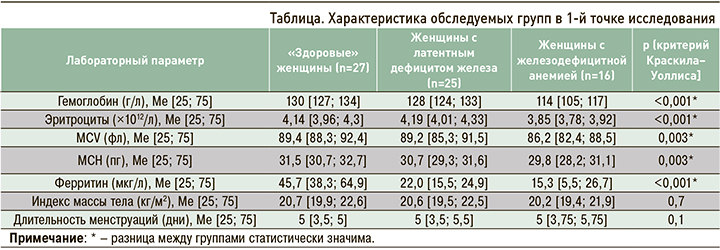
Ко 2-й точке (через 30 дней от начала спортивных сборов) из исследования было исключено 8 участниц – 4 в группе «здоровых» женщин по техническим причинам и 4 в группе ЛДЖ с терапией препаратом железа ввиду низкого комплаенса, не связанного с побочными эффектами от приема лекарственного средства. В группе «здоровых» женщин (n=23) медианы уровней гемоглобина и эритроцитов ко 2-й точке исследования были сопоставимы и составили 128 [126; 131] г/л и 4,28 [3,85; 4,42] × 1012/л соответственно (p >0,05; рис., сегмент 1А). Медиана уровня ферритина, в свою очередь, ко 2-й точке исследования была в этой группе статистически значимо ниже – 28,1 [16,4; 44,4] мкг/л (рис., сегмент 1В). При этом у 5 обследованных «здоровых» женщин уровень гемоглобина оказался выше, чем в 1-й точке исследования, на 5–9 г/л. У 11 участниц этой группы (48%) во 2-й точке исследования был выявлен ЛДЖ, у 2 (9%) – ЖДА.
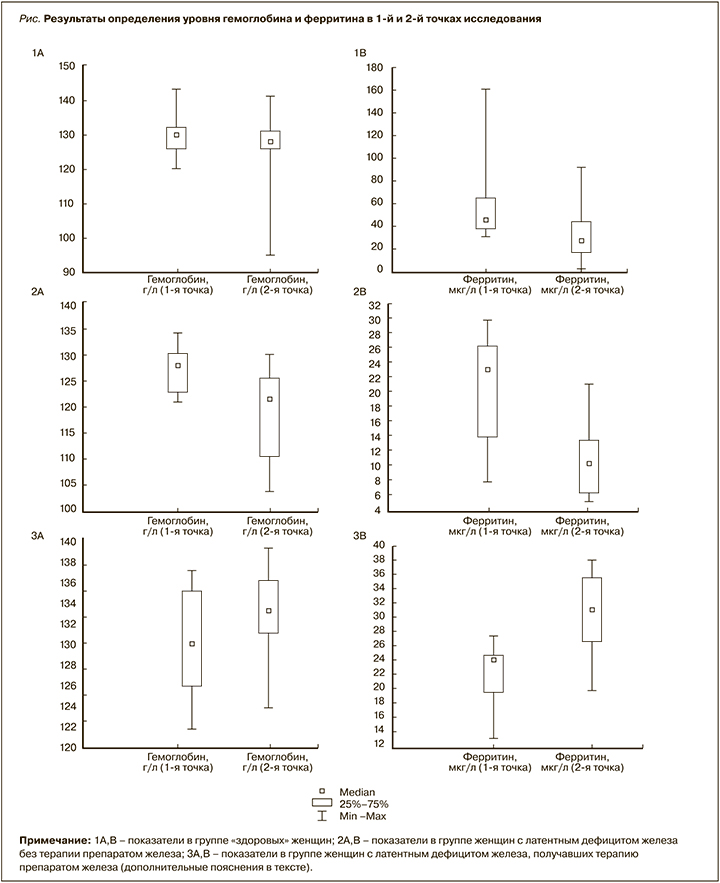
В группе ЛДЖ без терапии препаратами железа (n=12) наблюдалось статистически значимое снижение медианы уровня гемоглобина до 121 [110; 125] г/л, эритроцитов – до 4,01 [3,79; 4,16] ×1012/л, ферритина – до 10,2 [6,3; 13,2] мкг/л (рис., сегменты 2А, В). При этом у 5 участниц (42%) этой группы во 2-й точке исследования была диагностирована ЖДА. В группе ЛДЖ и терапией препаратами железа (n=9) ко 2-й точке исследования было выявлено статистически значимое увеличение уровня гемоглобина – со 130 [126; 135] до 133 [131; 136] г/л и ферритина – с 24,1 [19,6; 24,5] до 28,1 [16,4; 44,4] мкг/л (рис., сегменты 3А, В). При этом у двоих обследованных на фоне приема препаратов железа отмечалось незначительное снижение уровня ферритина (в пределах 2 единиц).
В рамках post-hoc-анализа выполнялся расчет относительного риска возникновения железодефицитных состояний (ЛДЖ или ЖДА). При наличии ИМТ <20 кг/м2 в 1-й точке исследования относительный риск составил 1,9 (чувствительность 46%, специфичность 90%). Относительный риск развития железодефицитных состояний в зависимости от длительности менструаций в пределах 5–8 дней равнялся 0,9 и не показал значимой чувствительности (59%) или специфичности (33%).
ОБСУЖДЕНИЕ И ЗАКЛЮЧЕНИЕ
Нами были получены данные о высокой встречаемости железодефицитных состояний среди женщин молодого возраста, что согласуется с данными ВОЗ. Подтверждено влияние физических нагрузок на формирование ЛДЖ, при этом наличие ЛДЖ перед интенсификацией физических нагрузок с вероятностью 41,7% приводит к дебюту ЖДА уже через 30 дней наблюдения. Причина развития железодефицитных состояний в рамках нашего исследования, вероятно, была многофакторна и включала как недостаточное поступление железа с пищей и менструальные кровопотери, так и повышенные потери железа на фоне аэробных физических нагрузок. Физиологическая реакция эритрона на аэробную физическую нагрузку в виде снижения уровня ферритина и увеличения уровня гемоглобина наблюдалась лишь в нескольких случаях при достаточном уровне ферритина (>30 мкг/л) в 1-й точке исследования. В то же время у всех участниц, получавших терапию препаратом железа, отмечалось увеличение уровней и гемоглобина, и ферритина. В других исследованиях, где применялись более низкие дозировки препаратов железа (100 мг/сут) на фоне физических нагрузок, наблюдалось дальнейшее снижение уровня ферритина [21].
Учитывая высокую встречаемость железодефицитных состояний уже в 1-й точке исследования, целесообразно рассмотреть вопросы длительности приема препаратов железа и целевого уровня ферритина для наилучшего восполнения депо. Исследование уровня ферритина крови у женщин молодого возраста перед длительным периодом интенсификации физической нагрузки может способствовать раннему выявлению латентного дефицита железа и железодефицитной анемии и своевременному назначению препаратов железа для их коррекции. Целесообразно проведение дальнейших исследований на более крупных выборках с учетом не только сопутствующей патологии, но и характера питания и количества потребляемого железа в сутки в период наблюдения.



