Микрокристаллические (метаболические) артропатии – группа заболеваний опорно-двигательного аппарата, обусловленная нарушением обмена веществ. К метаболическим артритам относятся заболевания, вызванные кристаллами уратов (подагра) и пирофосфата кальция (болезнь депонирования пирофосфатов кальция/пирофосфатная артропатия).
Распространенность обеих артропатий увеличивается с возрастом. Так, подагру наиболее часто диагностируют у взрослых, а пирофосфатную артропатию (ПАП) преимущественно у лиц пожилого возраста (не моложе 55 лет) с равной частотой как у мужчин, так и у женщин [1]. Характерными чертами заболеваний являются выпадение кристаллов (моноурата натрия, пирофосфата кальция, гидроксиапатита и др.) в синовиальную жидкость, пропитывание ими суставных и околосуставных поверхностей, а также развитие синовита и артрита [2].
В настоящее время подагру рассматривают как аутовоспалительный процесс, поскольку фагоцитоз кристаллов моноурата натрия приводит к активации врожденного иммунитета путем активации NRLP3 – инфламмасомы и последующей секреции ключевого цитокина интерлейкина-1β и других провоспалительных цитокинов [1].
Клинически оба заболевания очень похожи, проявляются острыми приступами артрита. Близость ПАП и подагры также отражена и в историческом названии первого заболевания – «псевдоподагра». В 90% случаев при ПАП поражаются коленные, плечевые суставы и мелкие суставы кистей. Подагра может начинаться и с артрита коленных суставов, особенно при наличии травмы в анамнезе, и, наоборот, ПАП может дебютировать с вовлечения плюснефалангового сустава [3]. Кроме того, описано сочетание обоих заболеваний у одного пациента, что значительно затрудняет как диагностику, так и подбор терапии [3]. По некоторым данным, подагра может быть фактором риска развития ПАП [2]. Крупных исследований о сочетании подагры и ПАП не проводилось, по данным НИИ ревматологии им. В.А. Насоновой, эти микрокристаллические артриты встречаются вместе довольно часто [3]. В статье приведен такой клинический случай.
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
Больной В., 58 лет, ИМТ=29,2 кг/м2, тип ожирения – абдоминальный (индекс «талия/бедро» 0,94). С 40-летнего возраста пациент регулярно употребляет алкоголь (до 250–300 г водки 1 раз в неделю или до 1 л красного вина). При каждом приеме алкоголя съедает большое количество мясных продуктов (около 2 кг). Дебют заболевания в январе 2013 г., когда впервые после употребления кровяной колбасы отметил резкую боль, гиперемию в I плюснефаланговом суставе обеих стоп. В дальнейшем атаки артрита повторялись регулярно после алкогольных эксцессов, эпизодов дегидратации (баня), употребления грибов и квашеной капусты. В основном в атаки вовлекались I плюснефаланговые суставы пальцев стоп, реже возникали моноартриты коленных суставов. Во время приступов пациент самостоятельно применял НПВП (диклофенак натрия).
В связи с резким учащением приступов в ноябре 2013 г. больной обратился на прием в НИИ ревматологии им В.А. Насоновой. Была диагностирована подагра, подтвержденная результатами поляризационной микроскопии, выявившей кристаллы моноурата натрия в синовиальной жидкости. Сывороточный уровень мочевой кислоты составил 590 мкмоль/л. После купирования артрита начата терапия аллопуринолом в дозе 100 мг/сут с последующим постепенным увеличением до 300 мг/сут. На фоне проводимой терапии уровень мочевой кислоты достиг целевых значений (360 мкмоль/л). С 2014–2017 гг. пациент к врачам не обращался, самостоятельно контролировал уровень мочевой кислоты, который был стойко нормальный (320–350 мкмоль/л), принимал аллопуринол по 100 мг/ сут.
 В октябре 2017 г. после алкогольного эксцесса возникли боль и припухлость в коленных суставах и I плюснефаланговом суставе справа, в связи чем обратился к ревматологу. При осмотре выявлены артриты обоих коленных суставов и I плюснефалангового сустава справа. В области локтевого сустава слева отмечался тофус. Уровень мочевой кислоты был равен 640 ммоль/л, C-реактивного белка (СРБ) – 28 мг/л, скорость оседания эритроцитов (СОЭ) – 38 мм/ч. На фоне проводимой терапии (эторикоксиб по 90 мг/сут; аллопуринол в дозе, увеличенной до 300 мг/сут) признаки артрита были полностью купированы, уровень мочевой кислоты снизился до нормальных значений. При динамическом наблюдении (через 6 и 12 мес) отмечался стойко нормальный уровень мочевой кислоты (300–310 мкмоль/л на фоне постоянного приема аллопуринола по 50 мг).
В октябре 2017 г. после алкогольного эксцесса возникли боль и припухлость в коленных суставах и I плюснефаланговом суставе справа, в связи чем обратился к ревматологу. При осмотре выявлены артриты обоих коленных суставов и I плюснефалангового сустава справа. В области локтевого сустава слева отмечался тофус. Уровень мочевой кислоты был равен 640 ммоль/л, C-реактивного белка (СРБ) – 28 мг/л, скорость оседания эритроцитов (СОЭ) – 38 мм/ч. На фоне проводимой терапии (эторикоксиб по 90 мг/сут; аллопуринол в дозе, увеличенной до 300 мг/сут) признаки артрита были полностью купированы, уровень мочевой кислоты снизился до нормальных значений. При динамическом наблюдении (через 6 и 12 мес) отмечался стойко нормальный уровень мочевой кислоты (300–310 мкмоль/л на фоне постоянного приема аллопуринола по 50 мг).
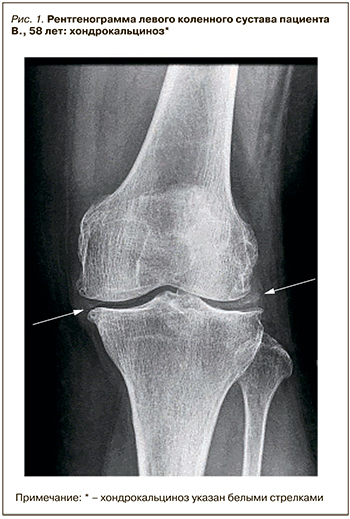
В ноябре 2018 г. без видимых причин (нарушение диеты, употребление алкоголя, дегидратацию пациент отрицает) на фоне сохраняющегося нормального уровня мочевой кислоты пациент отметил последовательное развитие артритов коленных суставов, затем левого плечевого сустава и суставов кистей. В связи с этим в декабре 2018 г. больной обратился на прием в Медицинский научно-образовательный центр МГУ им. М.В. Ломоносова. При осмотре выявлены артриты проксимальных межфаланговых суставов обеих кистей, обоих коленных суставов, плечевого сустава слева. При обследовании уровень мочевой кислоты составил 320 мкмоль/л, СРБ – 20 мг/л, СОЭ – 26 мм/ч. Число болезненных суставов – 8, припухших суставов – 6. С целью исключения дебюта ревматоидного артрита проведено иммунологическое исследование: уровни ревматоидного фактора (РФ) и антител к циклическому цитруллинированному пептиду оказались в норме. Также был проведена дифференциальная диагностика с ПАП: рентгенография коленных суставов выявила типичный признак ПАП – хондрокальциноз (рис. 1).
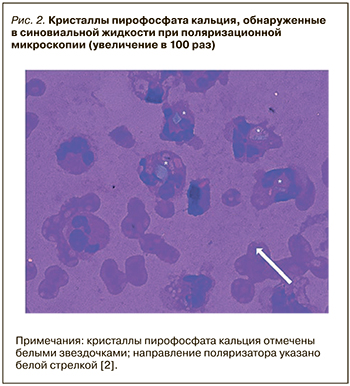 В результате повторного цитологического исследования суставной жидкости были обнаружены кристаллы пирофосфата кальция, кристаллы моноурата натрия не определялись (рис. 2).
В результате повторного цитологического исследования суставной жидкости были обнаружены кристаллы пирофосфата кальция, кристаллы моноурата натрия не определялись (рис. 2).
Таким образом, у пациента был выявлен второй микрокристаллический артрит – ПАП. Начата терапия колхицином в дозе 1 мг с дальнейшим увеличением до 1,5 мг, достигнут положительный эффект. В последующем назначен нимесулид (по 100 мг 2 раза/сут), омепразол (по 20 мг 1 раз/ сут). Через неделю на фоне проводимой терапии артрит был полностью купирован. При дальнейшем динамическом наблюдении в феврале 2019 г. артралгии пациента не беспокоили, приступов артрита зарегистрировано не было. СОЭ составила 18 мм/ч, СРБ – 4 мг/л, уровень мочевой кислоты – 310 мкмоль/л (на фоне приема аллопуринола по 50 мг/сут). В настоящее время продолжается динамическое наблюдение пациента.
ОБСУЖДЕНИЕ
Процесс установления диагноза – подагра и/или ПАП – нередко вызывает затруднение. Схожая симптоматика двух микрокристаллических артритов не позволяет основываться только на одной клинической картине заболевания: обе болезни проявляются острыми приступами артрита с выраженным болевым синдромом, отеком параартикулярных тканей, гиперемией и гипертермией кожного покрова над пораженными суставами. Кроме того, известно сочетание подагры и ПАП как между собой, так и с другими ревматологическими заболеваниями, что еще больше затрудняет процесс установки диагноза [1–5].
Трудность приведенного клинического случая при верификации диагноза заключалась как в схожести клинических проявлений ПАП и ранее установленной подагры (данных в пользу обострения которой получено не было), так и в симулировании ПАП клиники ревматоидного артрита (стойкие симметричные артриты обеих кистей, повышение сывороточного уровня СРБ), который в соответствии с диагностическими критериями АСR/EULAR 2015 г. подтвержден не был [5]. С учетом стойкой нормоурикемии, отсутствия данных в пользу ревматоидного артрита было предположено наличие у пациента еще одного заболевания, вызвавшего обострение. Согласно рекомендациям ACR/EULAR, решающее значение в диагностике микрокристаллических заболеваний имеет артроцентез с исследованием синовиальной жидкости для выявления кристаллов [1, 2, 6]. В результате обследования по данным цитологического исследования синовиальной жидкости были выявлены соли пирофосфата кальция, по данным рентгенографии коленных суставов – типичные признаки хондрокальциноза; это позволило установить диагноз «пирофосфатная артропатия. Подагра, хроническое течение. Подагрический артрит вне обострения».
ЗАКЛЮЧЕНИЕ
Диагностика широко распространенных микрокристаллических артритов до сих пор вызывает затруднение. Только использование современных методов диагностики (рентгеновского исследования суставов, УЗИ суставов и цитологического исследования синовиальной жидкости) и верификации сходных по клинической картине заболеваний позволит с высокой вероятностью установить точный диагноз у каждого пациента.



