В настоящее время проблема клапанных пороков сердца (КПС) приобретает все большее значение. Своевременное кардиохирургическое лечение пациентов с поражением клапана продлевает им жизнь и значительно улучшает ее качество, поздняя диагностика порока приводит к декомпенсации, а иногда к невозможности радикальной его коррекции. Традиционная ассоциация поражения клапанов с ревматической лихорадкой, а теперь еще с «дегенерацией» клапана, привела к тому, что терапевт и кардиолог не задумываются о нозологической принадлежности поражений клапанов, не помнят о других заболеваниях, приводящих к появлению КПС.
Терапевт должен иметь возможность диагностировать и направлять лечение большинства пациентов с КПС. Больные с клинически значимыми проявлениями порока (наличие жалоб, появление специфических симптомов) всегда должны рассматриваться в качестве кандидатов для кардиохирургического вмешательства. Более сложные решения могут потребоваться в случаях бессимптомного течения КПС, там, где имеется высокий риск операции, старческий возраст и т. д.
Аортальный стеноз (АС), или стеноз устья аорты, – сужение (обструкции) выходного отдела левого желудочка (ЛЖ). Существуют две основные причины АС неревматической этиологии: двухстворчатый аортальный клапан (АК) с последующей кальцификацией створок и возрастная кальцификация нормального трехстворчатого АК. В отличие от ревматической лихорадки, при которой происходит сращение створок по комиссурам с рубцеванием и дальнейшей прогрессирующей кальцификацией, при возрастном дегенеративно-кальцифицирующем процессе происходит иммобилизация створок АК. Кальцификация прогрессирует от основания створки до ее свободного края, в итоге вызывая уменьшение функциональной площади клапана, но не приводя к сращению по соответствующей комиссуре. При АС ревматической этиологии, как правило, имеется поражение митрального клапана (МК).
Двухстворчатый АК – часто встречающаяся врожденная аномалия сердца. В норме АК имеет 3 створки. Все они находятся в синусах Вальсальвы (коронарных синусах) – складках корня аорты, от которых отходят коронарные артерии, и называются соответственно: правая коронарная, левая коронарная и некоронарная створка АК. Двухстворчатый АК имеет только две створки почти равной величины. Чаще всего двухстворчатый АК не создает препятствия для выхода крови из ЛЖ сердца, и его выявляют случайно при ЭхоКГ исследовании. В этом случае говорят не о КПС, а об клапанной аномалии. В то же время двухстворчатый АК кальцифицируется чаще и раньше, чем трехстворчатый, в результате к 50–60-летнему возрасту возникает АС [1]. Интересно, что в отличие от кальциноза трехстворчатого АК, кальций начинает откладываться в комиссурах двухстворчатого АК. В последнее время мы видим несколько более позднюю кальцификацию двухстворчатого АК, развивающуюся к 70–75 годам жизни таких пациентов.
Очень важно помнить, что наличие двухстворчатого АК нередко наследуется вместе с другой аномалией сердечно-сосудистой системы – коарктацией аорты. Данное сочетание выявлено в 55,9% случаев коарктации аорты. Такая сочетанная врожденная патология чаще встречалась у пациентов мужского пола [2]. Следовательно, после выявления двухстворчатого АК во время ЭхоКГ исследования необходимо измерить артериальное давление на ногах у такого больного, чтобы не пропустить коарктацию аорты. Кроме того, у пациентов с двухстворчатым АК имеется аномалия соединительной ткани, что приводит к повышению частоты расслоения аорты. Больные с двухстворчатым АК относятся к группе среднего риска развития инфекционного эндокардита (ИЭ).
Необходимо также помнить, что кальцификация АК может происходить при хронической почечной недостаточности (в т.ч. при заместительной терапии программным гемодиализом), заболевании паращитовидных желез, после лучевой терапии (ЛТ) онкологических заболеваний, о чем будет подробней сказано ниже.
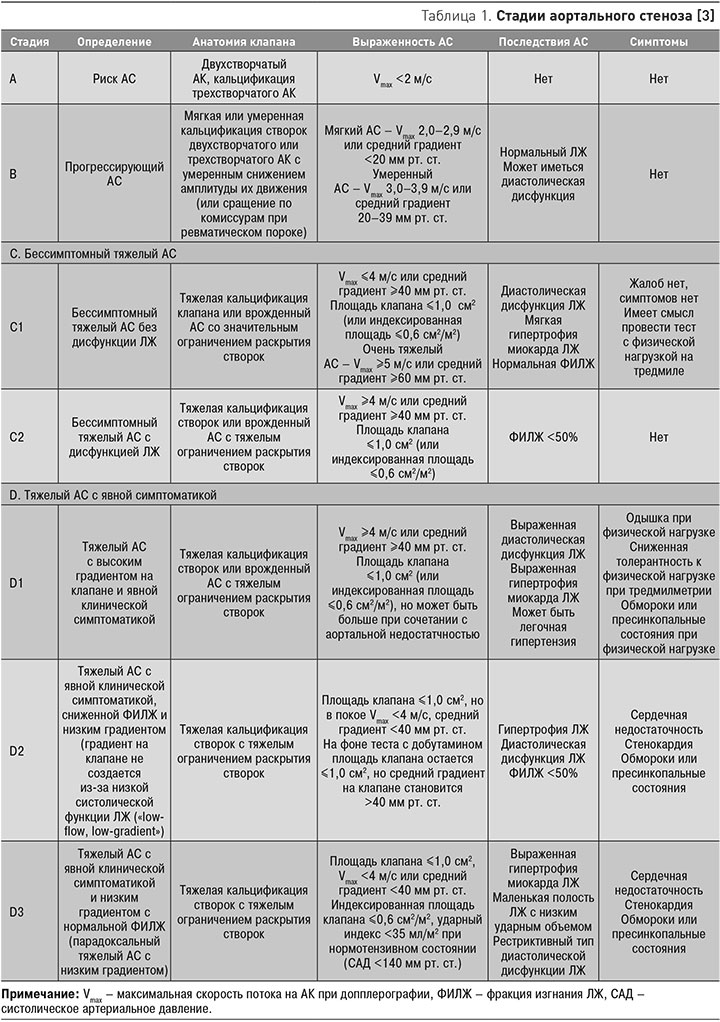
В соответствии с современными взглядами на течение АС, выделяют несколько его стадий (табл. 1).
АС любого происхождения – опасное заболевание. Его первым клиническим проявлением может стать внезапная смерть. Бессимптомный АС у пожилых может стать причиной тяжелых сердечно-сосудистых событий в течение 2-х лет после его выявления. Поэтому в ряде случаев принимается решение о кардиохирургическом лечении пациентов при отсутствии жалоб.
Диагностика АС кажется простой: необходимо выслушать во втором межреберье справа грубый шум изгнания с проведением на сосуды шеи, ослабленный второй тон и т.д., однако существуют состояния, которые затрудняют диагностику. Например, при артериальной гипертензии повышение давление в аорте может значительно уменьшить градиент на клапане (который представляет разницу давления между ЛЖ и аортой) и снизить интенсивность шума вплоть до его исчезновения. Поэтому имеет смысл у пожилых пациентов выслушивать сердце и после нормализации артериального давления.
Важно помнить, что при отсутствии жалоб у пациента с АС и нормальной ФИЛЖ в стадии B он должен обследоваться каждые 3–5 лет при мягком пороке (Vmax 2,0–2,9 м/с), каждые 1–2 года при умеренном АС (Vmax 3,0–3,9 м/с); в стадии С (Vmax ≥4 м/с) каждые 6–12 мес [3].
Аортальная недостаточность (АН; регургитация) возникает при неполном смыкании створок АК. Возникает при множестве заболеваний и у взрослых чаще всего не связана с ревматической лихорадкой. Причины АН неревматического происхождения:
- Хроническая АН:
- Сифилис.
- Аортиты при васкулитах (болезнь Такаясу, височный артериит и т. д.).
- Наследственные болезни соединительной ткана:
- а) синдром Марфана;
- б) синдром Элерса–Данло;
- в) синдром несовершенного остеогенеза.
- Врожденные пороки (аномалии) сердца:
- а) двухстворчатый аортальный клапана;
- б) высокий дефект межжелудочковой перегородки (синдром Эйзенменгера);
- в) аневризма синуса Вальсальвы.
- Аортиты, связанные с артритами:
- а) болезнь Бехтерева;
- б) синдром Рейтера;
- в) ревматоидный артрит;
- г) системная красная волчанка.
- Пузырчатый некроз срединного слоя аорты.
- Артериальная гипертензия.
- Миксоматозная дегенерация аортального клапана.
- Инфекционный эндокардит.
- Комбинированная с АС.
- Острая АН:
- Инфекционный эндокардит.
- Разрыв аневризмы синуса Вальсальвы.
- Диссекция аорты.
- Травма.
Изолированная АН встречается значительно реже, чем стеноз, нередко она сочетается с той или иной степенью АС.
В последнее время сифилис как причина АН встречается редко.
Синдром Марфана – наследственное заболевание, в основе которого лежит мутация гена фибриллина в 15-й хромосоме. Фибриллин синтезируется фибробластами и необходим для формирования микрофибриллярной сети во внеклеточном матриксе. Фенотипические проявления этого заболевания – высокий рост, удлиненные конечности и пальцы, гипермобильность суставов, деформация грудной клетки и т. д. Наиболее часто у таких больных обнаруживают прогрессирующее расширение корня аорты в области синусов Вальсальвы. В его основе лежит генетически обусловленный процесс с миксоматозной дегенерацией средней оболочки восходящей аорты. Возникает аннулоэктазия – расширение восходящей аорты и фиброзного кольца АК. Аортальная регургитация может быть выявлена при аускультации при выслушивании длинного протодиастолического шума и подтверждена ЭхоКГ исследованием. Следует помнить, что прогрессирующее расширение корня аорты может закончиться у больных синдромом Марфана ее разрывом и смертью. Поэтому при достижении диаметра аорты 45 мм при любой степени АН больного с синдромом Марфана следует направлять на кардиохирургическое лечение.
Синдром Элерса–Данло меньше известен врачам, чем синдром Марфана, наследуется как по аутосомно-доминантному, так и по аутосомно-рецессивному типу. При этом выявлено нарушение синтеза 3-х (I, III и V) из 20 известных типов коллагеновых белков. В настоящее время описано 9 вариантов фенотипа этого синдрома. Для него также характерно расширение корня аорты и множество других аномалий сердечно-сосудистой системы.
Неспецифический аортоартериит (артериит Такаясу) – прогрессирующее гранулематозное воспаление аорты и ее основных ветвей. Наиболее предрасположены к заболеванию молодые женщины. Характеризуется многообразной клинической симптоматикой.
Гигантоклеточный артериит – гранулематозный артериит основных ветвей аорты, преимущественно экстракраниальных ветвей сонной артерии с частым поражением височной артерии. Обычно начинается у больных старше 50 лет и часто сочетается с ревматической полимиалгией. Может поражать все артерии крупного и среднего калибра, но наиболее часто – височную артерию. Сопровождается резкими болями в височной области, при этом височная артерия выбухает, становится жесткой. В этот момент, до начала лечения, ее необходимо биоптировать. Выявляется васкулит с преимущественно мононуклеарной инфильтрацией или гранулематозным воспалением, обычно с многоядерными гигантскими клетками.
Неспецифический аортоартериит (артериит Такаясу) и гигантоклеточный артериит, представляющие васкулиты, способны поражать аорту и ее ветви. В части случаев возникают аортиты, диссекция аорты, у части больных – типичная АН.
Аортиты встречаются и у больных серонегативными артритами. К числу последних относятся идиопатический анкилозирующий спондилоартрит (болезнь Бехтерева) и уретроокулосиновиальный синдром (синдром Рейтера). При обоих заболеваниях возможно развитие аортита с ретроградным распространением процесса на АК и развитием АН. Это бывает не так редко, но практические врачи плохо знают об этом. Такое же поражение аорты и АК возможно при псориатическом спондилите. Поражение АК у таких больных может быть тяжелым и требовать протезирования.
Острое развитие АН возможно при нескольких заболеваниях:
• Аневризма синуса Вальсальвы представляет собой врожденную аномалию развития аорты – выпячивание аневризматического мешка, чаще всего правого коронарного или некоронарного синуса, в соседнюю камеру сердца, в просвет правого желудочка или правого предсердия. Примерно к 30–40-м годам у части больных происходит разрыв аневризмы синуса Вальсальвы, происходит массивный сброс из аорты в эти камеры. Резко увеличивается приток крови в легкие из правого желудочка, как результат резко возрастает приток крови к ЛЖ сердца. Левые отделы сердца неспособны сразу прокачать такое количество крови, что приводит к отеку легких. У части пациентов при разрыве синуса Вальсальвы створка АК затягивается в образовавшееся отверстие и возникает острая аортальная регургитация. Симптоматика напоминает инфаркт миокарда с острой сердечной недостаточностью. Над сердцем выслушивается громкий машинный шум и шум АН.
 • Инфекционный эндокардит аортального клапана. Стафилококковый ИЭ способен очень быстро разрушить любой клапан. При поражении АК и АН возникает протодиастолический шум, который может быть относительно ранним и типичным признаком заболевания. Клиническая картина ИЭ складывается из многих достаточно разнообразных симптомов, поэтому для диагностики этого заболевания создана шкала критериев. Шкала эта постоянно совершенствуется и изменяется, в последних Европейских рекомендациях по диагностике и лечению этого заболевания предлагаются инструментальные критерии, выявление которых в нашей стране пока не осуществимо. В табл. 2 представлены критерии университета Дюка предыдущей модификации.
• Инфекционный эндокардит аортального клапана. Стафилококковый ИЭ способен очень быстро разрушить любой клапан. При поражении АК и АН возникает протодиастолический шум, который может быть относительно ранним и типичным признаком заболевания. Клиническая картина ИЭ складывается из многих достаточно разнообразных симптомов, поэтому для диагностики этого заболевания создана шкала критериев. Шкала эта постоянно совершенствуется и изменяется, в последних Европейских рекомендациях по диагностике и лечению этого заболевания предлагаются инструментальные критерии, выявление которых в нашей стране пока не осуществимо. В табл. 2 представлены критерии университета Дюка предыдущей модификации.
Важно внимательно выслушивать сердце у пациентов с длительной непонятной лихорадкой, вовремя производить ЭхоКГ обследование больного. Это поможет выявить инфекционный эндокардит и начать вначале эмпирическое лечение антибиотиками.
• Диссекция аорты различного генеза представляет собой разрыв интимы и/или медиального слоя аорты с проникновением крови между ее слоями с образованием ложного просвета. При поражении восходящей аорты возникает разрыв фиброзного кольца АК и острая АН. Клиническая картина диссекции многообразна, но, как правило, манифестирует сильнейшими болями в грудной клетке с иррадиацией в позвоночник. Острая аортальная регургитация, вызванная расслоением аорты, – экстренная хирургическая ситуация, требующая немедленной диагностики и оперативного вмешательства. В этом случае показано экстренное проведение чреспищеводной ЭхоКГ либо мультиспиральной компьютерной или магнитно-резонансной томографии сердца.
При развитии острой клапанной АН многие характерные для хронической аортальной регургитации физикальные данные могут отсутствовать, что может привести к недооценке ее тяжести. Размер ЛЖ может быть нормальным. Пульсовое давление часто не повышено, т.к. систолическое давление снижено, а диастолическое давление в аорте уравновешивается повышенным диастолическим давлением в ЛЖ. По этой причине разница в показателях диастолического давления между аортой и ЛЖ может сохраняться до окончания диастолы, диастолический шум может быть коротким и мягким и потому плохо слышен. Повышенное диастолическое давление в ЛЖ приводит к преждевременному закрытию МК и уменьшению интенсивности I тона. Диастолическое дрожание на верхушке может обнаруживаться; как правило, оно непродолжительное. Обычно присутствует тахикардия. В этих случаях незаменимым методом исследования является ЭхоКГ. С ее помощью определяют наличие и тяжесть клапанной регургитации, этиологию аортальной регургитации.
• Митральный стеноз (стеноз левого атривентрикулярного отверстия). Чаще всего бывает следствием перенесенной ревматической лихорадки. Митральный стеноз (МС) неревматического генеза чаще всего врожденный, встречается редко. Такой врожденный КПС характеризуется неправильно сформированными створками или наличием мембраны над створками МК. Часто сочетается с другими врожденными аномалиями сердца. Редко встречающееся сочетание – синдром Лютембахера (дефект межпредсердной перегородки в сочетании с МС).
Диагностика МС основана на аускультации, при которой в области верхушки сердца выслушивается усиленный («хлопающий») I тон сердца, тон открытия МК, ранний мезодиастолический и пресистолический шумы. Усиленный I тон возникает в тот период болезни, когда створки МК еще гибкие. Отчасти «хлопающий» I тон является следствием быстрого сокращения недозаполненного ЛЖ и более быстрым, чем в норме закрытием створок МК. Кальцификация аппарата МК приводит к исчезновению этого феномена. Рост давления в легочной артерии приводит к появлению на ней акцента II тона, который хорошо выслушивается и в других точках. Также возникает расщепление II тона за счет более медленной систолы гипертрофированного правого желудочка сердца. Как и при других КПС, ЭхоКГ исследование ставит точки над «i». МС имеет достаточно характерные ЭхоКГ черты, с помощью этого метода определяется характер поражения клапана, диастолический градиент на нем, объемы полостей и т. д.
• Митральная недостаточность (МН; регургитация) представляет собой неспособность МК предотвратить обратный ток крови в систолу из ЛЖ в левое предсердие. Гемодинамически значимая митральная регургитация характеризуется пансистолическим (голосистолическим) шумом, выслушиваемом на верхушке сердца и проводящимся в левую подмышечную область. Первичная МН может быть следствием многих заболеваний:
- Хроническая МН:
- воспалительные процессы (ревматическая лихорадка, системная красная волчанка, васкулиты);
- врожденные или наследственные заболевания (синдромы Марфана, Элерса–Данло, миксоматозная дегенерация, врожденные пороки с расщеплением митральной створки, «парашютный» клапан);
- кальциноз фиброзного кольца МК;
- инфекционный эндокардит;
- врожденная патология створок МК (расщепление, фенестрация);
- карциноидный синдром;
- ЛТ при онкологических заболеваниях.
- Острая МН:
- разрыв сухожильных хорд МК (ИЭ, травма, миксоматозная дегенерация);
- поражение папиллярных мышц (дисфункция или разрыв при остом инфаркте миокарда);
- разрыв створок МК при ИЭ или во время комиссуротомии;
- патология фиброзного кольца МК – абсцесс при ИЭ.
Анализируя эти данные, можно заметить, что многие причины, вызывающие хроническую МН, аналогичны причинам, вызывающим хроническую аортальную регургитацию. Важно отметить, что среди воспалительных заболеваний фигурируют не только ревматическая лихорадка, но и васкулиты, системная красная волчанка, о чем необходимо помнить. Очень частая причина МН различной выраженности – кальциноз фиброзного кольца МК. Это хронический дегенеративный процесс, который обычно выявляется у пожилых и, по данным литературы, чаще поражает женщин. Часто он не приводит к тяжелому нарушению функции клапана, но иногда развивается гемодинамически значимая митральная регургитация.
У части больных кальциноз фиброзного кольца МК возникает в составе общего кальциноза внутренних структур сердца. Чаще такие изменения возникают у больных хронической почечной недостаточностью, получающих заместительную терапию программным гемодиализом.
Возникновение острой митральной регургитации по указанным выше причинам всегда протекает с тяжелой симптоматикой: с развитием интерстициального, а часто альвеолярного отека легких. Об этом следует помнить, например, если у больного с гипертоническим кризом первый раз в жизни развивается отек легких. Внимательная аускультация в таких случаях выявляет грубый пансистолический шум на верхушке сердца, и это часто бывает манифестацией разрыва хорд МК при быстром и резком подъеме артериального давления. Эти больные после стабилизации состояния должны быть отправлены к кардиохирургу.
Одним из пунктов перечня причин МН является ЛТ при онкологических заболеваниях. Последнее время проблеме поражений сердца при лечении опухолей придается большое значение. Развитие патологии клапанов сердца нередко связано с проведением ЛТ на область средостения. Для излеченных от онкологического заболевания пациентов отдаленная постлучевая патология сердца становится важной проблемой, которая ухудшает качество жизни и увеличивает риск сердечной смертности спустя 10 лет и более после проведения ЛТ [4]. Диагностирование таких нарушений не стандартизировано на международном уровне и представляет сложности в силу длительного временного разрыва между проведением ЛТ и развитием клапанной патологии. Терапевты и кардиологи плохо знакомы с этой проблемой и часто не учитывают наличия химиолучевой терапии в анамнезе больных с патологией клапанного аппарата. Несмотря на использование в настоящее время щадящих режимов радиотерапии, постлучевое поражение клапанов сердца является одной из важнейших проблем современной медицины, приводит к ухудшению качества жизни и увеличивает риск сердечной смертности [4, 5]. В основе лучевого поражения клапанов лежит кальцификация створок и фиброзного скелета сердца. Механизм развития постлучевых повреждений полностью не ясен. Предполагается, что ЛТ приводит к эндотелиальному повреждению с пролиферацией гладкомышечных клеток и развитием периваскулярного фиброза [6].
На частоту развития и характер лучевых повреждений оказывают влияние условия проведения ЛТ: величина суммарной очаговой дозы, поля воздействия, точность планирования, объем здоровых тканей, подвергшихся облучению и т.д. [7–9]. Определяющим фактором развития постлучевого поражения клапанов сердца является доза облучения, которая не должна превышать 30 Гр. Кроме того, очень важен объем сердца, попавшего в зону облучения, – клапанная патология сердца закономерно возникает после ЛТ, когда облучению подвергается 65% объема сердца и более [10].
Клинически явным постлучевое поражение клапанов становится примерно через 5 лет после воздействия. При этом распространенность увеличивается со временем, прошедшим после ЛТ [11]. Постлучевое клапанное поражение приводит к развитию краевого кальциноза клапана с дальнейшим формированием КПС. Чаще поражаются МК и АК с развитием как недостаточности, так и стеноза, нередко развивается трикуспидальная регургитация [12]. Клинически постлучевая клапанная дисфункция чаще всего проявляется застойной сердечной недостаточностью и одышкой, при этом трудно выделить относительный вклад клапанного поражения и сопутствующей рестриктивной кардиомиопатии. В дополнение нередко достаточно выражен рецидивирующий плевральный выпот, который может вместе с нарушением функции легких играть большую роль в возникновении одышки. Таким образом, одышка у этих больных чаще всего является многофакторной проблемой [13].
Лечение таких больных представляет трудную задачу в связи с тем, что поражение клапанов возникает одновременно с множественными сердечными и несердечными проявлениями, вызываемыми облучением. Кардиохирургическое лечение больных с постлучевым поражением клапанов должно проводиться с осторожностью, прежде всего потому, что обратимость симптоматики может быть неполной из-за наличия рестриктивной кардиомиопатии и застойной сердечной недостаточности, а также нарушения функции легких. Периоперационный риск у этих больных резко возрастает из-за поражения сердца и внекардиальных поражений, включающих кальцификацию аорты и поражение других органов. Кальцификация аорты и ее корня может создать существенные трудности даже при первичной операции по замене АК, а недостаточное расширение корня аорты может ограничить размер протеза, который может быть внедрен. Повторная операция у пациентов с облучением средостения чрезвычайно трудна из-за тяжелых спаек средостения. Кроме того, необходимо учитывать, что пациенты перед операцией могут иметь существенный риск тяжелых постлучевых поражений коронарных артерий, которые очень трудны для реваскуляризации. Поэтому показанием к кардиохирургической операции должно быть очень тяжелое поражение клапана (или клапанов), значительно снижающее качество жизни и создающее угрозу преждевременной смерти пациента. Профилактикой этих осложнений является назначение невысокой лучевой нагрузки – не выше 20–30 Гр при облучении лимфоузлов средостения [10].
Техническое усовершенствование радиотерапевтической аппаратуры, развитие клинической дозиметрии, разработка предлучевой топометрии с использованием компьютерной техники служат основой повышения эффективности ЛТ при лечении опухолей. Наличие в рамках предлучевой топометрии рентгеносимулятора, компьютерного томографа, возможность использования магнитно-резонансного и позитронного эмиссионного томографа позволяют весьма точно определить границы мишени, подлежащей облучению. Предлагается также проводить синхронизацию ЛТ с дыханием, что позволяет уменьшить дозу ионизирующего излучения в органах риска (сердце и легкие) и тем самым снизить вероятность развития лучевых осложнений [14]. Таким образом, постлучевое поражение клапанов сердца является одной из самых трудных проблем лечения, и ранняя диагностика становится важнейшей задачей современной медицины.
ЛЕЧЕНИЕ КЛАПАННЫХ ПОРОКОВ СЕРДЦА
Концепция лечения приобретенных и врожденных КПС исходит из того, что при наличии клинических проявлений заболевания их радикальная коррекция возможна только с помощью хирургических методов. Исследования естественного течения митрального порока сердца показали, что он приводит к развитию сердечной недостаточности, инвалидизации и быстрой смерти больных. Средняя продолжительность жизни пациентов с АС после начала коронарной симптоматики или приступов синкопальных состояний составляет примерно 3 года, а от начала проявлений застойной недостаточности кровообращения – около полутора лет. Хирургическое лечение КПС является эффективным средством выбора, призванным улучшить состояние больного, а нередко и спасти его от смерти. В нашей стране из-за позднего обращения больных, когда пораженные клапаны уже грубо изменены, в большинстве случаев производится их протезирование. Пациенты после замены пораженного клапана на искусственный должны состоять на динамическом учете у кардиолога. Согласно рекомендациям ESC по ведению пациентов с клапанными болезнями сердца, в течение 12 нед от момента замены клапана пациент должен наблюдаться у специалиста с целью контроля витальных функций и проведения инструментально-лабораторных исследований: ЭКГ, ЭхоКГ, рентгенологическое исследование органов грудной клетки, параметры коагулограммы.
Тем не менее во многих случаях такие пациенты попадают на прием к терапевту. Поэтому ему надо знать основные положения, касающиеся больных, перенесших протезирование клапана. Особенного внимания требуют пациенты с установленным механическим искусственным клапаном, поскольку наличие биологического протеза в ряде случаев не требует приема антикоагулянтов.
Динамическое наблюдение за пациентом после протезирования клапанов должно начинаться сразу после выписки из кардиохирургического стационарна. Диспансерное наблюдение проводится первые 6 мес – 2 раза в мес, следующий год – 1 раз в мес, затем – 1 раз в 6 мес, далее 1 раз в год, желательно в те же сроки проводить ЭхоКГ исследование. Все последующие данные ультразвукового исследования сердца (градиент на протезе, размеры и объемы полостей сердца, показатели насосной функции ЛЖ и т.д.) должны сопоставляться с показателями первой послеоперационной ЭхоКГ. Поэтому первые послеоперационные клинические, лабораторные и инструментальные данные должны быть скрупулезно вписаны в историю болезни и амбулаторную карту. При низкой информативности трансторакальной ЭхоКГ должна быть произведена чреспищеводная.
Перед врачом-кардиологом и/или терапевтом, к которому обратился больной с искусственным клапаном (или искусственными клапанами) сердца, встает ряд задач:
- Мониторирование состояния свертывающей системы крови в связи с постоянным приемом непрямых антикоагулянтов.
- Динамическое наблюдение за функцией протезированных клапанов для ранней диагностики ее нарушений и выявления осложнений отдаленного периода после протезирования.
- Коррекция состояний, непосредственно связанных с наличием протеза клапана.
- Своевременное выявление у больного с протезированным клапаном нового порока неоперированного клапана (или усугубление ранее существовавшего его умеренного порока).
- Коррекция сердечной недостаточности и нарушений сердечного ритма (если они возникают).
- Лечение заболеваний, не связанных с протезированием или связанных с ним косвенно.
- Ранняя (по возможности) диагностика осложнений, возникающих в позднем послеоперационном периоде.
В задачи кардиолога и/или терапевта входит регулярная аускультация сердца и выслушивание мелодии протеза. Это крайне необходимо, поскольку позволяет своевременно выявить дисфункцию искусственного клапана и/или появление нового порока неоперированного клапана. Наличие механического искусственного клапана сердца проявляется хорошо выслушиваемым отчетливым щелчком закрытия его запирательного элемента (иногда это щелчок слышен невооруженным ухом на расстоянии от больного). Грубых шумов не должно выслушиваться. Снижение интенсивности звука щелчка, особенно на недавно установленном механическом протезе, должно насторожить врача. Появление грубого шума может свидетельствовать о дисфункции протеза клапана, и это должно выявляться при аускультации. Звуковые феномены, выслушиваемые на сердце больного с биологическим протезом (протезами) клапанов, не отличается от таковых нативного клапана.
Основным методом исследования функции искусственного клапана является ЭхоКГ, и больной с искусственными клапанами должен обследоваться в те сроки диспансерного наблюдения, которые нами указаны выше. Однако при выявлении измененной мелодии протеза больной должен быть направлен на ЭхоКГ обследование немедленно.
Дисфункция протеза проявится изменением звука закрытия запирательного элемента механического клапана и появлением патологических шумов. Никогда не следует забывать о наличии искусственного клапана у пациента! Появление лихорадки у такого больного может означать наличие у него простого ОРЗ или пневмонии, но может быть проявлением ИЭ протеза. Протезный эндокардит является серьезным осложнением после имплантации искусственных механических клапанов. Уровень смертности от этого заболевания достигает 80%. Протезный эндокардит может быть причиной как патологической регургитации, так и патологического стеноза клапанных отверстий. Аускультация сердца и мелодии протеза клапана должна быть особенно тщательной при повышении температуры тела у таких больных.
Постоянный прием антикоагулянтов является обязательным, а возможно главным пунктом лекарственной терапии пациентов после замены клапана сердца на искусственный механический. С этой целью в России чаще всего назначается непрямой оральный антикоагулянт варфарин (кумарин), эффективность и безопасность которого изучена достаточно подробно. Его должны принимать практически все пациенты с механическими искусственными клапанами. Обычно доза варфарина в соответствии с целевым уровнем МНО 2,0–3,0/2,5–3,5 в зависимости от модели механического протеза подбирается еще в стационаре после кардиохирургической операции. Все больные (с механическими и биологическими протезами клапанов) первые 3 мес после операции должны получать антикоагулянты с МНО 2,5–3,5. Больные с механическими искусственными клапанами должны принимать непрямые антикоагулянты всю оставшуюся жизнь и не должны переводиться на новые оральные антикоагулянты. Пациенты с биологическими искусственными клапанами через 3 мес после операции могут получать антикоагулянтную терапию так же, как и в популяции: по поводу фибрилляции предсердий, в т.ч. новые оральные антикоагулянты.
Рамки статьи не позволили нам рассказать о всех нюансах этой интереснейшей патологии. Все же мы надеемся привлечь внимание практических врачей-терапевтов к этим часто встречающимся болезням клапанов сердца и необходимости правильного определения их нозологической принадлежности, что часто определяет правильный подход к лечению.



