Острые респираторные вирусные инфекции (ОРВИ) – широко распространенная группа острых воспалительных заболеваний органов дыхания, встречающаяся у лиц всех возрастов и характеризующаяся различными по форме и тяжести клиническими проявлениями. Несмотря на активное развитие медицины, ОРВИ и в настоящее время остается одной из актуальных и приоритетных проблем мирового здравоохранения, занимая ведущую позицию в структуре заболеваемости населения. В этой группе объединены патологические состояния с похожими клиническими признаками, обусловленными эпителиотропностью возбудителей, но с чрезвычайно разнообразной этиологией [1].
Современная медицина располагает множеством фармакологических препаратов, применяемых для лечения вирусных инфекций верхних дыхательных путей. Существенной особенностью лечения ОРВИ в России является бесконтрольное применение и продажа иммуномодулирующих средств, которых для профилактики и лечения ОРВИ зарегистрировано в нашей стране более сотни; к сожалению, без учета принципов доказательной медицины. Рост продаж иммуномодулирующих препаратов составляет 38% в год. При этом механизм действия этих лекарственных средств описан не полностью, или же в фармакодинамическом описании его, по сути, нет, а вместо этого приводится фраза о том, что «препарат обладает комплексным иммуномодулирующим, антиоксидантным действием, принимая участие в стимуляции антителообразования и синтеза разных видов интерферонов» [2].
В настоящий момент наблюдаются достаточно противоречивые сведения о сочетанных или изолированных изменениях локального и системного иммунитета при воспалительной патологии ЛОР-органов. При этом оториноларингологи в нашей стране в последнее время активно включают в схемы лечения разные иммуномодулирующие препараты при хроническом тонзиллите [3], полипозном риносинусите [5], хроническом ларингите, аденоидите, фарингите [6]. Однако при описании клинического эффекта того или иного препарата в оториноларингологии полноценных иммунологических исследований до и после окончания лечебных мероприятий не проводилось.
Лечение острых ринофарингитов на фоне ОРВИ проводится врачами общей практики, терапевтами, педиатрами, оториноларингологами. Основным принципом их терапии служит уменьшение тяжести клинических симптомов, профилактика развития осложнений и проявлений отдаленных отрицательных эффектов после перенесенного заболевания. Имеется много данных об использовании иммуномодуляторов при вирусных инфекциях [6, 7]. Для примера: в системе детских поликлиник Управления делами Президента РФ иммунотропные лекарственные средства при острых воспалительных заболеваниях верхних дыхательных путей назначались в 12,4% случаев [8]. Между тем вопрос назначения этих препаратов остается дискутабельным. Также не было найдено подтверждений наличия нарушений системного иммунитета у пациентов в начале заболевания ОРВИ, исключая больных с подтвержденным врожденным или приобретенным иммунодефицитом.
Цель исследования – изучить показатели местного и системного иммунитета у больных острым назофарингитом с интоксикационным синдромом в начальной стадии заболевания.
МАТЕРИАЛ И МЕТОДЫ
Проведено иммунологическое исследование 94 пациентов (36 мужчин и 58 женщин, средний возраст 37,8±12,2 лет), страдающих острым назофарингитом (ОНФ) с интоксикационным синдромом. Обследование выполнялось в день обращения пациента до начала лечения.
Критериями включения в исследование было наличие на момент обращения жалоб, симптомов и типичных признаков ОНФ при объективном осмотре и повышения температуры тела выше 37,1 °C. Наблюдалось острое начало заболевания с повышением температуры, наличием симптомов интоксикации в виде головной боли, миалгии или артралгии, слабости. Катаральные явления проявлялись в виде признаков воспаления слизистой оболочки носа, ротоглотки, гортани и трахеи и жалоб на першение, сухость задней стенки глотки, боль при глотании, сухой кашель, заложенность носа, чихание (87,23%), выделения из носа серозно-слизистого характера. Все пациенты были включены в исследование на 1-й или 2-й день от начала заболевания при условии отсутствия лечения к моменту обращения в Городскую клиническую больницу № 40 г. Екатеринбурга.
Основными критериями невключения в исследование служили возраст менее 18 лет, хронические воспалительные заболевания ЛОР-органов, наличие налетов на слизистой оболочке нёбных миндалин, респираторная аллергия, беременность, лечение иммуномодулирующими препаратами и антибиотиками в сроки менее чем за 3 мес до включения пациента в исследование, присутствие онкозаболеваний и аутоиммунной патологии. Для оценки выраженности катарального синдрома и морфологических изменений слизистой оболочки ЛОР-органов проводились эндоскопическое исследование полости носа, фарингоскопия, непрямая ларингоскопия и отоскопия.
Для иммунологического исследования у пациентов брали натощак венозную кровь. Методом проточной цитофлюориметрии на цитометре FACS Canto II (Becton Dickinson) в лаборатории клинической иммунологии Клинико-диагностического центра г. Екатеринбург осуществлялось иммунофенотипирование лимфоцитов с использованием пар моноклональных антител CD3-FITC/CD19-PE, CD3-FITC/CD4-PE, CD3-FITC/CD8-PE, CD3-FITC/CD16+56-PE (IO Test). Бактерицидную активность лейкоцитов оценивали с применением метода, разработанного в лаборатории клинической иммунологии Института иммунологии Минздрава России [9]. Лейкоциты выделяли в 3% растворе желатина в фосфатно-солевом буфере (PBS). В опытную лунку вносили 90 мкл живых ФИТЦ-меченых бактерий (St. aureus Cowan I), 20 мкл аутосыворотки и 90 мкл лейкоцитов в концентрации 2 млн в 1 мл. Смесь инкубировали 20 мин при 37 °С, лейкоциты осаждали в течение 1 мин при 200g, 2 раза отмывали PSB от несвязавшихся бактерий, ресуспендировали в 200 мкл PSB и инкубировали 1 ч при 37 °С. После остановки киллинга лейкоциты разрушали в течение 5–10 мин 0,2% раствором сапонина; бактерии осаждали центрифугированием при 1000g в течение 10 мин и ресуспендировали в 200 мкл PSB с 2,5 мкг пропидиума иодита (Sigma), окрашивающего только убитые клетки. Через 30–40 мин пробы анализировали на проточном цитометре FACScan (Becton Dickinson).
Функционирование НАДФ-оксидазной системы нейтрофилов изучали при помощи спонтанного и стимулированного НСТ-теста [10]. Состояние гуморального иммунитета оценивалось определением концентрации сывороточных иммуноглобулинов IgG, IgM, IgA в сыворотке крови методом радиальной иммунодиффузии (РИД) в агаре по Mancini с использованием моноспецифических и стандартных сывороток с известной концентрацией иммуноглобулинов производства Московского НИИ им. Гамалея. Содержание циркулирующих иммунных комплексов (ЦИК) определяли фотометрически после преципитации их 4% раствором полиэтиленгликоля-6000.
В сыворотке крови и носовой слизи оценивали содержание интерлейкинов (ИЛ)-1β, ИЛ-6, ИЛ-8, интерферона (ИФН)-α твердофазным иммуноферментным методом (ИФА) с использованием реактивов фирмы ООО «Цитокин» (г. Санкт-Петербург). Назальный секрет собирали на смоченный изотоническим раствором 0,9% натрия хлорида ватный тупфер, который помещали в средний носовой ход на 30 с, затем ватку переносили в пластиковую микропробирку с физиологическим раствором в объеме 0,75 мл и замораживали при температуре -70 °C. Перед исследованием производили быстрое размораживание. Пробирки центрифугировали в течение 10 мин при 1500 об./мин, в дальнейшем работали с надосадочной жидкостью. Определение секреторного иммуноглобулина класса A (sIgA) в слизистой оболочке носа выполняли с помощью тест-системы «IgA секреторный-ИФА-БЕСТ» серии А-8668 производства г. Новосибирск методом твердофазного ИФА с использованием моноклональных анти-IgА-антител, который входит в пероксидазный конъюгат, способный выявлять антитела, аффинно взаимодействующие с аллергенами, сорбированными на поверхности полистиролового планшета. Для группы контроля были взяты образцы носовой слизи 20 здоровых добровольцев, не имевших в момент взятия материала воспалительных явлений, не отличавшихся по полу и возрасту от группы пациентов с ОНФ и не соответствовавших критериев исключения.
Математическая обработка данных осуществлялась с использованием программы IBM SPSS Statistics 23.0. Все количественные признаки тестировали на соответствие их нормальному распределению (критерии Колмогорова и Шапиро–Уилка). Параметрические данные описаны в виде среднего значения и среднего квадратичного отклонения (±), непараметрические выражены через медиану с 25-м и 75-м процентилями. Для сравнения распределений числовых показателей в двух сравниваемых группах использовали дисперсионный анализ и непараметрический критерий Манна–Уитни.
РЕЗУЛЬТАТЫ
У всех пациентов с ОНФ в день обращения частота встречаемости проявлений интоксикационного синдрома была следующей: повышение температуры тела выше 38,0 °С наблюдалось в 54,22% (n=51), головная боль – в 88,3% (n=83), миалгия и артралгия – в 67,02% (n=63), слабость, чувства недомогания – в 97,82% (n=92) случаев. Из проявлений острого ринита на заложенность носа жаловались 84 человека (89,36%), ринорея отмечалась в 92,55% (n=87), чихание в 87,23% (n=82) случаев. Боль при глотании, першение, сухость задней стенки глотки встречались у 88,3% (n=83), мучительный сухой кашель – у 64% (n=60) человек.
При оценке системного иммунного статуса выявлено, что у большинства больных при обращении в первые 2 дня заболевания не было отклонений в лабораторных показателях от общепринятых норм, за исключением снижения относительного числа цитотоксических Т-лимфоцитов (CD3+CD8+), стимулированного НСТ-теста или теста с нитросиним тетразолием, определяющего фагоцитарную активность гранулоцитов, и увеличения фагоцитарной активности моноцитов (табл. 1). Это подтверждает результаты других исследований о незначительной амплитуде отклонений от нормы параметров системного гуморального и клеточного иммунитета при большинстве острых воспалительных заболеваний ЛОР-органов, особенно в тех случаях, когда патологический процесс не выходит за пределы слизистых оболочек [11].

Считается, что наиболее информативным в этом случае является изучение показателей локального иммунного статуса. Поскольку исследование цитокинов в выделениях из носа рекомендовано при различных формах ринита и острых респираторных инфекциях [12], нами был проведен анализ содержания провоспалительных цитокинов ИЛ-1b, ИЛ-6, ИЛ-8 и главных факторов врожденного иммунитета – ИФН-α и sIgА – в носовой слизи среднего носового хода. Для стандартизации пирогаллоловым методом определяли количество общего белка в образцах назальной слизи, затем пересчитывали содержание цитокинов на концентрацию белка 1 мг/мл. В начале инфекционного процесса в носовой слизи пациентов с ОНФ, по сравнению с группой здоровых добровольцев, было обнаружено низкое количество ИФН-α и sIgА и повышенное количество всех исследуемых нами провоспалительных цитокинов (табл. 2).

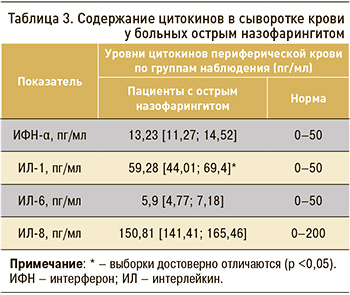 При изучении аналогичного спектра провоспалительных цитокинов и ИФН-α в сыворотке крови все показатели были в пределах общепринятых нормативных значений, кроме провоспалительного цитокина ИЛ-1b, который был повышен (табл. 3). Это логично объясняется наличием интоксикационного синдрома с повышением температуры тела выше 37,1 °C у всех пациентов, включенных в исследование. Полученные данные еще раз подтверждают общепринятое мнение, что исследование цитокинов сыворотки крови при воспалительной патологии слизистой верхних дыхательных путей не имеет большого значения. Поскольку основу патологического процесса составляет местное воспаление слизистой оболочки, диагностическую ценность имеют цитокины непосредственно из очага поражения.
При изучении аналогичного спектра провоспалительных цитокинов и ИФН-α в сыворотке крови все показатели были в пределах общепринятых нормативных значений, кроме провоспалительного цитокина ИЛ-1b, который был повышен (табл. 3). Это логично объясняется наличием интоксикационного синдрома с повышением температуры тела выше 37,1 °C у всех пациентов, включенных в исследование. Полученные данные еще раз подтверждают общепринятое мнение, что исследование цитокинов сыворотки крови при воспалительной патологии слизистой верхних дыхательных путей не имеет большого значения. Поскольку основу патологического процесса составляет местное воспаление слизистой оболочки, диагностическую ценность имеют цитокины непосредственно из очага поражения.
ОБСУЖДЕНИЕ
Устойчивость организма человека к различным респираторным инфекционным агентам – многофакторный феномен. Факторы врожденного и приобретенного иммунитета тесным образом взаимосвязаны и дополняют друг друга, в конечном итоге представляя собой лишь отдельные звенья защитного механизма, каким является противоинфекционный иммунитет. Иммунные механизмы не только обусловливают общую резистентность организма к инфекциям, но и в существенной мере определяют местную тканевую защиту на уровне слизистых оболочек. К факторам первой линии защиты слизистых оболочек относятся постоянное движение ресничек цилиндрического эпителия, лектины С-типа (конаглютинин, маннозосвязывающий белок, белки А и D сурфактанта), лизоцим, sІgА, ИФН и многие другие вещества, которые содержатся в секрете дыхательных путей. Их действие продолжается на протяжении всего периода борьбы с инфекцией, но наиболее эффективно они работают в течение первых 4 ч после внедрения вируса, когда они выступают практически единственными защитниками организма [13, 14].
Иммунная система организма всегда реагирует на внедрение микроорганизмов местной воспалительной реакцией, а при ее неэффективности – развитием системного острофазового ответа. ИФН-α формирует защитный барьер на пути вирусов намного раньше специфических защитных реакций иммунитета, стимулируя клеточную резистентность и делая клетки непригодными для размножения вирусов [15]. От скорости включения системы ИФН в процесс противовирусной защиты зависят течение и исход заболевания [16].
В нашем исследовании в начальной стадии острого респираторного заболевания показатели гуморального и клеточного иммунитета в подавляющем случае определялись в пределах нормы, было выявлено снижение показателей местного иммунного ответа в виде уменьшения содержания ИФН-α и sIgА. Повышение провоспалительных цитокинов ИЛ-1b, ИЛ-6, ИЛ-8 в назальной слизи и ИЛ-1b в сыворотке крови служит, наряду с клинической картиной, дополнительным свидетельством воспалительного процесса у этих пациентов. По мере развития воспалительного процесса все показатели будут иметь динамические изменения в зависимости от способа лечения [17].
Поскольку у зарегистрированных в настоящее время на территории России лекарственных иммунотропных препаратов системного применения нет доказанного влияния на факторы локального иммунитета слизистой оболочки верхних дыхательных путей, а изменения показателей системного клеточного и гуморального иммунитета, которые бы свидетельствовали о вторичном иммунодефиците, не определяются, вопрос об эффективности этих препаратов при их включении в схемы медикаментозной терапии острых респираторных вирусных заболеваний требует дальнейшего изучения.
ЗАКЛЮЧЕНИЕ
1. При ОНФ на фоне ОРВИ в периферической крови в начальном периоде заболевания определяется снижение относительного числа цитотоксических Т-лимфоцитов (CD3+CD8+), стимулированного НСТ-теста и увеличение фагоцитарной активности моноцитов.
2. Изучение показателей локального иммунного статуса выявило снижение основных факторов врожденного иммунитета слизистой оболочки ИФН-α и sIgА в носовой слизи.
3. Изучение возможности влияния на факторы врожденного иммунного ответа слизистой оболочки верхних дыхательных путей может быть перспективным для снижения восприимчивости организма к респираторным вирусам.



