ВВЕДЕНИЕ
Последнее десятилетие характеризуется неуклонным ростом неинфекционных заболеваний, и в первую очередь ожирения: по данным исследования ЭССЕ-РФ (2013), около четверти населения России в возрасте 35−44 лет имеют ожирение [1]. В настоящее время установлены различные фенотипы ожирения, но наибольшее обсуждение вызывает метаболически здоровый фенотип − метаболически здоровое ожирение (МЗО), состояние, характеризующееся низким кардиометаболическим риском. Данные о распространенности МЗО весьма разнообразны и зависят от выбранных критериев диагностики и, по данным разных исследователей, могут составлять от 12 до 45% в популяции [2]. Исследования, касающиеся МЗО, в основном направлены на изучение распространенности в зависимости от выбранного критерия диагностики и прогнозирование сердечно-сосудистого риска [3, 4]. Работы, посвященные особенностям адипокинового статуса, системного воспаления и дисфункции эндотелия внутри группы МЗО, единичны, а их результаты противоречивы [2, 5].
Цель исследования − изучить взаимосвязь адипокинов с маркерами субклинического воспаления и эндотелиальной дисфункции (ЭД) у больных метаболически здоровым ожирением.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Было обследовано 50 человек в возрасте 25−50 лет (женщин 65%) с ожирением без метаболических нарушений (критерии IDF, 2005) и АГ (Европейские рекомендации по АГ, 2013) – группа МЗО. Согласно национальным рекомендациям по диагностике ожирения и нарушений углеводного обмена [3, 6], группа МЗО была разделена на подгруппы в зависимости от степени инсулинорезистентности (ИР) по уровню НОМА-IR. 1 подгруппа МЗО с НОМА-IR <2,7 (n=35), 2-я подгруппа МЗО с НОМА-IR ≥2,7 (n=15). Группу сравнения составили 50 здоровых респондентов с индексом массы тела (ИМТ) <25 кг/ м². Критерии невключения: эндокринные формы ожирения, ассоциированные с ожирением заболевания и состояния. Всем пациентам проводили клинико-лабораторное обследование согласно медико-экономическим стандартам. Концентрацию биомаркеров в сыворотке крови исследовали иммуноферментным методом (ИФА) используя наборы реагентов: лептин − DBC (Канада), инсулин − ELISA Monobind Inc (Германия), резистин и адипонектин – BioVender (Чехия), эндотелин-1 (ЭТ-1) Biomedica ENDOTELIN (1-21) (Германия), С-реактивный белок (CRP-hs), васкулоэндотелиальный фактор роста (VEGF), фактор некроза опухоли α (TNFα), интерлейкин 6 (IL6) − ЗАО «Вектор-Бест» (Новосибирск, Россия). Фактор Виллебранда (ФВ) определяли в плазме крови набором TECHNOZYM vWF:Ag ELISA (Австрия), индекс инсулинорезистентности (HOMA-IR) рассчитывался в малой модели гомеостаза.
При статистической обработке данных использовали программу Statistica 10.0. Оценивая данные с нормальным распределением, использовали среднюю величину (М) и стандартное отклонение (SD); t-критерий Стьюдента. Данные с ненормальным распределением представлены в виде медианы (Ме) и интерквартильного интервала [25; 75]. Для множественного сравнения между группами использовался критерий Краскела−Уоллиса, попарные сравнения в этом же модуле с помощью критерия Манна−Уитни. Различия между выборками считали достоверными при значении р <0,05. Связь признаков оценивали при помощи регрессионного анализа с определением коэффициента ранговой корреляции Спирмена.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Средний возраст обследованных составил 44,8±7,7 года, средний ИМТ 36,0±5,5 кг/м². Систолическое артериальное давление (САД) и диастолическое артериальное давление (ДАД) не имели различий с группой контроля (САД 125±7,4 и 125±5,1 мм рт.ст., ДАД 74±8,5 и 74,1±4,3 мм рт. ст.; р=0,9). В подгруппе МЗО с НОМА-IR ≥2,7 уровень ДАД был достоверно выше, чем в подгруппе с НОМА-IR <2,7 (71,6±8,1 и 79,1±6,6 мм рт.ст.; р=0,02). Анализ метаболических параметров не выявил достоверных различий между группой МЗО и контролем. Обращает внимание, что в подгруппе МЗО с НОМА-IR ≥2,7 при отсутствии критериев метаболического синдрома (МС) уровни постпрандиальной гликемии (5,3±1,1 и 4,8±1,0 ммоль/л; р <0,05), ХС ЛПНП (1,3±0,2 и 1,6±0,1 ммоль/л; р <0,05), ТГ (1,4±0,5 и 1,0±0,5 ммоль/л; р <0,05) и мочевой кислоты (300±43,1 и 226,2±36,8 мкмоль/л; р <0,05) были достоверно выше, чем у здоровых лиц.
В группе МЗО снижение ХС ЛПВП ассоциировалось с повышением уровня гликемии натощак (r=−0,68; р <0,01), уровень САД имел прямую связь с ТГ (r=0,37; р <0,05). Данная тенденция прослеживалась в обеих подгруппах МЗО, однако в подгруппе с НОМА-IR ≥2,7 эта связь была статистически сильнее (r=−0,71 и r=0,57 соответственно; р <0,01).
Исследование гормональной активности жировой ткани не выявило различий уровня лептина между подгруппами МЗО, тогда как уровень адипонектина был ниже в подгруппе с НОМА-IR ≥2,7 как относительно группы контроля, так и подгруппы МЗО с HOMA-IR <2,7 (табл. 1).
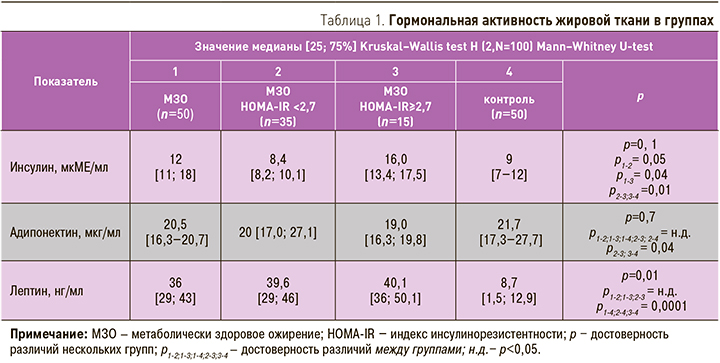
Уровень резистина в группе МЗО был выше, чем в группе контроля (3,4 [2,5; 3,9] и 2,2 [1,7; 2,8] нг/мл; р <0,05). Проведенный анализ выявил достоверное повышение уровня резистина в подгруппе с НОМА ≥2,7 в сравнении с контролем, тогда как в подгруппе с нормальной ИР отмечалась лишь тенденция к повышению концентрации маркера (рис. 1).
 В группе МЗО установлена связь лептина и резистина с НОМА-IR (r=0,40; р <0,05 и r=0,62; р=0,001), лептина с уровнем САД (r=0,43, p <0,05) и ДАД (r=0,35, p <0,05).
В группе МЗО установлена связь лептина и резистина с НОМА-IR (r=0,40; р <0,05 и r=0,62; р=0,001), лептина с уровнем САД (r=0,43, p <0,05) и ДАД (r=0,35, p <0,05).
Исследование провоспалительного статуса и маркеров ЭД в группах не выявило различий значений ФВ и ЭТ-1 между группами. Уровни CRP-hs и TNF-α в группе МЗО с НОМА-IR ≥2,7 превышали значения в контрольной группе (табл. 2).
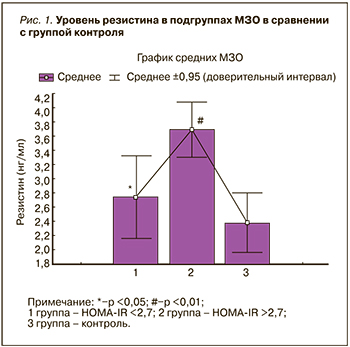
Уровень IL6 в группе МЗО был выше, чем в группе контроля независимо от уровня НОМА-IR. Следует подчеркнуть, что с повышением ИР уровень IL6 увеличивался (рис. 2).
В группе МЗО содержание TNF-α и IL6 было связано с уровнем САД (r=0,44 и r=0,33; p <0,05), ХС ЛПВП (r=−0,55 и r=−0,60; р <0,01) и резистином (r=0,32; р <0,05 и r=0,60; p <0,01). Значения IL6 и CRP-hs имели связи с ХС ЛПНП (r=0,33, p <0,05 и r=0,70; p <0,01) и ТГ (r=0,29 и r=0,36; p <0,05), уровень CRP-hs коррелировал с резистином (r=0,33; р <0,05). Следует отметить, что достоверная отрицательная связь в подгруппе МЗО с НОМА <2,7 была получена между IL6 и ХС ЛПВП (r=−0,45; р <0,05).
Уровень VEGF в группе МЗО был выше, чем в группе контроля независимо от уровня НОМА-IR. Необходимо подчеркнуть, что с повышением ИР уровень VEGF увеличивался (рис. 3).
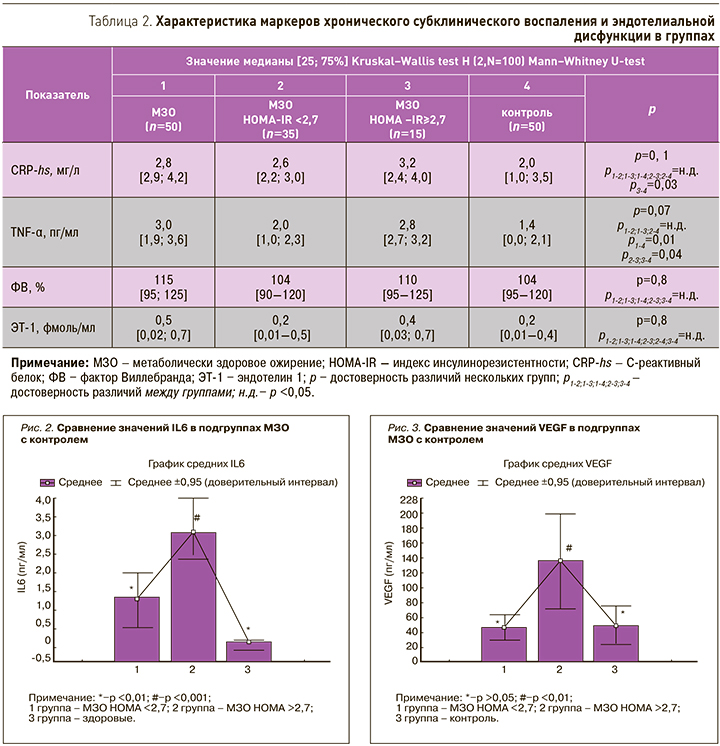
Получены ассоциации содержания VEGF с НОМА-IR (r=0,62; p <0,01), уровнем ХС ЛПВП (r=−0,70, p <0,01), лептина (r=0,29; р <0,05), резистина (r=0,70; p <0,01), IL6 (r=0,74, p <0,01) и ЭТ-1 (r=0,29; р <0,05). В подгруппе МЗО с НОМА <2,7 уровень VEGF коррелировал с НОМА-IR (r=0,42; p <0,05), ХС ЛПВП (r=−0,29; p <0,05), IL6 (r=0,34, p <0,05) и резистином (r=0,40; p <0,05).
ОБСУЖДЕНИЕ
В экспериментальных исследованиях последних лет было доказано наличие хронического субклинического воспаления в жировой ткани и его роль в формировании многих патологических процессов при ожирении. Известно, что до 40% всех клеток висцеральной жировой ткани могут составлять макрофаги. Макрофагальные цитокины индуцируют в адипоцитах воспалительные сдвиги, что запускает синтез цитокинов уже самими адипоцитами [7]. Известно, что резистин, так же как и TNF-α и IL6, в большей степени продуцируются клетками бурой жировой ткани, а его метаболическое действие проявляется снижением чувствительности к инсулину в периферических тканях и развитию атеросклероза [8]. Установлено, что TNF-α и IL6 дополнительно стимулируют синтез резистина [7, 8]. Таким образом, полученные взаимосвязи маркеров воспаления TNF-α и IL6 с резистином, уровнем САД, показателями липидного спектра в группе МЗО со сниженной чувствительностью к инсулину свидетельствуют об инициации механизмов, способствующих формированию атеросклероза и АГ. Прогрессирование этих событий косвенно подтверждают сопровождающие эти процессы снижения уровня адипонектина и ХС ЛПВП. В подгруппе с сохраненной чувствительностью к инсулину повышенные значения IL6 в отсутствие роста уровней CRP-hs и TNF-α можно объяснить тем, что в начальной стадии ожирения синтез IL6 способствует поддержанию необходимого количества противовоспалительных макрофагов в жировой ткани, что контролирует и ограничивает воспалительный процесс [9]. В нашем исследовании при прогрессировании ИР активация цитокинового ответа характеризовалась повышением CRP-hs, TNF-α, которые имели связи с ДАД и резистином, при этом показатели липидного обмена оставались в оптимальном диапазоне. Известно, что ИР способствует развитию ЭД [10]. Увеличение объема жировой ткани сопровождается ростом сосудистой сети; одним из факторов, ответственных за ангиогенез, является VEGF [11]. Этот факт объясняет полученную связь VEGF с адипокинами и индексом ИР в нашем исследовании. Доказано увеличение синтеза VEGF у больных с сердечно-сосудистыми заболеваниями, что позволяет ряду авторов рассматривать его как маркер неблагоприятных событий [12, 13]; полученная ассоциация VEGF с уровнем ХС ЛПВП также подтверждает это положение. Отсутствие различий ЭТ-1 и ФВ между группами МЗО и контролем свидетельствуют о сохраненной вазомоторной функции эндотелия и нормальной тромбогенной активности у больных с ожирением без метаболических нарушений. Однако повышенные значения VEGF и его связь с резистином, IL6 и ХС ЛПВП у больных с МЗО с нормальной чувствительностью к инсулину может говорить как об инициации процессов, направленных на формирование кардиометаболических нарушений, так и о возможной компенсаторной реакции, направленной на устранение метаболических нарушений.
ЗАКЛЮЧЕНИЕ
Больные с фенотипом здорового ожирения, нормотензией и нормальной чувствительностью к инсулину в меньшей степени подвержены неблагоприятным кардиоваскулярным рискам за счет менее выраженной гормональной и воспалительной активации жировой ткани и, как результат, менее выраженной эндотелиальной дисфункции. По мере формирования инсулинорезистентности даже в условиях нормотензии и отсутствии дислипидемии кардиоваскулярный риск увеличивается за счет активации субклинического воспаления и ангиогенной эндотелиальной дисфункции.



