Системный склероз, или системная склеродермия (ССД), – аутоиммунное заболевание соединительной ткани, основные клинические признаки которого обусловлены распространенными нарушениями микроциркуляции, фиброзом кожи и внутренних органов [1].
Почки часто вовлекаются в патологический процесс при ревматических заболеваниях. В большинстве случаев их поражение протекает бессимптомно, и для его выявления требуется применение дополнительных инструментальных и лабораторных методов диагностики [2]. Наиболее грозное и хорошо известное поражение почек (ПП) при CCД – склеродермический почечный криз (СПК). До конца 1970-х гг. СПК выступал ведущей причиной смерти больных ССД [3]. Более 40 лет назад, с открытием ингибиторов ангиотензинпревращающего фермента (иАПФ), СПК стал курабельным состоянием. Прогресс в лечении СПК, связанный с началом применения иАПФ, привел к значительному снижению интереса клиницистов к проблеме ПП у больных ССД. Следует отметить, что ПП, не связанные с развитием СПК, также описаны у пациентов с ССД. В целом, по данным морфологических исследований, у 80% больных ССД выявляются изменения почек, в том числе не связанные с ревматическими заболеваниями [4]. При этом 15-летняя выживаемость пациентов с ССД без ПП составляет 72%, а при их наличии – не более 13%.
В данной статье представлены основные варианты хронических ПП при ССД. Среди проявлений, свидетельствующих о субклиническом ПП при этом заболевании, следует отметить: 1) изолированное снижение скорости клубочковой фильтрации (СКФ); 2) увеличение индекса резистивности (ИР) почечных сосудов; 3) снижение почечного функционального резерва (ПФР).
По данным многочисленных наблюдений, существенное снижение СКФ у пациентов с ССД встречается уже при субклиническом ПП, обнаруживаясь, по результатам ряда исследований, почти у половины больных ССД с нормальным уровнем креатинина крови [5]. В клинической практике клиренсные методики определения СКФ давно уступили место расчетным методам. Как в общей популяции, так и у больных ССД величина СКФ, рассчитанная по формуле CKD-EPI, оказалась наиболее близка к результатам ее измерения с использованием одной из референтных методик (клиренс ЭДТА, с меченым технецием-99m) [6]. Выявление снижения СКФ важно не только для определения почечного прогноза, но и для расчета доз лекарственных препаратов, в том числе антибиотиков, иммуносупрессантов, при использовании рентгенконтрастных веществ и определения прогноза ССД в целом. A. Campo и соавт. в своем исследовании продемонстрировали, что снижение расчетной СКФ <60 мл/мин/1,73 м2 ассоциируется с увеличением смертности больных ССД с легочной гипертензией в 3 раза [7].
Метод цветной доплеросонографии позволяет диагностировать ренальную патологию у больных ССД до развития клинических симптомов ПП. C. Nishijima и соавт. [8] измеряли ИР с помощью цветной доплеросонографии в междольковых и сегментарных артериях у 53 больных ССД, 12 – с системной красной волчанкой, 3 – с дерматомиозитом и у 16 здоровых пациентов с нормальной функцией почек по результатам определения расчетной СКФ и анализов мочи. У пациентов с ССД ИР в почечных артериях оказался достоверно выше, чем в группах сравнения. При этом с повышением ИР коррелировали следующие симптомы: дигитальные язвы, снижение апертуры открытия рта, контрактуры пальцев кистей, легочный фиброз, вовлечение сердца, наличие и титр антител к топоизомеразе I (Scl-70), повышение уровня С-реактивного белка, снижение показателей жизненной емкости легких. Не коррелировали с этим параметром артериальное давление, уровень креатинина, протеинурия, уровень ренина, СКФ, поражения желудочно-кишечного тракта и других органов. Исследователи сделали вывод, что латентные и субклинические ПП могут быть предикторами развития СПК. По другим данным, ИР коррелирует с наличием склеродермического паттерна изменений при капилляроскопии и СКФ [9].
Использование антиоксиданта N-ацетилцистеина у больных ССД с ранними капилляроскопическими изменениями уменьшает ИР [10], но не оказывает положительного эффекта у пациентов с поздними капилляроскопическими изменениями. Выявление больных с ранними капилляроскопическими изменениями важно с точки зрения терапевтического «окна» ССД и нефропротективных возможностей терапии.
Метод определения ПФР используется для оценки состояния внутрипочечной гемодинамики и базируется на оценке прироста СКФ в процентном выражении в ответ на белковую нагрузку. Нормальным ответом на белковую нагрузку или введение аминокислот считается увеличение СКФ на 20–65% в течение 1,5–2 ч после начала теста. Снижение резерва клубочковой фильтрации рассматривается как ранний признак нарушения фильтрационной функции почек.
R. Livi и соавт. [11] исследовали 21 больного ССД с нормальной функцией почек, а также группу контроля (10 пациентов) после внутривенного введения раствора аминокислот (набор Freamine III Baxter, 8,5% раствор, вводился со скоростью 4,16 мл/мин в течение 2 ч). До и после введения аминокислот у всех пациентов измеряли СКФ (с помощью клиренса креатинина), эффективный почечный плазмоток (с помощью клиренса парааминогиппуровой кислоты), общее реноваскулярное сопротивление. Исходно все пациенты с ССД имели более низкий эффективный почечный плазмоток (403,5±43,8 против 496,4±71,3 мл/мин; р<0,0002) и более высокий уровень общего реноваскулярного сопротивления (10 822±204 против 8874±1639 дин/s × см5; р<0,014) при сравнении с группой контроля. ПФР также был значимо снижен у больных ССД (+1,9 (SD18,6)% против +34,8 (SD 13,9)% в группе контроля; р<0,0002). Однако ответ пациентов с ССД на введение раствора аминокислот был различным. С помощью анализа множественной регрессии была выявлена наибольшая обратная зависимость ПФР от среднего артериального давления и исходного уровня СКФ (R2=65%; р<0,0001). Таким образом, дефект ПФР после теста с аминокислотами подтверждает концепцию превалирования в почках больных ССД вазоконстрикторных факторов над вазодилатирующими. При 5-летнем наблюдении у пациентов со сниженным ПФР более значимо уменьшилась СКФ (≥2 мл/мин/год), причем у многих больных из этой группы развилась артериальная гипертензия (АГ) 1-й или 2-й степени. Авторы предположили, что снижение ПФР может быть как ранним признаком ПП при ССД, так и независимым предиктором развития почечной недостаточности и АГ в результате нарушенного ответа эндотелия на вазодилатирующие стимулы.
Субклиническое ПП при ССД, как правило, характеризуется медленным прогрессированием хронической болезни почек (ХБП). Терминальной стадии ХБП достигает небольшое количество пациентов с этим заболеванием. Так, согласно данным национального регистра Австралии и Новой Зеландии ANZDATA, за период с 1963 по 2005 гг. из 40 238 больных с терминальной стадией ХПН только у 127 (0,3%) ее причиной выступала ССД [12].
ПРОТЕИНУРИЯ У БОЛЬНЫХ СИСТЕМНОЙ СКЛЕРОДЕРМИЕЙ
По данным Европейского регистра изучения склеродермии EUSTAR, включавшего к 2012 г. 7655 пациентов с ССД, протеинурия, измеренная с помощью тест-полосок, выявлялась у 4,4% пациентов с лимитированной и у 8,4% с диффузной формой ССД [13]. Согласно данным EUSTAR, у больных ССД протеинурия оказалась одним из самых статистически значимых независимых факторов риска смертельных исходов (относительный риск 3,34), оставив далеко позади такие канонические факторы риска, как легочная гипертензия, легочная рестрикция (FEV1/FVC <80%), дыхательная недостаточность (III и IV функционального класса по NYHA), а также снижение диффузионной способности легких (DLCO) и высокий кожный счет (по Rodnan) [14].
В исследовании L. Sieberlich и соавт. [15], включавшем 80 больных ССД с нормальной СКФ, протеинурия зафиксирована у 17,5% пациентов, а альбуминурия – у каждого четвертого (!) больного. При этом выявлена корреляция альбуминурии с длительностью заболевания (более 4 лет) и с увеличением систолического артериального давления, а наличие протеинурии, достоверно чаще встречающейся при диффузной форме ССД, коррелировало с поражением желудочно-кишечного тракта.
Очевидно, что описанные выше патофизиологические нарушения функционирования почек у больных ССД практически напрямую связаны с состоянием внутриклубочковой и внутрипочечной гемодинамики, которая, с одной стороны, зависит от состояния собственно сосудистого русла (васкулопатия, вазоконстрикция), а с другой – от выраженности склероза/фиброза почечной паренхимы. Сегодня трудно переоценить значение сосудистого эндотелия в индукции и прогрессировании склеродермических васкулопатии и фиброза.
Оксидативный стресс, воздействие токсинов, антител и вирусов способны индуцировать развитие феномена сосудисто-эндотелиальной дисфункции (СЭД; vascular endothelial dysfunction), которая может быть определена как нарушение эндотелий-зависимой вазодилятации, потеря физиологических свойств эндотелия по поддержанию нормального сосудистого тонуса [16]. Доказано соучастие СЭД в патогенезе АГ, атеросклероза, ишемической болезни сердца, сахарного диабета (в том числе диабетической нефропатии), легочной гипертензии, ХПН и ССД. Формирование СЭД приводит к снижению активности NO-синтетазы эндотелия, уменьшению образования и биодоступности оксида азота, повышенному накоплению активных форм кислорода. Это, в свою очередь, приводит к дальнейшему повреждению самого эндотелия, следствием которого является гиперпродукция большого количества разнообразных ангиогенных, вазоконстрикторных, провоспалительных и профибротических молекул, неизбежно воздействующих и на ткань почки.
 Одним из значимых компонентов СЭД является гиперпродукция эндотелина (ЭТ). Помимо собственно эндотелиальных клеток внутрипочечных сосудов и клубочковых капилляров, образование ЭТ происходит в эпителиальных (ЭТ-1, -2, -3) и мезангиальных клетках (ЭТ-1) нефрона [17]. К эпителиальным клеткам относятся и подоциты почечных клубочков, которые играют крайне важную роль в процессах ультрафильтрации. Активация А-рецепторов ЭТ (ЕТА), локализующихся в эпителиальных, эндотелиальных и мезангиальных клетках почки, вызываемая ЭТ-1, приводит к снижению почечного кровотока, СКФ, уменьшению объема выделяемой мочи, натрийурезу, а также пролиферации мезангиальных клеток. Напротив, активация В-рецепторов ЭТ (ETВ) стимулирует высвобождение NO и простациклина, ингибирует апоптоз и продукцию эндотелинпревращающего фермента. При сравнении влияния антагонистов рецепторов ЕТА, ETВ и неселективных ЕТА/ЕТВ у пациентов с ХПН отмечено, что блокада селективных ЕТА -рецепторов приводит к вазодилатации почечных сосудов, снижению уровня протеинурии и ИР почечных артерий [18].
Одним из значимых компонентов СЭД является гиперпродукция эндотелина (ЭТ). Помимо собственно эндотелиальных клеток внутрипочечных сосудов и клубочковых капилляров, образование ЭТ происходит в эпителиальных (ЭТ-1, -2, -3) и мезангиальных клетках (ЭТ-1) нефрона [17]. К эпителиальным клеткам относятся и подоциты почечных клубочков, которые играют крайне важную роль в процессах ультрафильтрации. Активация А-рецепторов ЭТ (ЕТА), локализующихся в эпителиальных, эндотелиальных и мезангиальных клетках почки, вызываемая ЭТ-1, приводит к снижению почечного кровотока, СКФ, уменьшению объема выделяемой мочи, натрийурезу, а также пролиферации мезангиальных клеток. Напротив, активация В-рецепторов ЭТ (ETВ) стимулирует высвобождение NO и простациклина, ингибирует апоптоз и продукцию эндотелинпревращающего фермента. При сравнении влияния антагонистов рецепторов ЕТА, ETВ и неселективных ЕТА/ЕТВ у пациентов с ХПН отмечено, что блокада селективных ЕТА -рецепторов приводит к вазодилатации почечных сосудов, снижению уровня протеинурии и ИР почечных артерий [18].
Помимо этого, подоциты являются основным источником образования сосудистого эндотелиального фактора роста в почечных клубочках. Гиперпродукция подоцитами этого фактора индуцирует рост и пролиферацию не только эндотелиальных, но и мезангиальных клеток нефрона, приводя к усиленной аккумуляции внеклеточного матрикса (склероз), гиперфильтрации и протеинурии. Все перечисленные патофизиологические механизмы являются облигатными неиммунными факторами неуклонного прогрессирования любой нефропатии, независимо от этиологии. Сегодня уже очевидна вероятная молекулярная, патофизиологическая и гистологическая близость склеродермической васкулопатии почечных, легочных и периферических сосудов и тех процессов, которые ее сопровождают.
Очень частое выявление у больных ССД субклинических (хотя и прогностически значимых) форм ПП, очевидных и стереотипных, но «неспецифических» морфологических изменений в почечных биоптатах, наряду с доказанной универсальностью склеродермических патофизиологических и патогенетических механизмов развития ренальной васкулопатии и склероза, позволяет предположить, что, помимо острых форм СПК, существует и хронический вариант склеродермической нефропатии. По своей сути эта нефропатия является СЭД-индуцированной.
ХРОНИЧЕСКАЯ БОЛЕЗНЬ ПОЧЕК У БОЛЬНЫХ СИСТЕМНОЙ СКЛЕРОДЕРМИЕЙ
В то время как распространенность СПК при ССД в настоящее время оценивается в 2–5%, гораздо чаще, в 10–55% случаев, при этом заболевании отмечается асимптоматическое снижение почечной функции («немая уремия»), обусловленное наличием множественной мультиморбидной и коморбидной патологии, ассоциированной с развитием ХБП [19].
ХБП – наднозологичекий термин, болезнь диагностируется на основании выявления анатомического или структурного ПП и/или снижения СКФ <60 мл/мин/1,73 м2, которые прослеживаются в течение ≥3 мес, независимо от их характера и этиологии. Сам факт наличия аутоиммунного заболевания соединительной ткани зачастую может рассматривается как маркер ПП. Так, у 15% пациентов с диффузной формой ССД в какой-либо период болезни отмечается увеличение уровня креатинина >115 ммоль/л [20].
Независимо от этиологии ХБП в ее основе лежат универсальные неиммунные механизмы развития (протеинурия, гиперфильтрация, снижение ПФР, внутрипочечные гипертензия и гипоперфузия, АГ, интерстициальный фиброз, СЭД и др.), особенно ярко выраженные у больных ССД.
ЛЕКАРСТВЕННЫЕ НЕФРОПАТИИ
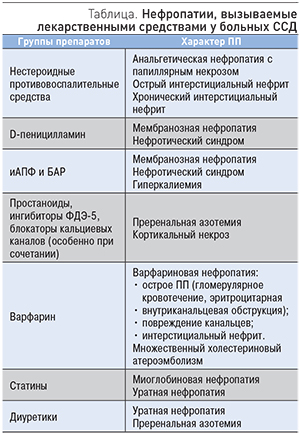
Пациенты с ССД получают большое количество разнообразных лекарственных препаратов, назначаемых как с целью воздействия на патогенетические механизмы этого заболевания, так и для коррекции его осложнений и лечения сопутствующей патологии. Основные, наиболее часто применяемые при ССД группы лекарственных средств и их возможные нежелательные эффекты на функцию почек представлены в таблице.
Отдельно следует остановиться на воздействии D-пеницилламина, который длительное время считался основным препаратом в лечении ССД и, несмотря на неподтвержденную эффективность, весьма широко применяется при этом заболевании и в настоящее время. Применение D-пеницилламина ассоциируется с разнообразными иммунологическими феноменами: от образования антител до развития аутоиммунных заболеваний – системной красной волчанки, аутоиммунного тиреоидита, неакантолитической пузырчатки (пемфигоид), синдрома Гийена–Барре, полимиозита и васкулитов. Нередко встречаются и ПП, индуцированные применением D-пеницилламина. У части пациентов (до 20%), леченных D-пеницилламином, отмечено развитие мембранозной гломерулопатии. Также описаны случаи ПП по типу диффузного пролиферативного гломерулонефрита с полулуниями, волчаночного синдрома и легочно-почечного синдрома, схожего с синдромом Гудпасчера [21]. Как правило, после отмены D-пеницилламина наблюдается обратное развитие индуцированной им патологии, но описаны и летальные исходы. В тяжелых случаях может потребоваться применение глюкокортикостероидов, иммуносупрессивной терапии и плазмафереза. Уровень смертности среди таких пациентов крайне высок и достигает 40% [21].
ЗАКЛЮЧЕНИЕ
Патология почек у больных с ССД крайне разнообразна. Некоторые варианты ПП имеют несомненную связь с патогенезом системного склероза, другие же обусловлены вторичным поражением легких, сердца, желудочно-кишечного тракта, применением лекарственных препаратов. Пятнадцатилетняя выживаемость больных ССД без ПП составляет 72%, при наличии ПП – не более 13%, при остром характере ПП 5-летняя выживаемость составляет лишь 23% [22]. Независимо от механизмов индукции и поддержания сформировавшаяся нефропатия может оказывать непосредственное влияние на клиническое течение собственно ССД и возможности ее медикаментозной терапии. Дальнейшее изучение патогенеза ПП при ССД может привести к повышению эффективности лечения пациентов с данным заболеванием в целом.



