АКТУАЛЬНОСТЬ
В настоящее время в мире сохраняется высокая распространенность хронической сердечной недостаточности (ХСН) [1]. Одним из ведущих факторов риска развития и прогрессирования этого заболевания выступает ожирение [2, 3]. Встречаемость ХСН при ожирении в 9, а при морбидном ожирении – в 12 раз выше, чем у пациентов с нормальной массой тела [4].
При сочетании ХСН и ожирения формируется прогрессирующее увеличение жесткости артерий, что приводит к росту пульсового давления [5] и ассоциировано с неблагоприятным исходом [6]. Это определяет высокую значимость оценки состояния артериальной стенки у больных с сочетанием этих патологий. Неблагоприятное ремоделирование магистральных артерий ассоциировано с каскадом взаимосвязанных патогенетических процессов: окислительным стрессом, синдромом низкоинтенсивного воспаления, эндотелиальной дисфункцией, активацией ренин-ангиотензин-альдостероновой системы, расстройствами микроциркуляции, профибротическими изменениями сосудистой стенки, дислипидемией, нарушениями углеводного, пуринового обмена, инсулинорезистентностью [7, 8]. Кроме того, непосредственное участие в формировании структурных изменений артерий принимает висцеральная жировая ткань [9, 10]. Наибольшее влияние на прогрессирование сосудистой жесткости оказывают адипокины, продуцируемые висцеральной жировой тканью [11]. В связи с этим оценка влияния висцерального ожирения на жесткость сосудистой стенки артерий представляет собой актуальную задачу для практического здравоохранения.
Цель исследования – оценить роль висцерального ожирения в прогрессировании ригидности магистральных артерий у больных ХСН.
МАТЕРИАЛ И МЕТОДЫ
В исследование было включено 165 пациентов с ХСН I–IIА стадии, I–III функционального класса (ФК) ишемического генеза в возрасте от 40 до 65 лет. В зависимости от индекса массы тела (ИМТ) больные были рандомизированы на 3 группы, сопоставимые по возрасту, полу, частоте встречаемости курения, стажу артериальной гипертензии (АГ), уровню офисного артериального давления (АД). В 1-ю группу вошли больные ХСН с нормальным ИМТ (n=55), во 2-ю – с ХСН и избыточным ИМТ (n=53), в 3-ю – с ХСН и ожирением 1–2 степени (n=57) [12]. Различий по тяжести ХСН между исследуемыми группами не было.
Критерии исключения из исследования: ХСН IIб–III стадии, ХСН IV ФК, ожирение III степени, неконтролируемая злокачественная АГ, острый коронарный синдром и острые нарушения мозгового кровообращения давностью менее 6 мес, гемодинамически значимые пороки сердца и нарушения ритма, сахарный диабет 1-го и 2-го типа, клинически выраженная печеночная недостаточность, хроническая болезнь почек выше 3б стадии, зависимость от алкоголя, любые другие заболевания, которые могли повлиять на результаты исследования.
Все пациенты получали базисную терапию сердечной недостаточности, средние дозировки препаратов достоверно не различались. Клинико-демографическая характеристика групп представлена в таблице 1.
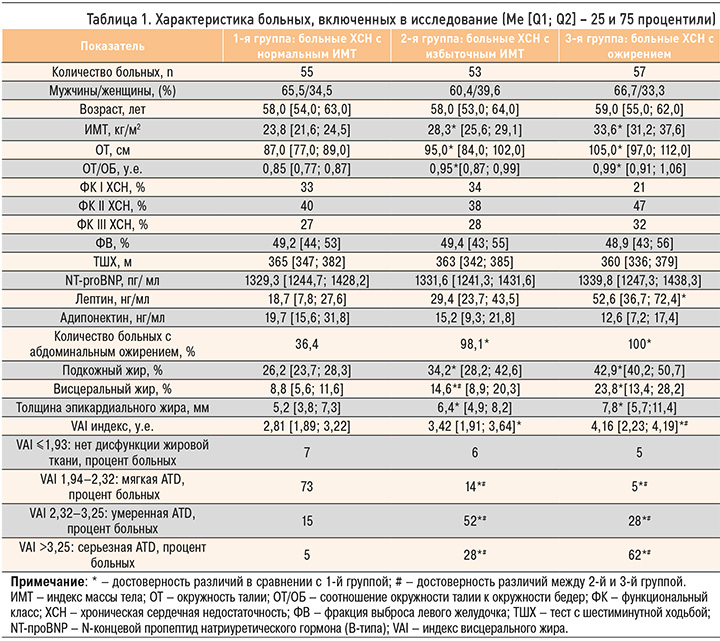
Клиническое обследование включало оценку общего состояния, клиническое измерение АД на обеих руках в положении пациента сидя по стандартной методике, подсчет частоты сердечных сокращений, антропометрию с расчетом ИМТ, замеры объема талии (ОТ), бедер (ОБ), расчет соотношения ОТ/ОБ. Анализ состава тела проводился методом биоэлектрического импеданса на аппарате Omron BF508 52 (Kyoto, Япония) с оценкой процентного содержания подкожного и висцерального жира. Абдоминальному ожирению соответствовал ОТ ≥94 см у мужчин и ≥80 см у женщин, висцеральному ожирению – превышение висцерального жира в организме ≥9% [13, 14]. Рассчитывался индекс висцерального жира (VAI), оценивалась степень дисфункции жировой ткани (ATD); возрастная норма для пациентов, вошедших в исследование, составляла ≤1,93 [14; 15].
Структурно-функциональные параметры сердца и толщина эпикардиальной жировой ткани (ЭЖТ) анализировались методом эхокардиографии (ЭхоКГ) на аппарате Siemens Sonoline G50 (Германия).
Эластичность магистральных артерий определялась путем измерения скорости распространения пульсовой волны (СРПВ) в стандартных условиях с помощью сфигмографической приставки на аппаратно-программном комплексе «Поли-Спектр-8/Е» (Россия). СРПВ по сосудам эластического (СРПВэ) и мышечного (СРПВм) типов рассчитывалась как отношение расстояния между точками расположения датчиков ко времени прохождения пульсовой волны на каротидно-феморальном и каротидно-радиальном сегментах соответственно.
У пациентов также оценивались лабораторные маркеры ожирения. Уровни лептина (наборы Leptin, Diagnostics Biochem, Канада) и адипонектина (наборы Adiponectin, Mediagnost, GmbH, Германия) сыворотки крови определялись с помощью иммуноферментного анализа. Референсными значениями для лептина считали цифры 3,7–11,1 нг/мл (для женщин ≤27,6 нг/мл, для мужчин – ≤13,8 нг/мл), для адипонектина – 8,2–19,1 нг/мл.
Статистическая обработка результатов выполнялась с привлечением встроенных функций программы MC Excel и программы STATISTICA 12.0. Данные представлены в виде Me [Q1; Q2], где Me – медиана, [Q1; Q2] – 25 и 75 процентили соответственно, качественные величины – в виде частоты встречаемости (%). Нулевую статистическую гипотезу об отсутствии различий отвергали при p <0,05. Независимые выборки сравнивались с помощью критерия Краскела–Уоллиса. В случае дихотомических показателей статистическая значимость различий долей оценивалась с использованием точного метода Фишера. Оценка статистики связей осуществлялась по коэффициенту ранговой корреляции Спирмена (r) с помощью линейной регрессии.
Исследование проводилось в соответствии с этическими принципами, изложенными в Хельсинкской декларации Всемирной медицинской ассоциации (2008), трехсторонним соглашением по надлежащей клинической практике (ICH GCP), Конституцией РФ, Федеральным законом от 21 ноября 2011 г. № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации».
Клиническое исследование было одобрено региональным Этическим комитетом. Информированное согласие было получено у участников до начала выполнения любых процедур исследования.
РЕЗУЛЬТАТЫ
Установлены статистически значимые различия по ИМТ между 1-й и 2-й, 1-й и 3-й, 2-й и 3-й группами исследования (p <0,0001). Антропометрические показатели, отражающие абдоминальное ожирение (ОТ, соотношение ОТ/ОБ), оказались достоверно выше у лиц 2-й и 3-й групп по сравнению с пациентами 1-й группы. Кроме того, абдоминальное ожирение, оцениваемое по ОТ, чаще встречалось среди больных, имеющих избыточный ИМТ и ожирение по сравнению с лицами с нормальным ИМТ (100, 98,1 и 36,4% в 3-й, 2-й и 1-й группах соответственно, p <0,0001). При этом обращает на себя внимание факт наличия абдоминального ожирения и среди лиц 1-й группы, имеющих нормальный ИМТ.
По данным биоимпедансометрии, в обследуемых группах было установлено достоверное увеличение висцерального жира у пациентов с избыточным ИМТ и ожирением: 8,8 [5,6; 11,6] % в 1-й группе против 14,6 [8,9; 20,3] % и 23,8 [13,4; 28,2] % во 2-й и 3-й группах соответственно. Отмеченная закономерность сопровождалась ростом толщины эпикардиального жирового депо – с 5,2 [3,8; 7,3] мм в группе больных с ХСН и нормальным весом до 7,8 [5,7; 11,4] мм среди пациентов с ХСН и сопутствующим ожирением.
Во всех обследуемых группах отмечалась взаимосвязь между уровнем висцерального жира и ОТ (r=0,54, r=0,62 r=0,65 в 1-й, 2-й и 3-й группах соответственно, р <0,05), уровнем висцерального жира и соотношением ОТ/ОБ (r=-0,48, r=-0,54 r=-0,56 в 1-й, 2-й и 3-й группах соответственно, р <0,05).
VAI-индекс, отражающий дисфункцию жировой ткани, был достоверно выше среди больных ХСН с ожирением, ХСН с избыточной массой тела в сравнении с лицами, имевшими «изолированную» ХСН (см. табл. 1).
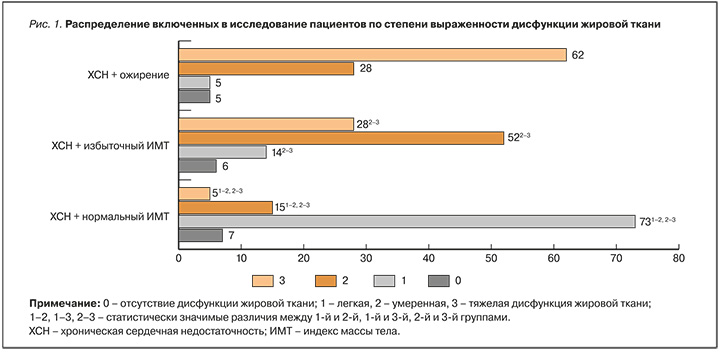
Более высокий процент лиц с дисфункцией жировой ткани наблюдался во 2-й и 3-й группах в сравнении с 1-й группой. Распределение больных по степени ATD представлено на рисунке 1.
Ригидность магистральных артерий представлена результатами оценки СРПВ (табл. 2). СРПВ по сосудам эластического типа в 1-й и 2-й группах достоверно не отличались и составили 8,8 [6,3; 10,5] и 9,3 [7,5; 10,9] м/с соответственно. СРПВэ в группе больных ХСН и ожирением оказалось достоверно больше, чем в других группах, – 10,8 [9,2; 12,9] м/с. Кроме того, в 3-й группе достоверно чаще встречались пациенты с СРПВэ >10 м/с (82 против 57 и 65% в 1-й и 2-й группах соответственно).

Нами зарегистрировано возрастание СРПВм при присоединении к ХСН ожирения, однако различия между группами по этому параметру не достигли уровня статистической значимости. Отношение СРПВм/СРПВэ во всех группах было менее 1,0 (в норме 1,1–1,3), что свидетельствует о выраженном увеличении степени жесткости сосудистой стенки. Соотношение СРПВм/СРПВэ оказалось более значимо снижено среди пациентов 3-й группы (см. табл. 2). При проведении окклюзионной пробы в группе больных с ХСН и ожирением, ХСН и избыточной массой тела достоверно реже встречалась нормальная реактивность магистральных артерий: 16, 25 и 36% в 3-й, 2-й и 1-й группе соответственно.
Установлены достоверные корреляционные взаимоотношения между СРПВэ и ОТ (r=0,42), ОТ/ОБ (r=-0,44), СРПВэ и ATD (r=0,52), СРПВэ и ИМТ (r=0,38), СРПВм и ОТ (r=0,40), СРПВм и ОТ/ОБ (r=-0,42), СРПВм и ИМТ(r=0,32) среди пациентов с ХСН и ожирением.
При оценке зависимости СРПВэ от процента висцерального жира по данным биоимпедансометрии было получено следующее регрессионное уравнение (1):
YСРПВэ = 8,49 + 0,1 × X%ВЖ (1),
где YСРПВэ – скорость распространения пульсовой волны по сосудам эластического типов, м/с; X%ВЖ – висцеральный жир, %.
Полученная зависимость характеризовалась статистически значимой прямой корреляционной связью умеренной тесноты (r=0,425; p=0,001). В регрессионной модели (1) были учтены 18,1% факторов, оказывающих влияние на дисперсию СРПВэ.
Исходя из коэффициента регрессии, увеличение висцерального жира на 1% сопровождалось повышением СРПВэ на 0,1 м/с.
На рисунке 2 приведен график регрессионной функции, характеризующей зависимость СРПВэ от процента вицерального жира по данным биоимпедансометрии.

При оценке зависимости СРПВэ от эпикардиального жира по данным ЭхоКГ было получено следующее регрессионное уравнение (2):
YСРПВэ = 7,07 + 0,46 × XтЭЖ (2),
где YСРПВэ – скорость распространения пульсовой волны по сосудам эластического типов, м/с; XтЭЖ – толщина эпикардиального жира, мм.
Полученная зависимость характеризовалась статистически значимой прямой корреляционной связью высокой тесноты (0,735; p <0,001). В регрессионной модели (2) были учтены 54% факторов, оказывающих влияние на дисперсию СРПВэ.
Исходя из коэффициента регрессии, увеличение эпикардиального жира на 1 мм сопровождалось возрастанием СРПВэ на 0,46 м/с.
На рисунке 3 представлен график регрессионной функции, характеризующей зависимость СРПВэ от толщины эпикардиального жира.
При оценке сывороточной концентрации лабораторных маркеров висцерального ожирения было обнаружено снижение уровня адипонектина и возрастание уровня лептина от 1-й к 3-й группе (см. табл. 1). Корреляционный анализ показал наличие статистически значимых связей между СРПВэ и концентрацией лептина и (r=0,58), СРПВэ и уровнем адипонектина (r=-0,76) среди лиц, страдающих ХСН и ожирением. Кроме того, выявлена положительная статистически значимая связь между толщиной ЭЖТ и уровнем лептина (r=0,62) и отрицательная достоверная связь между толщиной ЭЖТ и концентрацией адипонектина (r=-0,56).
ОБСУЖДЕНИЕ
Оценка содержания в организме висцерального жира и выраженности абдоминального ожирения имеет большую практическую значимость. В проведенном нами исследовании выявлен высокий процент больных с абдоминальным ожирением не только среди лиц с избыточным ИМТ и ожирением, но и в группе пациентов с ХСН и нормальным ИМТ (от 18,5 до 24,9 кг/м2). У больных ХСН, часто имеющих нарушение водного баланса, ИМТ не может точно отражать наличие ожирения. В связи с этим у пациентов с ХСН целесообразно оценивать не только ИМТ, но и значения ОТ, соотношения ОТ/ОБ, а также содержание висцерального жира в организме. Одним из наиболее клинически значимых депо висцерального жира является ЭЖТ. Известно, что толщина ЭЖТ тесно связана с метаболическим синдромом, инсулинорезистентностью, ишемической болезнью сердца, субклиническим атеросклерозом и рассматривается в качестве маркера кардиоваскулярного риска [16, 17]. Толщина эпикардиального жира ассоциируется с нарушенной диастолической функцией левого желудочка и высоким риском развития сердечной недостаточности у пациентов с ожирением [18, 19]. Пороговое значение толщины ЭЖТ в настоящее время еще не определено. Имеются данные, что при толщине ЭЖТ более 5 мм значимо увеличивается риск сердечно-сосудистых заболеваний [20]. В нашем исследовании получены достоверно более высокие значения этого параметра в группе больных ХСН с избыточным ИМТ/ХСН с ожирением относительно больных ХСН с нормальным ИМТ. Известно, что в норме ЭЖТ имеет кардио- и васкулопротективную активность [21]. При этом показатель ее толщины тесно коррелирует с такими маркерами нейрогуморальной активности висцерального жира, как лептин, адипонектин и резистин [22].
Висцеральный жир является гормон-продуцирующей тканью и активно участвует в развитии воспалительных процессов в сосудистой стенке [23]. Параллельно с увеличением жесткости магистральных артерий отмечено снижение сывороточной концентрации адипонектина и возрастание уровня лептина. В настоящее время хорошо известна защитная роль адипонектина и негативная роль лептина в повреждении органов-мишеней, в том числе крупных сосудов [24, 25]. Дисбаланс адипокинового статуса при ожирении играет важную роль в повышении ригидности магистральных артерий. Согласно литературным данным, повышение сывороточного уровня лептина и снижение концентрации адипонектина имеют тесную связь с высокими значениями артериальной жесткости [25, 26]. Адипонектин обладает ангиопротективным эффектом, который в первую очередь связан с противовоспалительной активностью [27, 28]. Снижение концентрации адипонектина приводит к неблагоприятным изменениям структурно-функциональных параметров артерий независимо от других сердечно-сосудистых факторов риска [29].
В свою очередь, гиперлептинемия активирует окислительный стресс, запускает профибротические процессы, что вызывает повышение жесткости сосудистой стенки [30]. В проведенном нами исследовании выявлены тесные корреляционные связи между толщиной эпикардиального жира и концентрацией адипонектина, лептина у больных с ХСН и избыточной массой/ожирением. В литературе также встречаются сведения, подтверждающие, что при увеличении толщины ЭЖТ происходит изменение продукции адипоцитокинов [31]. Кроме того, результаты нашего исследования подчеркивают тесные взаимосвязи между количеством висцерального жира, толщины эпикардиального жира и эластическими свойствами магистральных артерий, что указывает на важную патогенетическую роль висцеральной жировой ткани в прогрессировании сосудистой ригидности у больных ХСН с ожирением. Ряд исследований, проведенных ранее, также демонстрирует независимую взаимосвязь между толщиной ЭЖТ и артериальной жесткостью [32, 33]. Кроме того, толщина эпикардиального жира в большей степени взаимосвязана с жесткостью артерий, чем критерий абдоминального ожирения (ОТ) [22]. Полученная нами линейная зависимость между увеличением толщины ЭЖТ и ростом СРПВэ подтверждает высокую значимость оценки первого параметра у больных ХСН.
Таким образом, установленные корреляционные связи между параметрами, характеризующими степень выраженности висцерального ожирения, и параметрами эластичности магистральных артерий свидетельствуют о важных патогенетических взаимоотношениях у больных ХСН и ожирением.
ЗАКЛЮЧЕНИЕ
В проведенном исследовании выявлена более тесная корреляционная связь СРПВ не с антропометрическими показателями ожирения, а с толщиной ЭЖТ и количеством висцерального жира, определенного методом биоимпедансометрии. Достоверные ассоциации между степенью выраженности висцерального ожирения и показателями эластичности сосудистой стенки отражают важную патогенетическую роль висцеральной жировой ткани в развитии и прогрессировании ригидности артерий у пациентов с ХСН.



