ВВЕДЕНИЕ
Термин «синдром такоцубо» (в переводе с японского «ловушка для ловли осьминога») был введен в Японии Sato H. et al. в 1990 г. [1]. К этому времени коллективом авторов было описано уже пять случаев данного синдрома, который развивался у пациентов на фоне стрессовой ситуации и сопровождался транзиторной акинезией верхушки левого желудочка (ЛЖ) в сочетании с гиперкинезией базальных сегментов с последующим восстановлением систолической функции ЛЖ в сроки от нескольких недель до 3 мес [2].
Встречаемость синдрома такоцубо (СТ) точно неизвестна, однако, согласно различным регистрам, его распространенность среди пациентов, госпитализированных с подозрением на острый коронарный синдром (ОКС) в США и Европе, составляет около 2% [3].
Наиболее частым триггером, провоцирующим СТ, выступает стресс, возникающий на фоне отрицательных эмоциональных реакций на различные жизненные ситуации: смерть близкого человека, ссоры и разводы и т.д. Однако описаны случаи СТ, развивающегося и при положительных переживаниях (так называемое счастливое сердце – happy heart): юбилеях, свадьбах внуков, денежных выигрышах и т.п. Помимо эмоциональных причин, СТ может провоцироваться так называемыми физическими триггерами: обострением соматического заболевания, медицинским вмешательством, наркозом, применением лекарственных препаратов и другими факторами. При этом, по данным литературы, в 11–28% случаев не удается установить тот или иной пусковой фактор, вызвавший развитие СТ [4].
По клинической картине и изменениям на электрокардиограмме (ЭКГ) СТ напоминает ОКС, в связи с чем в 2018 г. в экспертном документе по СТ были представлены обновленные международные диагностические критерии заболевания InterTAK [1].
Что же касается патофизиологических механизмов СТ, то они продолжают изучаться. Ключевыми факторами в развитии СТ считают прямое кардиотоксическое действие на миокард избытка катехоламинов, спазм коронарных микрососудов, вегетативный дисбаланс, оксидативный стресс, воспалительные и метаболические нарушения в миокарде [1, 5].
СТ чаще описывается как доброкачественное заболевание, однако внутригоспитальные осложнения в его остром периоде в большинстве случаев являются жизнеугрожающими, и их частота, согласно данным литературы, колеблется в широком диапазоне: острая сердечная недостаточность – 12–45% случаев, обструкция выходного тракта ЛЖ – 10–25%, митральная регургитация – 14–25% и др. [4, 6, 7].
В последние годы активно изучается течение отдаленного периода заболевания, так как у большинства пациентов, перенесших СТ, несмотря на восстановление фракции выброса (ФВ) ЛЖ, сохраняются жалобы, характерные для хронической сердечной недостаточности (ХСН): одышка, сердцебиения, снижение качества жизни. Оказалось, что и отдаленная летальность у пациентов с СТ сравнима с больными, перенесшими ОКС, составляя ~5,6% пациентов в год, а частота неблагоприятных сердечно-сосудистых событий в целом достигает 9,9% [4]. Необходимо отметить, что информации о факторах, предрасполагающих к развитию осложнений в отдаленном периоде, в литературе крайне мало [3, 10]. Принимая во внимание довольно высокий процент осложнений у больных с СТ в отдаленном периоде, представляется важным выявление предикторов неблагоприятного течения заболевания с целью их своевременной коррекции.
Цель исследования – на основании клинических и лабораторно-инструментальных данных построить модели прогноза риска развития неблагоприятных событий в отдаленном периоде у больных, перенесших СТ.
МАТЕРИАЛ И МЕТОДЫ
Проведено контролируемое когортное клиническое исследование базе ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Минздрава России. Протокол исследования соответствует положениям Хельсинкской декларации, был одобрен локальным этическим комитетом (протокол от 11.11.2020 № 8). Всеми участниками было подписано добровольное информирование согласие.
Критерием включения в исследование был верифицированный на основании международных критериев InterTAK (согласительный документ EOK 2018 г.) диагноз СТ [1]. По протоколу в исследуемую группу было включено 60 пациентов с СТ, чей средний возраст составил 65,5±13,4 лет, из них 55 (91,7 %) женщин (табл. 1).

На первом этапе, в остром периоде заболевания (7–14 дней от его начала) пациентам с СТ выполнялось стандартное обследование: анализировались особенности клинической картины заболевания, результаты лабораторно-инструментальных методов обследования (биохимический анализ крови, клинический анализ крови, электрокардиография, эхокардиография, коронаровентрикулография, периферическая артериальная тонометрия на аппарате EndoPAT 2000 до и после ментального стресс-теста). Выраженность симптомов ХСН на догоспитальном (ретроспективно) и госпитальном этапе оценивалась по шкале ШОКС (оценка клинического состояния при ХСН) в модификации В.Ю. Мареева от 2000 г.
Инструментальная оценка функции эндотелия (эндотелийзависимая вазодилатация) при помощи аппарата EndoPAT 2000 проводилась по стандартной методике c определением индекса реактивной гиперемии – RHI [11]. Значение RHI ранжировалось на две группы: показатели ≤1,67 свидетельствовали об эндотелиальной дисфункции (ЭД), RHI в диапазоне 1,68–3,0 считался критерием нормальной функции эндотелия [11].
Принимая во внимание, что в большинстве случаев триггером развития СТ является эмоциональный стресс, для воспроизведения острой психической стресс-реакции в лабораторных условиях проводилась серия стресс-тестов в соответствии с протоколом, предложенным Д.Ю. Алексеевой с соавт. и опубликованном в ее статье 2016 г.: ментальный стресс-тест Струпа (МТС), тест на арифметический счет (АС), проба воспроизведения/возврата гнева (ВГ), проба «разговор о болезни» (РБ) [12]. Данные тесты достаточно просты и доступны для выполнения у людей разного возраста и уровня образования.
Экспериментальный протокол влияния стресс-проб на функциональную активность эндотелия включал три этапа: 1 – исследование функции эндотелия при помощи аппарата EndoPAT 2000 в покое (15 мин); 2 – последовательное выполнение комплекса ментальных стресс-тестов (МТС, ВГ, АС, РБ); 3 – определение наличия ЭД на аппарате EndoPAT 2000 после ментальных стресс-тестов.
Через 1 год после дебюта заболевания пациентам с СТ выполнялись стандартное клиническое обследование, эхокардиография (ЭхоКГ) с применением методики speckle-tracking (STE) для оценки глобальной продольной и циркулярной деформации ЛЖ (ГПД и ГЦД). В основе методики STE лежит отслеживание траектории движения (tracking) в ходе сердечного цикла акустических маркеров миокарда (speckle) в серошкальном двухмерном ультразвуковом изображении. В результате компьютерной обработки траектории движения акустических пятен получают цифровые значения деформации и скорости деформации ЛЖ (глобальная деформация) в нескольких направлениях – продольном и циркулярном. Преимуществом STE ЭхоКГ является возможность количественной оценки систолической и диастолической функции в полуавтоматическом режиме и снижение субъективности и оператор-зависимости, характерных для стандартной ЭхоКГ. За пороговое значение нормы для ГПД и ГЦД в настоящее время принят уровень ≥18% [13, 14].
Через 1 год от момента возникновения заболевания осуществлялся забор крови для определения уровня эндотелина-1 (ЭТ-1) и циркулирующих эндотелиальных клеток в периферической крови (ЦЭК). ЭТ-1 служит ключевым маркером эндотелиальной дисфункции [15]. В норме он синтезируется только при стимуляции эндотелия различными факторами, в частности адреналином, тромбином, ангиотензином, вазопрессином. Наиболее высокий уровень ЭТ отмечается при мультифокальном атеросклерозе, неспецифическом аортоартериите, облитерирующем тромбангиите, т.е. при заболеваниях, протекающих с повреждением эндотелия [16]. По данным ряда исследований, у пациентов с острым инфарктом миокарда (ИМ) содержание ЭТ-1 выступает предиктором годичной летальности, более значимым, чем содержание норадреналина, натрийуретического пептида и показателей ЭхоКГ [16].
Содержание зрелых циркулирующих эндотелиальных клеток (ЦЭК) в периферической крови отражает целостность сосудистого эндотелия и вполне оправдано может считаться маркером прямого клеточного повреждения и дисфункции эндотелия. Уровень ЦЭК у здоровых людей в периферической крови низкий, так как при отсутствии патологических состояний процесс обновления эндотелия происходит медленно, и нежизнеспособные эндотелиальные клетки быстро удаляются из кровотока ретикулоэндотелиальной системой. Предполагается, что количество ЦЭК в периферической крови отражает системное повреждение эндотелия [17].
Содержание ЭТ-1 в сыворотке крови определялось методом твердофазного иммуноферментного анализа посредством фотометра для микропланшет 680 (Bio-Rad Laboratories, Inc., США), с использованием реагентов ELISA Kit for Endothelin 1 (Cloud-Clone Corp., США). Подсчет количества ЦЭК в периферической крови проводился на проточном цитофлуориметре CY TOMICS FC 500 (Beckman Coulter, США) с применением меченных флуорохромами моноклональных антител к поверхностным маркерам клеток: CD 146-PE (phycoerythrin – фикоэритрин; Becihan Coulter, США) использовался в качестве метки для ЦЭК, CD 45-PC 5 (phycoerythrin + cyanine 5 - фикоэритрин + цианин 5; Beckman Coulter, США) – как панлейкоцитарный маркер.
Кроме этого, через 1 год у пациентов с СТ повторно исследовалась функция эндотелия с помощью аппарата EndoPAT 2000 в покое и после стресс-проб, а также оценивалась выраженность симптомов ХСН по шкале ШОКС.
Статистический анализ полученных данных проводился при помощи пакета компьютерных программ SPSS 17.0 (SPSS Inc., США). Средние величины описаны в виде среднего и стандартного отклонения (M±SD) либо представлены в виде медианы и квартильного размаха (Me [Q1–Q3]). Статистическую значимость отличий оценивали с помощью U-теста Манна–Уитни. Для определения пороговых значений факторов и оценки их диагностической эффективности использовали ROC-кривые. Все параметры были проверены с помощью однофакторного анализа. Алгоритмы оценки риска развития осложнений были построены путем медико-математического моделирования с использованием метода деревьев классификации (CHAID, Chi Squared Automatic Interaction Detection). Многофакторный анализ и построение прогностической модели выполнялись методом бинарной логистической регрессии с пошаговым включением признаков. Критерием статистической достоверности получаемых выводов считали общепринятую в медицине величину р <0,05.
РЕЗУЛЬТАТЫ
Наиболее часто СТ у обследованных пациентов провоцировался негативным стрессом, преимущественно связанным с конфликтами дома или на работе, при этом случаев развития заболевания на фоне позитивных переживаний отмечено не было. У трети больных триггером СТ служил физический фактор (табл. 2): обструктивные заболевания легких (n=5), хирургическое вмешательство (n=3), тромбоэмболия легочной артерии (n=2), острая задержка мочи (n=1), дренирование почки с формированием нефростомы (n=1), химиотерапевтическое лечение онкологического заболевания (n=1), травма (n=1), эклампсия (n=1), инфекция COVID-19 (n=1).

Согласно данным ШОКС, при оценке догоспитального этапа у больных СТ средний балл составил 1 [0–2], а распределение больных по функциональному классу (ФК) сердечной недостаточности было следующим: 1-й ФК – 14 (23,3%), 2-й ФК – 1 (1,7%) человек, у остальных пациентов отсутствовали клинические признаки ХСН. В остром периоде заболевания (7–14-й сутки) у больных с СТ набранный балл по результатам ШОКС был достоверно выше, чем исходный, и составил 6 [5–7] (p <0,05). При этом ХСН у 10 (16,9%) человек соответствовала 3-му ФК, у остальных 49 (83,1%) – 2-му ФК (1 пациент умер в стационаре). В динамике через 1 год средний балл по ШОКС у больных с СТ достоверно снизился – до 4 [2–4] баллов (p <0,05), но не вернулся к исходному догоспитальному уровню. Через год у 30 (53,6%) человек ХСН оценивалась на уровне 2 ФК, у 26 (46,4%) – 1 ФК (3 пациента умерли от сердечно-сосудистых причин).
Неблагоприятное течение СТ через 1 год оценивалось по следующим конечным точкам: прогрессирование хронической сердечной недостаточности (нарастание ФК ХСН), снижение показателей деформации ЛЖ по данным ЭхоКГ с применением методики STE, рецидив СТ, летальный исход (табл. 3).

Средние значения ФВ ЛЖ у больных с СТ при поступлении составили 44,5±9,7%, при выписке этот показатель достоверно увеличился до 60,2±7,6% (p <0,05). Через год в сравнении с данными при выписке наблюдался достоверный прирост ФВ ЛЖ до 61,6±9,2% (p <0,05), а вот через 2 года было зарегистрировано достоверное снижение этого показателя относительно данных, полученных годом ранее, – до 60,0±9,0% (p <0,05). При этом показатели ГПД и ГЦД ЛЖ у 26 обследованных пациентов с СТ (43,3%) через 1 год от момента возникновения заболевания были на уровне 14,0±3,1 и 15,0±4,1% соответственно. При этом только у 2 из 26 этих пациентов значения ГПД и ГЦД были более 18%, еще в 3 случаях при нормальной ГЦД наблюдалась низкая ГПД.
При построении ROC-кривых и однофакторном анализе предикторами прогрессирования ХСН с сохраненной ФВ (сФВ) и сниженной деформации ЛЖ через 1 год оказались показатели, отражающие наличие эндотелиальной дисфункции (ЭД). Такие лабораторные маркеры, как ЦЭК, ЭТ-1 и RHI, через 1 год после ментального стресс-теста с высокой чувствительностью и специфичностью предсказывают прогрессирование ХСН у больных с СТ в течение года в сравнении с догоспитальном этапом (табл. 4). Факторами, определяющими низкие значения ГЦД и ГПД ЛЖ через 1 год, являются RHI в покое в острый период заболевания, RHI в покое и после ментального стресс-теста через 1 год (табл. 4).
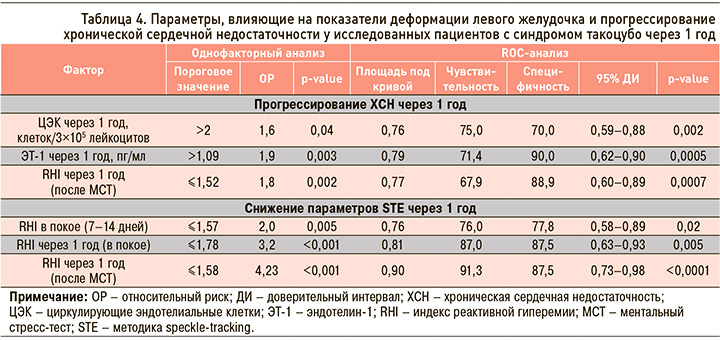
При выполнении многофакторного анализа показателей, достоверно влияющих на ухудшение течения ХСН и нарушение восстановления деформации ЛЖ в отдаленном периоде СТ, выявлено не было. Однако при построении методом CHAID модели риска прогрессирования ХСН и низких параметров ГПД и ГЦД ЛЖ через 1 год от дебюта СТ оказалось, что прогностически значимым предиктором ХСН является возраст старше 54 лет (рис. 1). Такой фактор, как наличие ЭД на фоне экспериментального стресса через 1 год, влиял на показатели ГЦД и ГПД ЛЖ: при RHI после МСТ ≤1,58 вероятность сниженной деформации достигала 95,5% (рис. 2).
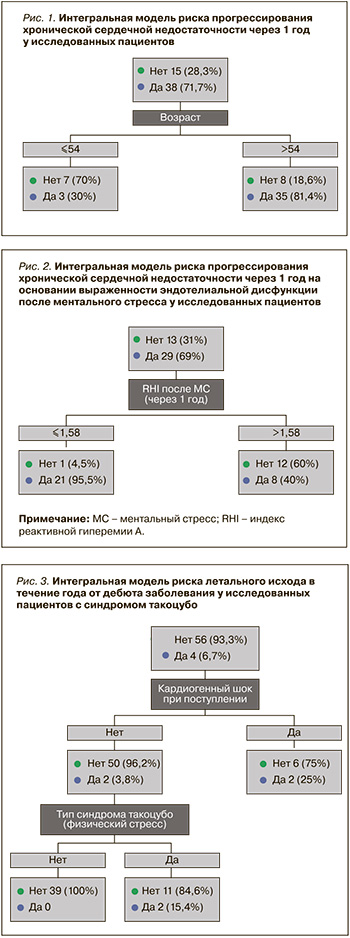
Как указано выше, в отдаленном периоде наблюдалось 4 случая смерти (причины не установлены), также у 2 пациентов был зарегистрирован рецидив СТ. При одно- и многофакторном анализе не удалось выявить предикторы, определяющие риск общей смертности и рецидива заболевания в течение года после возникновения СТ, вероятно, по причине небольшого числа данных событий. Вместе с тем при построении прогностической модели методом CHAID оказалось возможным спрогнозировать летальный исход (рис. 3). Возникновение кардиогенного шока при развитии СТ увеличивает риск смерти в отдаленном периоде до 25%. Кроме того, летальный исход в течение года может случиться в 15,4% случаев, если СТ возник в ответ на физический триггер, а не на эмоциональный фактор (см. рис. 3). Таким образом, предикторами летального исхода в отдаленном периоде СТ выступают кардиогенный шок в остром периоде и физический тип триггера, который стал причиной развития СТ.
ОБСУЖДЕНИЕ
Осложнения в остром периоде болезни при СТ достаточно хорошо изучены в отличие от отдаленного периода заболевания, данные о котором являются достаточно противоречивыми [4, 7]. Ранее СТ описывался как доброкачественное заболевание, однако недавние исследования показали, что отдаленный прогноз у пациентов с СТ сопоставим с таковым у больных соответствующего возраста и пола, перенесших ОКС [7]. По этим данным, отдаленная летальность пациентов, перенесших СТ, составляет 5,6% в год, а частота основных сердечно-сосудистых событий – 9,9% [4, 6]. Рецидив СТ встречается, по одним данным, у 11,4% пациентов в течение 4 лет после первого обращения [7], по другим – у 4,7–5% при наблюдении на протяжении 10 лет [4, 7].
Согласно нашим результатам, в течение года рецидив заболевания был у 3,3% пациентов. Ввиду небольшого числа случаев рецидива СТ нам не удалось выделить параметры, которые могли бы влиять на риск повторного возникновения заболевания. По данным литературы к таким факторам относятся женский пол, низкий индекс массы тела, ранее существовавшие психические заболевания [18, 19].
По результатам настоящего исследования, общая летальность в течение года у обследованных пациентов достигла 6,7% случаев, более детально установить причину смерти этих пациентов не удалось. Независимыми предикторами летального исхода в отдаленном периоде заболевания оказались развитие кардиогенного шока в остром периоде, а также физический характер триггера, который послужил причиной развития СТ. Полученные данные перекликаются с ранее опубликованными работами. Так, по данным Almendro-Delia M. et al. (2018), кардиогенный шок во время госпитализации служит одним из наиболее сильных факторов краткосрочного и долгосрочного летального исхода и в 5 раз повышает риск смерти от всех причин в отдаленном периоде [20].
Принимая во внимание то, что независимыми предиктором летального исхода в отдаленном периоде заболевания оказался физический характер триггера, послуживший причиной развития СТ, большой интерес представляет имеющаяся в литературе информация на эту тему. В соответствии с ней при СТ, вызванном физическими триггерами, наблюдается более высокая смертность в ближайшей и отдаленной перспективе, чем при СТ, спровоцированном эмоциональным стрессом [21, 22]. В работе Lu X. et al. пациенты с СТ были разделены на три класса в соответствии с триггерами заболевания: эмоциональные триггеры – I класс, физические триггеры – II класс, отсутствие идентифицируемого триггера – III класс. Исследование показало, что пациенты с СТ II и III классов имели более высокие показатели 5-летней смертности, чем больные с триггерами класса I [21]. Считается, что эмоциональные триггеры могут иметь фазовую природу и усиливаться, а также ослабевать вместе с эмоциональным состоянием пациента, тогда как физические триггеры способны поддерживать «катехоламиновую бурю», которую нельзя уменьшить без лечения основного заболевания [22].
Еще одна гипотеза, объясняющая неблагоприятный прогноз при наличии физического триггера, заключается в том, что СТ, спровоцированный эмоциональным стрессом, развивается вследствие активации нейронов лимбической системы, которая опосредует вазоконстрикцию, ответственную за оглушение миокарда; следовательно, возникшая микрососудистая дисфункция может быть обратимой. В то же время СТ вследствие физического триггера возникает в результате прямого катехоламин-индуцированного повреждения миокарда с развитием стойких генерализованных микрососудистых нарушений, воспаления, апоптоза и формированием микронекрозов и фиброза миокарда [23].
После перенесенного СТ у большинства больных в отдаленном периоде сохраняются жалобы, характерные для ХСН, несмотря на восстановление ФВ ЛЖ [9]. Как было показано в настоящем исследовании, у всех пациентов с СТ в отдаленном периоде заболевания выраженность симптомов ХСН по шкале ШОКС соответствовала 1–2-му ФК, а в одном случае даже 3му ФК, притом что исходно, до развития СТ, только у 15 человек были признаки ХСН на уровне 1–2-го ФК.
Необходимо отметить, что балл по ШОКС не имел корреляционной связи со значением ФВ ЛЖ, но имел обратную зависимость средней силы от уровня ГПД и ГЦД (-0,49 и -0,48 соответственно; p <0,05). Вероятно, выявленные нарушения глобальной сократимости ЛЖ, определенные с помощью методики STE, являются более точными по сравнению с ФВ ЛЖ и объясняют тот факт, что даже спустя год после СТ у больных остаются клинические признаки ХСН. По фенотипу это ХСН с сохраненной ФВ ЛЖ (ХСНсФВ ЛЖ).
Представляет интерес и тот факт, что у выживших после СТ частота госпитализаций по поводу ХСН была значительно выше, чем у лиц контрольной группы сопоставимого возраста и пола [9]. Эта информация указывает на то, что СТ не является преходящим и доброкачественным состоянием, в связи с чем необходимы дополнительные исследования для изучения механизмов формирования ХСН у данной когорты больных. Scally C. et al. предполагают, что нарушения сократимости ЛЖ могут быть обусловлены сохраняющимися долговременными структурными и метаболическими изменениями в миокарде, которые могут прогрессировать до персистирующего фенотипа сердечной недостаточности [9]. Причиной ХСН могут быть сохраняющиеся воспалительные изменения в миокарде [5, 8, 24].
Мы предлагаем еще один механизм, объясняющий сохранение дисфункции ЛЖ у больных, перенесших СТ. По данным однофакторного анализа в отношении риска прогрессирования ХСН (и выявления сниженных показателей деформации ЛЖ по результатам STE), у обследованных пациентов значимыми предикторами выступили маркеры, отражающие наличие ЭД, такие как уровень ЦЭК, ЭТ-1 и сниженные значения RHI, полученного при помощи методики EndoPAT 2000. В литературе мы не нашли информации об оценке ЭД у пациентов с СТ при помощи EndoPAT 2000, а также уровнях ЭТ-1 и ЦЭК в отдаленном периоде СТ. Причиной, по которой использовалась именно методика EndoPAT 2000, является то обстоятельство, что обнаруженные этим методом нарушения эндотелийзависимой вазодилатации были сопоставимы с результатами интракоронарных проб с ацетилхолином [25]. По данным Bonetti P. et al., пороговое значение RHI ≤1,67, вычисленного с помощью аппарата EndoPAT 2000, свидетельствует об ЭД с чувствительностью 82% и специфичностью 77% [26].
Тот факт, что именно маркеры ЭД выступили в роли предикторов прогрессирования ХСНсФВ ЛЖ и нарушений деформации ЛЖ у наших больных, вполне объясним. В ряде работ ранее было показано, что спустя 5–22 мес после дебюта СТ у больных сохраняется микроваскулярная дисфункция, что подтверждалось внутрикоронарной пробой с ацетилхолином и нарушением перфузии миокарда в ответ на холодовую пробу [1, 5]. Zilberman L. et al. отмечено, что у пациентов, перенесших СТ, наблюдается тенденция к более высокой концентрации ангиогенного белка sFlt1, так называемого рецептора-1 фактора роста эндотелия сосудов, или антиангиогенного фактора (VEGF-R). Этот белок блокирует связь васкулоэндотелиального фактора роста (VEGF) с соответствующими рецепторами на эндотелии, что приводит к нарушению его функций [27].
Есть основания предположить, что микроваскулярные нарушения в миокарде, возникающие вследствие ЭД, являются не только механизмом патогенеза СТ, но и связаны с формированием у пациентов ХСНсФВЛЖ в отдаленном периоде заболевания. В литературе мы нашли ряд исследований, свидетельствующих о прямой связи диастолической дисфункции ЛЖ, которая лежит в основе ХСНсФВЛЖ и микроваскулярной дисфункции вследствие ЭД [28, 29]. При ЭД снижение биодоступности оксида азота (NO) и уменьшение содержания циклического гуанозинмонофосфата и протеинкиназы G в кардиомиоцитах вызывают развитие гипертрофии и фиброза в миокарде, способствуя формированию диастолической дисфункции ЛЖ [29]. Кроме того, нарушение продукции NO неблагоприятно влияет на расслабление субэндокардиальных миоцитов, что также провоцирует диастолическую дисфункцию ЛЖ [30].
Важно также подчеркнуть, что согласно используемой модели CHAID, по нашим данным, основным предиктором нарушений деформации ЛЖ спустя год после дебюта СТ также была ЭД, развивающаяся в ответ на экспериментальный психологический стресс (пороговое значение ≤1,58 с чувствительностью 95,5%). Как известно, психический стресс провоцирует окислительный стресс, который усугубляет ЭД, способствуя дополнительному высвобождению ЭТ-1 и ангиотензина II и нейтрализует действие сосудорасширяющих молекул, тем самым позволяя выявить скрытую ЭД [31]. Таким образом, механизм формирования у больных с СТ в отдаленном периоде фенотипа ХСНсФВ вследствие микроваскулярной дисфункции, на наш взгляд, является вполне вероятным [14, 32].
Прогностически значимым параметром неблагоприятного течения ХСН у наших пациентов оказался также возраст старше 54 лет (чувствительность модели 88,9%). Большинство исследований показало, что у пожилых больных с СТ отдаленные результаты хуже, чем у более молодых пациентов [21]. Согласно анализу долгосрочных результатов, выполненному Cammann V.L. et al., пожилые пациенты с СТ имеют самый высокий уровень смертности по сравнению с больными молодого и среднего возраста. По мнению авторов, это обусловлено тем, что пожилой возраст сам по себе служит негативным прогностическим фактором в связи с наличием у таких пациентов сопутствующих заболеваний и сердечно-сосудистых факторов риска, а также развитием фиброза в миокарде и формированием ХСНсФВЛЖ [33].
В свете полученных данных, учитывая развитие у пациентов, перенесших эпизод острой сердечной недостаточности при СТ, в последующем ХСН, по-видимому, можно согласиться с точкой зрения ряда авторов о том, что СТ является не острым, а хроническим заболеванием, т.е. не синдромом, а кардиомиопатией.
ЗАКЛЮЧЕНИЕ
Информация о предикторах прогрессирования ХСН и летального исхода в отдаленном периоде заболевания у больных с СТ и возможность их прогнозирования с помощью моделей риска позволит более целенаправленно рекомендовать терапию пациентам при выписке из стационара.



