Как известно, артериальная гипертензия, гиперхолестеринемия и курение на 75% определяют структуру смертности от сердечно-сосудистых заболеваний (ССЗ) в России [1]. Коррекция каждого из перечисленных факторов риска является значимым условием увеличения продолжительности жизни человека. Данная статья посвящена мерам по коррекции дислипидемий (ДЛП), что во многом связано с опубликованием в 2016 г. новых европейских рекомендаций [2]. В настоящее время доступным для обсуждения является проект российских рекомендаций по данному вопросу, которые будут приняты в октябре 2017 г. на очередном конгрессе Российского кардиологического общества. Основные положения данного проекта поддерживают последние европейские рекомендации. Ниже изложены «шаги», т.е. последовательность действий врача, направленные на выявление ДЛП и их коррекцию согласно последним рекомендациям.
Шаг 1. Исследования, необходимые для выявления ДЛП
С этой целью в крови исследуют уровни общего холестерина (ОХС), триглицеридов (ТГ), холестерина липопротеидов высокой плотности (ХС ЛПВП) и холестерина липопротеидов низкой плотности (ХС ЛПНП). Последний показатель имеет интегральный характер и является наиболее важным для оценки выраженности ДЛП и ее коррекции. Обычно он вычисляется по формуле Фридвальда: ХС ЛПНП = ОХС – (ХС ЛПВП + ТГ/2,2). Однако в тех случаях, когда уровень ТГ ≥4,5 ммоль/л, формула Фридвальда дает неверные результаты. В этих случаях рекомендовано определение ХС ЛПНП лабораторным путем, что требует дополнительных затрат и применяется нечасто. В российской клинической практике нередко используют такой показатель, как коэффициент атерогенности (ОХС – ХС ЛПВП/ХС ЛПВП). В настоящее время он утратил свое значение и не рекомендуется для использования.
В последние годы установлено, что исследование липидов желательно, но не обязательно проводить натощак. Разница между свободным определением и исследованием после 12-часового предварительного голодания составляет всего 0,2 ммоль/л [3].
Шаг 2. Исключение вторичного характера ДЛП
При обнаружении нарушений липидного обмена, т. е. уровня ОХС ≥5,2 ммоль/л и/или ХС ЛПНП ≥3,0 ммоль/л и/или ТГ ≥1,7 ммоль/л, следует в первую очередь исключить вторичный характер ДЛП, что обусловлено в большинстве случаев гипотиреозом, сахарным диабетом (СД), заболеваниями почек (нефротический синдром), печени (холестаз), поджелудочной железы. При исключении данной патологии следует оценить сердечно-сосудистый риск (ССР) у данного пациента.
Шаг 3. Определение ССР
При наличии только факторов риска данный показатель определяется по известной шкале SCORE [4]. При значении <1% устанавливается низкий риск, при 1–4% – умеренный риск, при 5–9% – высокий риск, при ≥10% – очень высокий риск. Основные изменения в установлении категории риска при наличии ССЗ произошли в 2016 г. Если ранее очень высокий риск устанавливался при наличии ишемической болезни сердца (ИБС), мозга, нижних конечностей, СД с поражением органов-мишеней (прежде всего почек при обнаружении суточной альбуминурии ≥10 мг/г) или операций по реваскуляризации любых сосудистых бассейнов в анамнезе, то в последних рекомендациях обнаружение атеросклеротической бляшки (АСБ) в коронарных, сонных или других периферических артериях, стенозирующей их просвет ≥50%, также относит пациента к категории очень высокого риска, независимо от наличия или отсутствия клинической симптоматики. К пациентам очень высокого риска относятся также больные со скоростью клубочковой фильтрации ≤30 мл/мин/1,73 м2 (ранее было ≤60 мл/мин/1,73 м2). К категории высокого риска относятся пациенты, имеющие хотя бы одно из перечисленных состояний: семейная ДЛП, артериальное давление АГ ≥180/110 мм рт. ст., ОХС ≥8,0 ммоль/л, АСБ со стенозированием от 20 до 50% и скорости клубочковой фильтрации от 30 до 60 мл/мин/1,73 м2. Последние два показателя внесены в перечень критериев в 2016 г.
Шаг 4. Определение целевых уровней липидов в зависимости от величины ССР
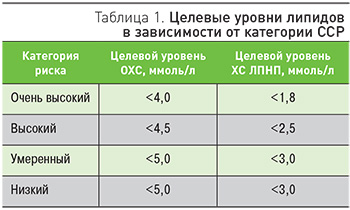 Оптимальное установление величины данных показателей является в настоящее время предметом широкой дискуссии. С учетом действующих российских и европейских рекомендаций, желаемые целевые уровни ОХС и ХС ЛПНП в зависимости от величины ССР представлены в табл. 1.
Оптимальное установление величины данных показателей является в настоящее время предметом широкой дискуссии. С учетом действующих российских и европейских рекомендаций, желаемые целевые уровни ОХС и ХС ЛПНП в зависимости от величины ССР представлены в табл. 1.
Хотя на первый взгляд целевые уровни липидов не изменились существенно по сравнению с прежними рекомендациями, в документе 2016 г. указано, что при очень высоком риске концентрация ХС ЛПНП должна быть снижена на 50% при его исходном уровне от 1,8 до 3,5 ммоль/л (уровень доказанности IB), а при высоком риске – также на 50% при его исходном уровне от 2,6 до 5,2 ммоль/л (уровень доказанности IIB). Однако в проекте российских рекомендаций, принятие которых ожидается в конце 2017 г., целевой уровень ХС ЛПНП у пациентов очень высокого ССР представлен как ≤1,5 ммоль/л. Это связано с тем, что только при таком значении ХС ЛПНП атеросклеротический процесс перестает прогрессировать. Нижний уровень допустимого снижения ХС ЛПНП определен как 0,9 ммоль/л [2].
Шаг 5. Установление необходимости назначения липидснижающей терапии (ЛСТ)
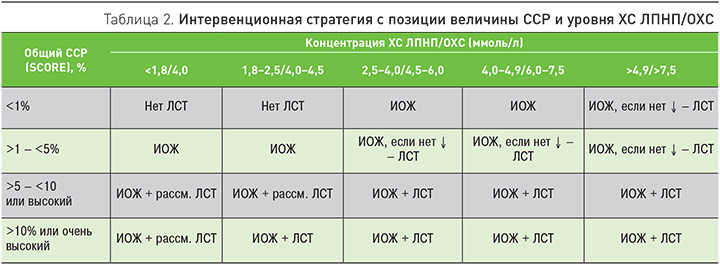
В 2011 г. эксперты Европейского общества атеросклероза впервые предложили таблицу, определяющую необходимость назначения ЛСТ в зависимости от величины ССР и уровня ХС ЛПНП [5]. Мы позволили себе дополнить данную таблицу значениями ОХС, который повсеместно значительно более доступен для определения. Это тем более уместно, учитывая, что в последних европейских рекомендациях уровень ОХС также признан мишенью для ЛСТ (уровень доказанности IIA), наряду с показателем ХС ЛПНП (уровень доказанности IA). Справедливости ради следует отметить, что в российских рекомендациях 2012 г. для ОХС уже был определен целевой уровень [4].
Как следует из табл. 2, в зависимости от величины ССР и уровня ХС ЛПНП/ОХС возможны 3 ситуации: 1) нет необходимости в назначении ЛСТ. Рекомендуется изменение образа жизни (ИОЖ); 2) если ИОЖ через 3–4 мес не привело к достижению целевых уровней липидов, то следует рассмотреть вопрос о назначении ЛСТ; 3) при высоком и особенно очень высоком риске в большинстве случаев необходимо сразу назначить ЛСТ, наряду с мероприятиями по ИОЖ.
Следует особо отметить, что при установлении диагнозов ИБС, цереброваскулярных заболеваний, атеросклеротических заболеваний периферических сосудов, СД с поражением органов-мишеней ЛСТ назначается в обязательном порядке независимо от уровней липидов. Все перечисленные состояния классифицируются как ССЗ с очень высоким ССР.
Шаг 6. Выбор препаратов для коррекции ДЛП
До недавнего времени к средствам для лечения ДЛП относили статины, фибраты, ингибитор всасывания холестерина в кишечнике эзетимиб, секвестранты жирных кислот, никотиновую кислоту, ω-3-полиненасыщенные жирные кислоты. Однако в последние годы единственной группой препаратов, которая надежно осуществляет коррекцию ДЛП и оказывает выраженный клинический эффект, являются статины (уровень доказанности IA) [2, 3]. Эзетимиб снижает уровень ХС ЛПНП на 15–25%, однако до настоящего времени отсутствуют доказательства его изолированного клинического воздействия. В связи с этим он применяется лишь в дополнение к терапии статинами или при их непереносимости. Перспективной представляется относительно новая группа препаратов – моноклональные антитела к PSCK9, которые в инъекционном введении 1–2 р/мес снижают уровень ХС ЛПНП на 50–70%. В марте 2017 г., после окончания исследования FOURIER, получены данные и о существенном клиническом эффекте данной группы препаратов [6]. В настоящее время они зарегистрированы как средства, применяемые вместе со статинами при недостаточной их эффективности или непереносимости. Широкое использование данного класса препаратов сдерживает их высокая стоимость.
Остальные перечисленные выше группы препаратов утратили свое значение и не рекомендуются более для рутинного использования в клинической практике [2, 3].
Таким образом, статины являются на сегодняшний день единственным классом препаратов, которые показали свою высокую эффективность как в первичной [7], так и во вторичной профилактике ССЗ. Статины позитивно влияют на прогноз заболевания, увеличивая продолжительность жизни пациентов.
Статины обладают еще рядом весьма важных эффектов, которые принято называть дополнительными, или плейотропными. Однако часть этих воздействий настолько важна и полезна, что некоторые исследователи считают их даже более существенными, чем гиполипидемический [8]. Ниже перечислены наиболее весомые из них: 1) улучшение эндотелиальной функции, которое осуществляется за счет выработки оксида азота и стимуляции ангиогенеза; 2) противовоспалительный и иммуномодулирующий эффекты, которые выражаются в снижении уровня С-реактивного белка и выработки провоспалительных цитокинов; 3) антитромботический эффект, который сопровождается повышением выработки тканевого активатора плазминогена, снижением реактивности и адгезии тромбоцитов, синтеза тромбоксана А и концентрации фибриногена; 4) стабилизация АСБ, которая происходит за счет ингибирования миграции макрофагов, снижения выработки протеолитических ферментов, факторов тканевой совместимости и образования свободных радикалов; 5) эффекты статинов, ассоциирующиеся с улучшением формирования костной ткани, ослаблением опухолевого роста, замедлением или предотвращением синильной деменции, стимуляцией неоваскуляризации, снижением литогенности желчи.
Шаг 7. Какой из статинов выбрать для лечения конкретного пациента?
В России зарегистрировано 7 статинов: ловастатин, симвастатин, правастатин, флувастатин, аторвастатин, розувастатин и совсем недавно питавастатин. В последние годы появились весомые ограничения в отношении широкого использования симвастатина. Это связано с тем, что по результатам исследований 4S и HPS клинический эффект препарата проявляется только через 3–4 года. Кроме того, симвастатин не следует использовать в дозе более 20 мг совместно с амлодипином, ранолазином и более 10 мг совместно с амиодароном, верапамилом и дилтиаземом из-за выраженных взаимодействий с данными препаратами.
Чаще всего используют аторвастатин и розувастатин. При выборе между данными препаратами следует руководствоваться тем, что аторвастатин липофилен, т. е. проникает через гематоэнцефалический барьер, метаболизируется в печени и выводится через кишечник, а розувастатин гидрофилен, т. е. не накапливается в мозговой ткани и выводится почками. Следовательно, при цереброваскулярных заболеваниях, хронических заболеваниях печени предпочтение следует отдавать розувастатину, а при тяжелых поражениях почек – аторвастатину. Кроме того, розувастатин слабо взаимодействует с другими лекарствами и в одной и той же дозе оказывает в 2–2,5 раза более выраженный эффект, чем аторвастатин.
Недавно в нашей стране начал применяться новый оригинальный статин – питавастатин. Его отличительными особенностями являются: 1) высокое сродство к рецепторам ЛПНП, вследствие чего эффект проявляется в меньших дозах (1, 2 и 4 мг); 2) высокая биодоступность и длительный период полувыведения, что уменьшает вероятность его межлекарственного взаимодействия с другими препаратами; 3) питавастатин занимает лидирующее место среди статинов по способности повышать уровень ХС ЛПВП; 4) препарат в наименьшей степени по сравнению с другими статинами влияет на инициацию СД. Отмечено, что после двух лет его применения гликозилированный гемоглобин имеет даже тенденцию к снижению [9, 10].
Шаг 8. Какую дозу статина назначить пациенту?
Выбор дозы назначаемого статина зависит от трех обстоятельств: клинической ситуации, степени выраженности ДЛП и уровня ССР. Так, согласно стандарту ведения больных с острым коронарным синдромом (нестабильная стенокардия, инфаркт миокарда с подъемом или без подъема сегмента ST), пациенту назначают максимальную дозу статина, т. е. 80 мг аторвастатина или 40 мг розувастатина без учета степени ДЛП. В возрасте старше 75 лет доза уменьшается в 2 раза. Дискутабельным является в настоящее время вопрос, в течение какого времени больному следует принимать такую дозу препарата? Согласно американским рекомендациям 2013 г. [11, 12], не менее 5 лет или неопределенно долго. Европейские рекомендации больше ориентируют в решении данного вопроса на достижение целевых уровней липидов при очень высоком ССР или на снижение концентрации ХС ЛПНП не менее чем на 50% от исходного уровня. При стабильных формах ИБС, цереброваскулярных заболеваниях, атеросклерозе периферических сосудов, СД также необходимо достижение целевых уровней при очень высоком ССР. Обычно это дозы аторвастатина 40–80 мг или розувастатина 20–40 мг. У пациентов с наличием только факторов риска ССЗ назначение и доза статинов определяются в зависимости от выраженности ДЛП и степени ССР (табл. 2).
Шаг 9. Как часто контролировать уровень ДЛП и безопасность лечения статинами?
Перед назначением статинов, кроме показателей липидного обмена, определяются уровни билирубина, АлАТ, АсАТ, креатинфосфокиназы, креатинина и скорости клубочковой фильтрации. После назначения любого статина повторное определение липидов и вышеперечисленных показателей проводится через 6–8 нед. При достижении целевого уровня липидов, нормальных показателей функционального состояния печени и почек повторное исследование всех данных проводят через 3 мес, а затем 1–2 раза в год. При недостижении целевых уровней липидов дозу статина повышают или присоединяют к лечению эзетрол в дозе 10 мг.
При трехкратном превышении уровней трансаминаз верхних границ нормы (ВГН) или пятикратном превышении ВГН уровня креатинфосфокиназы статины отменяют, а при двукратном превышении уровней ферментов ВГН их дозу уменьшают вдвое. Если через 2 нед после отмены статинов ферменты не нормализуются, то следует искать другую причину их повышения.
Шаг 9. Как долго следует проводить лечение статинами?
При наличии у пациента высокого и очень высокого ССР неопределенно долго. При снижении категории риска – в зависимости от рекомендаций, приведенных в табл. 2.



