ВВЕДЕНИЕ
Частота возникновения первичной преждевременной овариальной недостаточности (ПОН) составляет 1% среди женщин в возрасте до 40 лет и 0,1% среди женщин до 30 лет [1, 2]. Частота развития вторичной ПОН отличается в различных странах и связана с распространенностью заболеваний, следствием которых она является [2].
Критерием первичной ПОН служит прекращение менструации сроком не менее чем на 4 мес и уровень фолликулостимулирующего гормона (ФСГ) более 40 МЕ/л [3].
На сегодняшний день доказано, что ПОН ассоциирована с эндотелиальной и вегетативной дисфункцией, дислипидемией и метаболическим синдромом [2, 3]. У женщин с ПОН наблюдаются увеличение толщины комплекса интима-медиа сонной артерии и изменение диастолической функции левого желудочка [6]. Goldmeier S. et al. показали, что даже при приеме заместительной гормональной терапии (ЗГТ) у женщин с ПОН в сравнении со здоровыми лицами сохраняются ослабленная чувствительность к барорефлексу (3,9±1,38 против 7,15±3,62 мс/мм рт.ст.) и пониженная вариабельность сердечного ритма (2310±1173 против 3754±1921 мс2) [7]. В исследовании Knauff E.A. et al. [6] у женщин с ПОН (n=90) уровень триглицеридов (ТГ) оказался значительно выше (средняя разница 0,17 лог-ммол/L [95% доверительный интервал (ДИ): 0,06–0,29]), а уровень холестерина липопротеидов высокой плотности (ЛПВП) ниже по сравнению с контрольной группой (n=198) после коррекции с учетом возраста, индекса массы тела (ИМТ) и курения. Эта разница не была подтверждена в меньшем по размеру исследовании Gulhan I. et al., включавшем 47 пациенток с ПОН и 60 лиц из контрольной группы [5]. Тем не менее в этом исследовании были выявлены значительно более высокие уровни ТГ и липопротеидов очень низкой плотности (ЛПОНП) у пациенток с ПОН, у которых наблюдалась значимая отрицательная корреляция между эстрадиолом и уровнями ТГ (r=-0,291, p=0,047). Недавно Ates S. et al. [8] сообщили об увеличении уровней ТГ и холестерина ЛПВП у женщин с ПОН (n=59) в сравнении со здоровыми женщинами из группы контроля (n=59). В исследованных группах были зарегистрированы аналогичные уровни глюкозы, инсулина, HOMA-IR (индекса инсулинорезистентности), холестерина липопротеинов низкой плотности (ЛПНП) и ТГ, однако частота метаболического синдрома была значительно выше среди пациенток с ПОН [9]. Другие авторы, напротив, обнаружили увеличение сывороточной глюкозы, инсулина и индекса HOMA-IR у женщин с ПОН (n=43) относительно контроля (n=33) [8].
Несмотря на наличие противоречивых данных по липидному профилю и индексам инсулинорезистентности, общий сердечно-сосудистый риск у женщин с ПОН, по-видимому, значительно увеличен, о чем свидетельствует анализ причин смертности в этой когорте. Особенно это касается ишемической болезни сердца (ИБС), риск смерти от которой у женщин с ПОН повышается примерно на 80% относительно женщин с менопаузой в возрасте 49–55 лет [10].
В целом у женщин с ПОН увеличен риск смерти от всех причин. По данным крупного Норвежского исследования с участием 19 731 женщины, было обнаружено, что наступление менопаузы до 40 лет связано с повышением смертности на 1,06 (95% ДИ: 0,99–1,14) в сравнении с женщинами, у которых менопауза наступила в возрасте 50–52 лет [11]. Также было установлено, что ранняя менопауза сокращает ожидаемую продолжительность жизни. Данные проспективного когортного исследования 68 154 взрослых женщин из США продемонстрировали, что среди женщин, сообщивших о наступлении менопаузы в возрасте 40–44 лет, смертность от всех причин выше по сравнению с женщинами с наступившей менопаузой в возрасте 50–54 лет (коэффициент процента (КП) 1,04; 95% ДИ: 1,00–1,08) [12]. Повышенный риск смерти от всех причин в этом исследовании в основном был ассоциирован со смертностью от сердечно-сосудистых заболеваний (КП 1,09; 95% ДИ: 1,00–1,18), болезней дыхательных системы (КП 1,19; 95% ДИ: 1,02–1,39), мочеполовых заболеваний (КП 1,39; 95% ДИ: 1,07–1,82) и внешних причин (КП 1,56; 95% ДИ: 1,21–2,02) [13].
Не так давно Европейское общество репродукции человека и эмбриологии (ESHRE) опубликовало руководство по ведению больных с ПОН [14]. По мнению экспертов, женщин с ПОН в первую очередь необходимо консультировать по вопросам снижения факторов риска ССЗ. С целью уменьшения риска преждевременной смерти им следует отказаться от употребления алкоголя и никотина, заняться регулярными, но не чрезмерными физическими нагрузками, поддерживать нормальную массу тела, а также прекратить бесконтрольный прием антидепрессантов как средства лечения повседневных стрессов. Оценка кардиоваскулярного риска должна состоять из ежегодного мониторинга артериального давления, уровня холестерина, ИМТ, а также статуса курения.
Цель исследования – оценить 10-летний риск развития сердечно-сосудистых заболеваний (ССЗ), рассчитанный с использованием Фрамингемской шкалы оценки (FRS) и SCORE2, а также рассчитать риск развития фатальных осложнений у пациенток с различной этиологией ПОН в сравнении со здоровыми женщинами.
МАТЕРИАЛ И МЕТОДЫ
Исследование было проспективным, когортным, наблюдательным.
Критериями включения в исследование были подписанное информированное согласие, женский пол, возраст наступления менопаузы до 40 лет, наличие аменореи ≥4 мес, уровень ФСГ выше 40 МЕ/л или доказанный ранее диагноз ПОН.
Критериями исключения служили мужской пол, возраст старше 45 лет, отсутствие подписанного информированного согласия пациента на участие в исследовании.
В группу пациентов со вторичной ПОН включались женщины, перенесшие двухстороннюю овариоэктомию по поводу различных онкологических заболеваний.
В общей сложности в исследование вошли 133 пациентки с первичной ПОН, 133 – со вторичной ПОН и 133 женщины без ПОН (контрольная группа).
Для оценки сердечно-сосудистого риска использовались шкалы FRS, SCORE и SCORE2. Шкалы FRS и SCORE2 применялись для оценки 10-летнего риска развития ССЗ. Применение сразу двух шкал позволяло более объективно оценить кардиоваскулярный риск и снизить вероятность его недо- или переоценки. Другой целью задействования сразу двух шкал было определение шкалы с наибольшей чувствительностью к ПОН, что в дальнейшем можно было бы использовать в реальной клинической практике. Шкала SCORE использовалась для расчета 10-летнего риска развития смерти от ССЗ, а также для получения статистических данных о ее возможном использовании в клинической практике у пациенток с ПОН.
Во всех трех группах исследования был оценен 10-летний риск развития ССЗ, рассчитанный с помощью шкал FRS и SCORE2, а также риск развития смерти от тех же заболеваний по шкале SCORE у пациенток с ПОН в сравнении со здоровыми женщинами (контролем). Классические шкалы оценки сердечно-сосудистого риска применялись в оригинальном виде и не подвергались авторским изменениям.
При наличии у пациенток ССЗ, ассоциированных с высоким риском, расчет кардиоваскулярного риска по SCORE и SCORE2 не проводился, а риск изначально определялся как 10% (что соответствует высокому риску).
По шкале FRS сердечно-сосудистый риск оценивается как низкий при 10-летней вероятности развития ССЗ менее 10%, как промежуточный – при 10–20%, как высокий – при более 20%. Согласно шкале SCORE2, низким считается риск менее 2,5%, умеренным – 2,5–7,5%, высоким – более 7,5%. В соответствии со шкалой SCORE сердечно-сосудистый риск менее 1% классифицируется как низкий, от 1 до 5% – как умеренный, от 5 до 10% – как высокий, более 10% – как очень высокий.
Расчет рисков по различным шкалам выполнялся математически по формулам в соответствии с рекомендациями по использованию SCORE, SCORE2 и FRS. При оценке риска по шкалам SCORE2 и SCORE пациентки с ИБС и сахарным диабетом были исключены из расчета как лица, имеющие высокий риск.
Все группы были сопоставимы по полу, возрасту и ИМТ.
РЕЗУЛЬТАТЫ
Данные сердечно-сосудистых и других параметров у пациенток в трех исследуемых группах приведены в таблице 1. Из нее следует, что пациентки не различались по возрасту, полу, статусу курения и ИМТ. Между собой группы пациенток с различными формами ПОН также не различались по средней длительности постменопаузального периода. Однако частота прием ЗГТ была выше в группе вторичной ПОН по сравнению с первичной (82 против 27%, р <0,05).

Во всех трех группах был рассчитан 10-летний риск развития ССЗ с использованием шкал FRS и SCORE 2, а также определен риск развития смерти от тех же причин по шкале SCORE. Полученные результаты отражены в таблице 2.
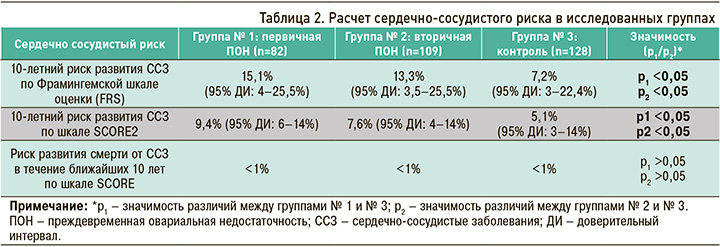
Как уже отмечалось ранее, при оценке сердечно-сосудистого риска пациентки с ИБС и сахарным диабетом были исключены из расчетов как лица, уже имеющие высокий риск. В итоге в первой группе осталось 82 человека, во второй – 109, в третьей – 128.
10-летний риск развития ССЗ, оцененный по шкале FRS, оказался статистически значимо повышен у пациенток с ПОН относительно контрольной группы. У женщин с первичной ПОН он составил в среднем 15,1% (95% ДИ: 4–25,5%; p <0,05), что соответствует умеренному 10-летнему риску развития ССЗ. У женщин со вторичной ПОН этот показатель в среднем равнялся 13,3% (95% ДИ: 3,5–25,5%; p <0,05), что также соответствует умеренному 10-летнему риску развития ССЗ. В свою очередь, в контрольной группе он составил 7,2% (95% ДИ: 3–22,4%; p <0,05), т.е. у входивших в нее участниц имелся низкий 10-летний риск развития ССЗ.
10-летний риск развития ССЗ по шкале SCORE2 также был статистически значимо повышен у женщин с ПОН в сравнении с контролем. У пациенток с первичной ПОН он равнялся в среднем 9,4% (95% ДИ: 6–14%; p <0,05), что соответствует высокому 10-летнему риску развития ССЗ. У женщин со вторичной ПОН среднее значение этого показателя составило в среднем 7,6% (95% ДИ: 4–14%; p <0,05), что также соответствует высокому 10-летнему риску развития ССЗ. Наконец, в контрольной группе он находился на уровне 5,1% (95% ДИ: 3–14%; p <0,05), т.е. здесь наблюдался умеренный 10-летний риск развития ССЗ.
Риск развития смерти от ССЗ в течение ближайших 10 лет, рассчитанный по шкале SCORE, в группах женщин, страдающих ПОН, и в группе контроля статистически значимо не различался и соответствовал низкому риску – менее 1%.
Таким образом, у пациенток с первичной и вторичной ПОН не только значимо чаще встречались ИБС и сахарный диабет (45 и 20% соответственно), но и были повышены сердечно-сосудистые риски по сравнению с контролем.
ОБСУЖДЕНИЕ
Полученные данные свидетельствуют о том, что у женщин с ПОН повышен 10-летний риск развития ССЗ. Эта закономерность была выявлена при расчете 10-летнего риска развития ССЗ как по шкале FRS, так и SCORE2. При этом риск развития ССЗ оказался выше в группе пациенток с первичной ПОН, нежели в группе со вторичной формой заболевания. Риск смерти от ССЗ в течение ближайших 10 лет, рассчитанный по SCORE, в исследованных группах статистически значимо не различался. Следует отметить, что бремя ССЗ в обоих группах ПОН было выше, чем в контрольной, и достигало 45% среди пациенток с ПОН первичной этиологии.
При сравнении полученных результатов с другими, ранее нами опубликованными [15], можно увидеть, что вне зависимости от используемой шкалы оценки пациенты с ПОН имеют более высокий 10-летний риск развития ССЗ, но при этом не имеют более высокого 10-летнего риска развития смерти от тех же заболеваний.
Приблизительно такие же результаты получены в ряде иностранных исследований [12, 13], где также был выявлен более высокий риск развития ССЗ у пациенток с ПОН. В свою очередь, в исследовании Jacobsen B.K. et al. [11] у женщин с ПОН, помимо более высокого риска развития самих ССЗ, наблюдался также более высокий риск развития смерти от этих заболеваний.
Хотя точные числовые значения кардиоваскулярного риска и различаются от исследования к исследованию, во всех них прослеживается общая тенденция повышения риска развития ССЗ у женщин, страдающих ПОН.
Среди ограничений нашего исследования стоит отметить разную частоту приема ЗГТ в группах пациенток с первичной и вторичной ПОН. Это могло привести к более выраженному снижению сердечно-сосудистого риска в группе вторичной ПОН. Однако, несмотря на эти изменения, кардиоваскулярный риск в группе вторичной ПОН все равно оставался более высоким по сравнению с контролем.
ЗАКЛЮЧЕНИЕ
У женщин с ПОН независимо от ее этиологии отмечалось более высокое бремя ССЗ (45 и 20% в группах с первичной и вторичной ПОН) и 10-летнего кардиоваскулярного риска, рассчитанного с использованием шкал FRS и SCORE2. Риск развития фатальных сердечно-сосудистых событий в течение ближайших 10 лет, рассчитанный по шкале SCORE, статистически значимо не различался между пациентками с различными формами ПОН и здоровыми женщинами.



