ВВЕДЕНИЕ
Язвенный колит (ЯК) и болезнь Крона (БК), относящиеся к группе воспалительных заболеваний кишечника (ВЗК), являются хроническими заболеваниями с прогрессирующим течением при отсутствии адекватной терапии [1, 2].
На данный момент основной метод диагностики ВЗК – анализ клинико-анамнестических данных, а также проведение видеоколоноскопии с морфологическим исследованием [1, 2]. Однако в связи с отсутствием характерных признаков даже в развитых странах ВЗК нередко диагностируются спустя несколько месяцев и лет с момента манифестации заболевания [1, 2, 3–6]. Так, задержка верификации БК составляет от 3,4 до 23 мес, а ЯК – от 2 до 10 мес [3, 4]. Более того, от 8 до 25% пациентов остаются без диагноза более 24 мес, что может приводить к увеличению числа осложненных форм БК и потребности хирургического лечения как при ЯК, так и БК [5–9]. По нашим данным, в Санкт-Петербурге БК в среднем диагностируется спустя 27,4 мес, а ЯК – 12,1 мес, что коррелирует с зарубежными данными [10].
В последнее десятилетие в гастроэнтерологии все чаше начинает использоваться и внедряться в практику искусственный интеллект (ИИ) на основе сетей глубокого обучения, который позволяет в более короткие сроки и с большей точностью выявлять то или иное заболевание [11–13].
Цель исследования – разработать метод диагностики и дифференциальной диагностики ВЗК с использованием ИИ посредством анализа эндоскопических изображений.
МАТЕРИАЛ И МЕТОДЫ
Формирование базы изображений проводилось при обследовании пациентов в условиях Северо-Западного центра ВЗК (на базе Северо-Западного государственного медицинского университета (СЗГМУ) им. И.И. Мечникова, г. Санкт-Петербург) и отделения гастроэнтерологии клиники Петра Великого. В исследование включались данные пациентов старше 18 лет с верифицированными диагнозами ЯК и БК толстой кишки. Исследование было одобрено локальным этическим комитетом СЗГМУ им. И.И. Мечникова.
Диагноз ВЗК устанавливался с учетом российских клинических рекомендаций по ведению пациентов с ЯК и БК [1, 2]. Основным условием включения в исследование было наличие эндоскопических признаков обострения основного заболевания: SES-CD (Simple endoscopic score – простая эндоскопическая шкала болезни Крона) >2 баллов для БК и >1 балла по шкале Schroeder для ЯК [1, 2, 14].
Из исследования исключались пациенты с ремиссией ВЗК, недифференцированным колитом и подтвержденными кишечными инфекциями. Группой сравнения выступали пациенты, у которых при выполнении видеоколоноскопии (ВКС) отсутствовали патологические изменения слизистой оболочки толстой кишки.
Всем пациентам выполнялась ВКС эндоскопами высокого разрешения (CF H185L, Olympus Medical Systems, Токио, Япония, EC-3890LZi, Pentax Lifecare Division, Токио, Япония) с осмотром всех отделов толстой кишки и фотофиксацией в эндоскопическом отделении клиники Петра Великого. Часть изображений толстой кишки пациентов была включена ретроспективно, и они были обезличены. Пациенты, проходившие ВКС проспективно, подписали информированное согласие на участие в исследовании и вошли в валидационную когорту.
Этапы формирования базы данных изображений и обучения искусственных нейронных сетей
При проведении ВКС были получены цифровые изображения слизистой оболочки толстой кишки (варианты нормы и варианты с патологическими изменениями слизистой оболочки), которые имели одинаковый размер в формате JPEG с разрешением 1350×1080 пикселей. Все снимки оценивались врачом-экспертом, были удалены засвеченные и нечеткие изображения, изображения с артефактами и посторонними предметами. В дальнейшем изображения были приведены к размеру 256×256 пикселей и подвергнуты фильтрации с использованием фильтра нелокального среднего [15] и улучшению контраста методом адаптивной контрастно-ограниченной эквализации гистограммы [16].
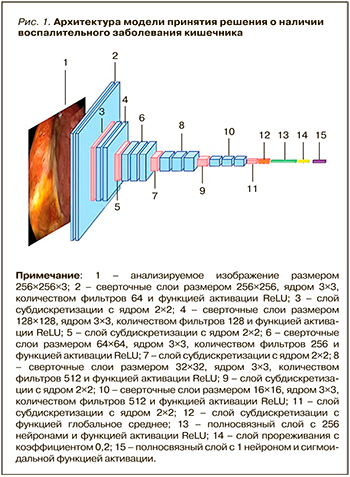
Для выявления и дифференциальной диагностики ВЗК были разработаны две искусственные нейронные сети (ИНС): одна определяла наличие или отсутствие ВЗК, вторая принимала решение о нозологической форме при ВЗК – ЯК или БК. Ввиду ограниченного массива изображений для обучения модели с нуля ИНС была основана на сверточной нейронной сети VGG16 [17], обученной на миллионах изображений из базы ImageNet. Для классификации эндоскопических изображений полносвязный слой сети VGG16 был заменен разработанной моделью, построенной из слоя субдискретизации, трех полносвязных слоев и слоя прореживания.
Обе модели состояли из 23 слоев, но только 15 из них имели весовые коэффициенты (13 сверточных слоев и 2 полносвязных; рис. 1). При обучении на вход первого сверточного слоя подавались цветные изображения с разрешением 256×256 пикселей и далее проходили через 5 блоков, включающих сверточные слои с размером окна 3×3 и фильтрами размером 64, 128, 256, 512 и 512. В конце каждого блока присутствовал слой субдискретизации. После сверточных слоев и слоев субдискретизации располагалась так называемая верхняя модель, состоящая из двух полносвязных слоев: первый слой имеет 256 нейронов, а последний – 1 нейрон. Между полносвязными слоями был добавлен слой прореживания с коэффициентом 0,2. Сверточные и полносвязные слои имели функцию активации ReLu, а выходной полносвязный слой – сигмоидальную функцию активации. Если на выходном слое после подачи изображения было значение «патология», то далее оно передавалось на вторую модель, которая уже давала заключение о виде ВЗК.
Обучение первой модели для выявления патологии проводилось на протяжении 50 эпох с использованием оптимизатора SGD шагом обучения 0,0001. Обучение модели, дифференцирующей ЯК и БК, выполнялось на протяжении 25 эпох с применением оптимизатора SGD шагом обучения 0,0001. Обучение ИНС осуществлялось с помощью открытых библиотек Keras и TensorFlow на языке программирования Python (версия 3.7.9). Получено положительное заключение на заявку на патент 2021125698/14(054302) «Способ дифференциальной диагностики болезни Крона или язвенного колита» (дата подачи 31.08.2021).
Статистика
Для оценки адекватности разработанной сверточной нейронной сети использовалась матрица неточностей, на основе которой были рассчитаны полнота, точность и F-мера.
РЕЗУЛЬТАТЫ
Для участия в этапе обучения ИНС выявлять патологию и дифференцировать ЯК и БК нами включено 435 пациентов, прошедших ВКС. Из исследования было исключено 104 пациента с отсутствием диагностических признаков ВЗК при эндоскопическом исследовании, данных об исключении инфекционных причин изменения слизистой оболочки, а также с ремиссией основного заболевания (рис. 2).
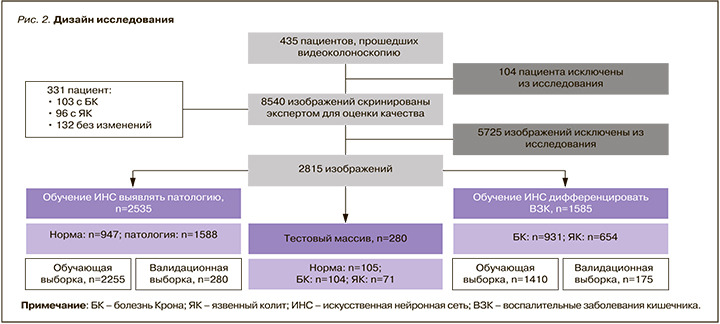
Врачом-экспертом были оценены 8540 цифровых изображений от 331 пациента, 5725 из которых оказались неинформативными из-за наличия элементов эндоскопа, бликов, нечеткости изображения, невозможности оценить слизистую вследствие плохой подготовки к исследованию. В итоге исследование были включены 2815 изображений, которые соответствовали заданным критериям.
Количество изображений по группам
Модель для выявления ВЗК была обучена на массиве, состоящем из 2535 изображений двух классов, – «норма» и «патология». Класс «норма» включал 947, «патология» – 1588 изображений. Для обучения модели массив изображений был разделен на обучающую и валидационную выборки: в первую вошли 2255, во вторую – 280 изображений.
Для обучения ИНС дифференциации между БК и ЯК был использован массив из 1585 изображений двух классов – «болезнь Крона» и «язвенный колит». Класс «болезнь Крона» состоял из 931, а «язвенный колит» – 654 изображений. Для обучения модели массив изображений был разделен на обучающую и валидационную выборки. Таким образом, обучающая выборка содержала 1410, а валидационная – 175 изображений.
Также был выделен тестовый массив из 280 изображений, который не участвовал в обучении моделей: класс «норма» – 105, «БК» – 104, «ЯК» – 71 изображение.
При обучении моделей для выявления ВЗК была произведена аугментация изображений обучающей выборки со следующими параметрами: поворот на 30 градусов, отражение по горизонтали, смещение изображения на 20% по вертикали и горизонтали.
Адекватность моделей выявления патологии и верификации ВЗК оценивалась ее точностью и значением функции потерь при обучении и валидации (табл. 1).
При обучении на массиве изображений первая ИНС могла выявлять патологию с точностью 90,5%, а дифференцировать виды патологий с точностью 83,7%. При валидации моделей точность составляла 89,35 и 81,9% соответственно.
Далее ансамбль моделей принятия решения о наличии и виде ВЗК был апробирован на тестовом массиве изображений, после чего были рассчитаны полнота, точность и F-мера. Результаты оценки адекватности ансамбля моделей представлены в таблице 2.
После апробации на тестовом массиве (табл. 3) ИНС могла выявлять норму с точностью 88%, ЯК – 90%, БК – 90%; при этом общая точность ансамбля составила 84,6%.
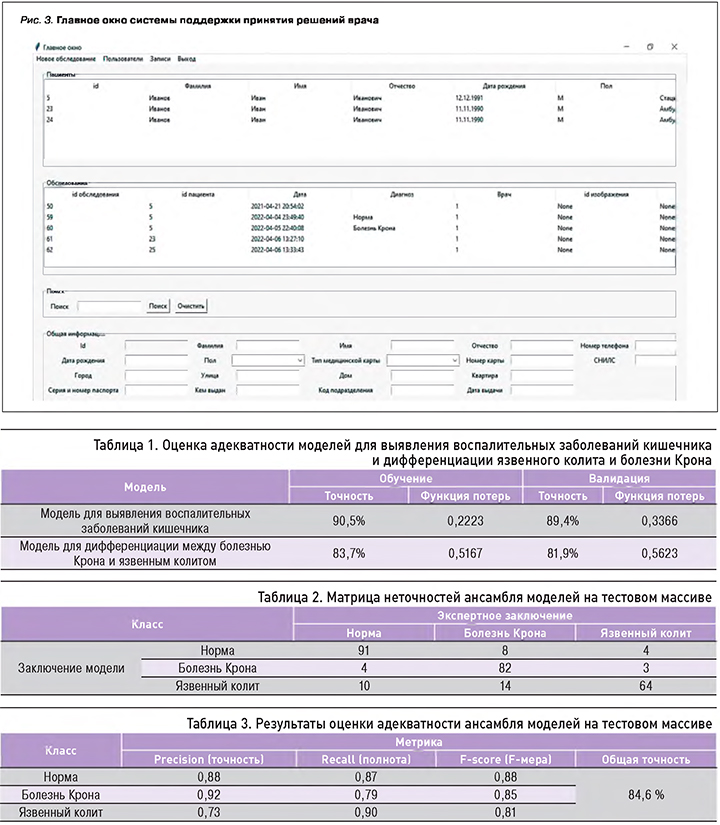
На основании полученных результатов с помощью языка программирования Python была разработана система поддержки принятия решений врача (СППРВ) из 4 основных блоков: регистрации пациентов, поддержки пользователей, базы пациентов и обследования, последний из которых включал ИНС. В СППРВ можно вносить данные пациентов (ФИО, номер и тип карты пациента, клинико-лабораторные данные), а также загружать эндоскопические изображения и получать заключение системы о наличии и виде ВЗК (рис. 3).
ПРИМЕРЫ ИСПОЛЬЗОВАНИЯ ИСКУССТВЕННОГО ИНТЕЛЛЕКТА ДЛЯ ДИАГНОСТИКИ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ КИШЕЧНИКА В КЛИНИЧЕСКОЙ ПРАКТИКЕ
Пример 1. Пациент Г., 35 лет, поступил в отделение гастроэнтерологии клиники Петра Великого СЗГМУ им. И.И. Мечникова с жалобами на учащение стула до 2 раз в сутки с видимой кровью. Внекишечные симптомы отсутствовали.
На амбулаторном этапе были исключены кишечные инфекции, при выполнении ректороманоскопии выявлена гиперемия слизистой прямой кишки с контактной кровоточивостью. На госпитальном этапе после выполнения ВКС пациент был зарегистрирован в разработанной программе, куда были загружены эндоскопические изображения. ИНС дала заключение о наличии у пациента БК, что подтвердилось данными ВКС и результатами морфологического исследования.
Пример 2. Пациентка А., 32 лет, поступила в отделение гастроэнтерологии Петра Великого СЗГМУ им. И.И. Мечникова с обострением ранее установленного ЯК; при этом наблюдались неэффективность терапии препаратами 5-аминосалициловой кислоты и неоднократная потеря ответа на биологическую терапию.
Из анамнеза известно, что каждую предшествующую госпитализацию пациентке проводилась дифференциальная диагностика ЯК с БК, были исключены вирусные и бактериальные инфекции. В ходе обследования в клинике по данным ультразвукового исследования были выявлены воспалительные изменения терминального отдела подвздошной и сигмовидной кишки. Пациентке была выполнена ВКС с мультифокальной биопсией, после чего данные пациентки были внесены в разработанную программу. После анализа эндоскопического изображения в ИНС было получено заключение о наличии ЯК, что также подтвердилось после получения результатов дополнительных исследований – наличия левостороннего поражения по данным ВКС и отсутствия признаков воспаления тонкой кишки по результатам магнитно-резонансной энтерографии.
ОБСУЖДЕНИЕ
Диагностика ВЗК является сложной задачей для клинициста: при подозрении на такую патологию требуется исключение большого количества различных заболеваний и проведение широкого спектра лабораторно-инструментальных исследований [18]. Ввиду сложности диагностики ВЗК верифицируются спустя несколько месяцев и даже лет с момента манифестации симптомов, что ухудшает прогноз болезни [3–6, 10].
Наше исследование показало, что ИНС способна выявлять наличие патологии с точностью 89,4% и дифференцировать ВЗК с точностью 81,9%. По сравнению с другими классами модель лучше всего обнаруживает класс «ЯК» (точность 90%), а также наиболее хорошо отличает класс «БК» от других классов (точность 92%). Общая точность системы составила 84,6%. Разработанная модель показала умеренную точность диагностики ВЗК и с высокой точностью могла выявлять как ЯК, так и БК. Созданная на ее основе СППРВ даст возможность определять ВЗК с момента загрузки изображения в систему, что, в свою очередь, позволит эндоскописту или врачу первичного звена сразу отправить пациента в профильный центр.
В последние годы ряд исследователей предпринимал попытки использовать ИИ для оптимизации диагностического процесса. Так, Ruan G. et al. разработали ИНС для диагностики ЯК и БК, обучив ее на 34 300 изображениях. Модель продемонстрировала большую точность выявления ВЗК при расчете на пациента и сравнении с эндоскопистом-стажером (99,1 против 78%, р <0,001), опытным эндоскопистом (99,1 против 92,2%, р <0,001) и на повреждение (90,4 против 78% и 92,2%, р <0,001 соответственно) [19]. Эта модель была протестирована на большем количестве изображений по сравнению с разработанными ИНС, в связи с чем показала лучшие результаты.
Tong Y. et al. создали модель на основе метода случайного леса (random forest) и ИНС, позволяющую выявлять ЯК, БК и абдоминальный туберкулез (АТ) при анализе текста эндоскопических заключений [20]. Метод «случайного леса» мог дифференцировать ЯК/БК с чувствительностью 0,89 и специфичностью 0,84, ЯК/АТ – 0,83 и 0,82, БК/АТ – 0,72 и 0,77 соответственно. ИНС применялась для диагностики только БК и кишечной формы туберкулеза и обладала более высокой чувствительностью и специфичностью – 0,90 и 0,77 соответственно [20]. Несмотря на возможность диагностики большего числа патологий, по сравнению с разработанной нами ИНС, группы для обучения исследовании Tong Y. et al. были неоднородными: 5128 заключений ЯК, 875 – БК и 396 – АТ. Кроме того, эти модели были разработаны для носителей китайского языка, а это может снижать точность диагностики при их использовании на другом языке [20].
ИНС также могут применяться для выявления поражений верхних отделов желудочно-кишечного тракта посредством анализа изображений с видеокапсульного исследования. Aoki T. et al. обучили ИНС находить эрозии и язвенные дефекты более чем на 5000 изображениях от 115 пациентов [21]. Чувствительность метода составила 88,2% (95% доверительный интервал (ДИ): 84,8–91,0), специфичность – 90,9% (95% ДИ: 90,3–91,4), точность – 90,8% (95% ДИ: 90,2–91,3). ИНС также была способна анализировать изображения очень быстро, со скоростью 44,8 кадра в секунду. Однако, по сравнению с разработанной нами ИНС, эта нейронная сеть исследователей не была обучена дифференцировать патологии, которые привели к данной эндоскопической картине [21].
При использовании разработанных ИНС в нашем исследовании мы отметили некоторые ограничения. Во-первых, ИНС обучались на изображениях пациентов с ЯК и БК толстой кишки, в связи с чем при наличии другой патологии этого органа (кишечные инфекции, клостридиальный колит, лекарственное поражение и др.) использование рассмотренного метода может быть некорректным, что требует оценки эффективности его применения в дополнительных исследованиях, а также обучению ИНС различать другие заболевания. Во-вторых, изображения для обучения и тестирования были выбраны ретроспективно, и это могло привести к систематической ошибке отбора, хотя при проверке нами модели на проспективных изображениях это ограничение было незаметно. В-третьих, для валидации модели были использованы только изображения, полученные с помощью эндоскопического оборудования, которое имеет опции осмотра в узком спектре света и с функцией оптического увеличения: это таит риск некоторых погрешностей при применении в клинической практике эндоскопического оборудования другого уровня (при отсутствии указанных опций). Представленные ограничения могут быть устранены или минимизированы в ходе дальнейшего совершенствования подходов по применению ИНС у пациентов с ВЗК.
ЗАКЛЮЧЕНИЕ
В нашем исследовании разработанные ИНС показали свою эффективность при выявлении и дифференциальной диагностике ВЗК. Созданная на их основе СППРВ может быть использована в клинической практике как дополнительный дифференциально-диагностический ресурс для специалистов различного профиля (эндоскопистов, гастроэнтерологов, терапевтов, врачей общей практики и др.), а также диагностический инструмент для дистанционных или телемедицинских консультаций, в том числе и в удаленных регионах России. Важной представляется дальнейшая интеграция эндоскопических, клинико-лабораторных и морфологических показателей для создания комплексного программного продукта.
Благодарности. Исследование было поддержано именным грантом им. профессора Э.Э. Эйхвальда. Авторы благодарят Д.Г. Береста, зав. эндоскопическим отделением клиники Петра Великого, и К.В. Голубеву, врача-эндоскописта, за предоставленную базу эндоскопических изображений.



