Пандемия COVID-19, затронувшая все страны мира, сопровождается высочайшей нагрузкой на государство и систему здравоохранения и требует от них огромных усилий для снижения уровня распространенности не только COVID-19, но и новых инфекций. Ее начало датируется январем 2020 г., когда ВОЗ представила новую коронавирусную инфекцию как чрезвычайную ситуацию в области общественного здравоохранения, а вскоре после этого объявила ее пандемию [1–3]. Следует подчеркнуть, что при новой коронавирусной инфекции патологические изменения не только затрагивают респираторную систему, но и могут инициировать возникновение заболеваний в других органах, в том числе в пищеварительном тракте. В связи с этим заслуживают внимание данные о выявлении РНК SARS-CoV-2 в образцах стула инфицированных пациентов и наличии вирусного рецептора ангиотензинпревращающего фермента 2 (ACE2) с высокой экспрессией в эпителиальных клетках желудочно-кишечного тракта (ЖКТ). Таким образом, SARS-CoV-2 может активно инфицировать и размножаться в ЖКТ, вызывая патологические процессы во всех органах пищеварения.
В ряде случаев поражение органов пищеварения остается не распознанным из-за субклинического протекания или абсолютного доминирования более тяжелой патологии легких. Поэтому истинная частота коморбидных заболеваний при коронавирусной инфекции продолжает быть предметом активного обсуждения. Коморбидная патология может носить самостоятельный характер, как, например, при циррозе печени, язвенном колите, сахарном диабете или гипертонической болезни, или иметь вторичный характер, индуцированный самим SARS-CoV-2. Подобная коморбидность способна в значительной мере повлиять на исход COVID-19. Например, наличие сахарного диабета увеличивает риск летального исхода больного с COVID-19 в 9 раз (отношение шансов (ОШ) 6,9; 95% доверительный интервал (ДИ) 1,8–26,2; р= 0,002), гипертонической болезни – в 26 раз (ОШ 26,8; 95% ДИ 5,6–128,4) [4], а декомпенсированного цирроза печени – в 4 раза (ОШ 3,96; 95% ДИ 1,4–7,84) [5].
Особую актуальность представляет исследование эпидемиологии, особенностей патогенеза и диагностики патологии пищеварительного тракта, ассоциированной с коронавирусной инфекции. Это связано с тем, что ЖКТ служит входными воротами для COVID-19, и в ряде случаев симптомы поражения органов пищеварения могут встречаться без респираторных проявлений заболевания, определяя тяжесть его течения и прогноза. В то же время механизмы поражения пищеварительного тракта при коронавирусной инфекции изучены недостаточно, а их верификация не всегда совершенна. При этом своевременная диагностика коморбидной патологии пищеварительного тракта у больных COVID-19 может улучшить прогноз течения инфекции и оптимизировать проводимое лечение.
Целью настоящего обзора стала систематизация сведений об эпидемиологии, этиопатогенезе, клинике, диагностике и тактике ведения больных с поражениями пищеварительного тракта при инфекции COVID-19.
ЭПИДЕМИОЛОГИЯ КЛИНИЧЕСКИХ ПРОЯВЛЕНИЙ ПАТОЛОГИИ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА ПРИ COVID-19
В ранних отчетах из Китая, основанных на данных ретроспективного анализа, распространенность желудочно-кишечных симптомов при инфекции COVID-19 колебалась от 11,4 до 50% [6, 7]. В метаанализе с участием более 4000 пациентов частота встречаемости таких симптомов у пациентов с COVID-19 составляла 17,6% (95% ДИ 12,3–24,5). РНК вируса обнаруживалась в образцах стула у 48,1% пациентов, с достаточно высокой частотой даже после того, как респираторные образцы демонстрировали отрицательные результаты теста [8].
Распространенность симптомов поражения ЖКТ во многом зависит от степени тяжести коронавирусной инфекции и длительности респираторных симптомов COVID-19. К примеру, частота встречаемости диареи как одного из наиболее распространенных нереспираторных симптомов коронавирусной инфекции варьируется в значительном диапазоне: от 2 до 50% в зависимости от проявлений основного заболевания [9]. В другом метаанализе исследовались данные о 29% пациентах пожилого возраста с тяжело протекающей инфекцией COVID-19, которые предъявляли жалобы на боль в животе, тошноту, рвоту и диарею. При этом у 4% из них были жалобы только на расстройство деятельности ЖКТ [10].
На основании вышеизложенного делается вывод, что реальная распространенность поражения пищеварительного тракта у пациентов с COVID-19 может быть выше. Например, частота встречаемости тошноты и рвоты, как и других признаков поражения ЖКТ, в зависимости от тяжести коронавирусной инфекции может различаться в 2 и более раза [11, 12] с нередким доминированием анорексии [7, 13]. В многочисленных исследованиях продемонстрировано, что распространенность анорексии у пациентов, страдающих COVID-19, колеблется от 23,2 до 89% и ассоциируется с тошнотой, потерей или нарушением обоняния (аносмией) и вкуса (агевзией) [13], которые регистрируются у 24,82–89% больных COVID-19 [14, 15]. В другом крупном метаанализе приводятся данные о наличии абдоминального дискомфорта или боли в животе у 6,9%, а тошноты или рвоты у 7,7% пациентов [16].
По данным систематического обзора и метаанализа, выполненного Rokkas T., средняя распространенность острой диареи при COVID-19 равняется 10,4% [16]. В другом исследовании приводятся данные об еще большей распространенности острой диареи, достигающей 19,4% у больных COVID-19. Ее длительность составляла от 1 до 14 дней (в среднем 5,4±3,1 дня и 4,2±2,2 дефекаций в день) [17]. Лихорадка присутствовала у 62,4% пациентов с кишечными симптомами, а пациенты с диарей поступали на стационарное лечение значительно позже, чем лица с изолированным респираторным синдромом (16,0±7,7 против 11,6±5,1 дней; p <0,001). При этом у больных с поражением ЖКТ время между появлением кишечных симптомов и элиминацией вируса было большим, чем у лиц с COVID-19 без патологии ЖКТ; кроме этого, у первой категории с большей частотой регистрировался положительный результат анализа кала на вирус (RT-PCR+; 73,3 против 14,3%; p=0,033) [17].
В одном из метаанализов была продемонстрирована связь диспептического синдрома с печеночной гиперферментемией. Так, диарея регистрировалась у 7,4% (95% ДИ 4,3–12,2%) пациентов с COVID-19. У 4,6% (95% ДИ 2,6–8,0%) определялась тошнота или рвота. Высокие титры аспартатаминотрансферазы (АСТ) и аланинаминотрансферазы (АЛТ) выявлялись у 14,6% (95% ДИ 12,8–16,6%) и 20% (95% ДИ 15,3–25,6%) больных соответственно. При этом положительный фекальный тест на SARS-CoV-2 имел место у 40,5% (95% ДИ 27,4–55,1%) пациентов [18].
Способность вируса COVID-19 напрямую поражать печень носит дискуссионный характер. Тем не менее существующие данные говорят о том, что у больных COVID-19 повреждение печени может быть результатом как прямого патогенного воздействия вируса, так и системного воспаления с осложненным течением заболевания; еще один возможный путь ее повреждения – токсичное воздействие медикаментов, используемых для лечения коронавирусной инфекции [19]. В литературе приводятся данные о том, что среди пациентов с COVID-19 в 76,3% случаев регистрируется гипербилирубинемия, повышение уровня печеночных ферментов (АСТ, АЛТ) и гамма-глутамилтрансферазы (ГГТ) [20]. Так, через 2 нед после госпитализации по поводу COVID-19 увеличение этих показателей более 3 норм наблюдалось со следующей частотой: АЛТ – у 23,4% больных, АСТ – у 14,8%, общего билирубина – у 11,5%, ГГТ – у 24,4%. Поражение печени у этого контингента больных ассоциировалось с применением антибиотиков, нестероидных противовоспалительных препаратов (НПВП), средств традиционной китайской медицины и интерферона. В свою очередь, это инициировало повышение риска прогрессирования коронавирусной инфекции и развитие полиорганной недостаточности [20].
В другом исследовании приводятся сведения о том, что повышенные уровни АСТ и АЛТ отмечались у 14–53% пациентов с COVID-19. При тяжелом течении инфекции повышение печеночных ферментов определялось в 37–38% случаев, тогда как при легком – в 21–24% [21]. Также было показано, что при пневмонии, ассоциированной с COVID- 19, синдром цитолиза печеночных клеток диагностируется гораздо чаще, чем при внебольничной пневмонии: 52,17 против 28,1% пациентов соответственно [21]. Тем не менее развитие желтухи и печеночной недостаточности на фоне COVID-19 происходит достаточно редко [22]. Схожие данные приводят и другие авторы. Так, изменение биохимических тестов, характеризующих функциональное состояние печени, отмечается у 19–76% пациентов с COVID-19 [23]. При этом повышение уровня щелочной фосфатазы как проявление синдрома холестаза, выявляется только у 9,6–20,8% пациентов с COVID-19, а повышение уровня общего билирубина – у 8,8–10,6% обследованных [24, 25].
Более позднее исследование, проведенное в Гонконге, показало наличие активной вирусной инфекции ЖКТ у 7 из 15 (47%) пациентов с COVID-19 даже в отсутствие каких-либо клинических симптомов, что указывает на персистенцию инфекции SARS-CoV-2. Заслуживают внимание данные о том, что коронавирусная инфекция ЖКТ сопровождается увеличением концентрации в кале ряда бактерий, продуцирующих короткоцепочечные жирные кислоты: Collinsella aerofaciens, Collinsella tanakaei, Streptococcus infantis, Morganella morganii [26]. У части пациентов вирусная активность и репликация SARS-CoV-2 в кишечнике сохранялись даже после элиминации вируса из дыхательных путей. Приведенные данные дают возможность предположить наличие фекально-орального распространения COVID-19, хотя в настоящее время такой путь передачи вируса в полной мере не находит подтверждения [15].
При выполнении эндоскопического исследования верхних отделов ЖКТ были зарегистрированы герпетические эрозии слизистой оболочки ЖКТ и язвы с положительными результатами биопсии на вирус SARS-CoV-2 [27]. При выполнении фиброэзофагогастроскопии обнаружено, что у 75% пациентов с SARS-CoV-2 имелась различная патология, включая эзофагит (20,8%), язву двенадцатиперстной кишки (20,8%), эрозивный гастрит (16,6%), новообразования (8,3%) и синдром Маллори–Вейсса (4,1%). При этом данные о показаниях к проведению эндоскопических вмешательств не приводятся, а само исследование проводилось на небольшой группе пациентов [27].
Интересны также результаты колоноскопии, свидетельствующие о том, что у пациентов с COVID-19 обнаруживается высокая частота поражений кишечника, включая сегментарный колит, ассоциированный с дивертикулезом (25%), геморрагический язвенный колит (5%) и ишемический колит (20%). Еще у 5% больных верифицировались опухоли, у 15% – микроскопический колит [27].
В ряде случае при инфекции COVID-19 диагностируется острый панкреатит (у 0,27% госпитализированных пациентов). При этом у 69% лиц этиология острого панкреатита не была верифицирована [28]. В литературе приводятся данные о повышении концентрации ферментов поджелудочной железы у 17% пациентов с COVID-19 [29]. Однако высокие цифры уровня ферментов поджелудочной железы следует интерпретировать с осторожностью, поскольку данный признак не является строго специфичным для панкреатита, особенно при отсутствии сильной боли в животе [30]. Представляется наиболее вероятным, что острый панкреатит, связанный с COVID-19, чаще ассоциируется с тяжелым системным воспалительным процессом и развитием полиорганной недостаточности, а не напрямую с вирусом [31]. В то же время развитие острого бескаменного холецистита на фоне COVID-19 относится к разряду казуистики, и в представленной литературе приводятся сведения только о двух таких пациентах [32].
Одной из наиболее частых причин тяжелых осложнений со стороны ЖКТ при COVID-19 являются кровотечения, которые встречаются у 4–13,7% у госпитализированных больных, находящихся в критическом состоянии [33, 34]. При этом сам источник кровотечения диагностируется редко, так как эндоскопическое исследование у таких чрезвычайно тяжелых больных проводится нечасто, и для их лечения априорно используются ингибиторы протонной помпы [35].
Следует отметить, что при коронавирусной инфекции в 100% случаев развивается синдром избыточного бактериального роста в тонком кишечнике, способный негативно влиять на функцию различных органов и систем и ухудшать прогноз основного заболевания [36].
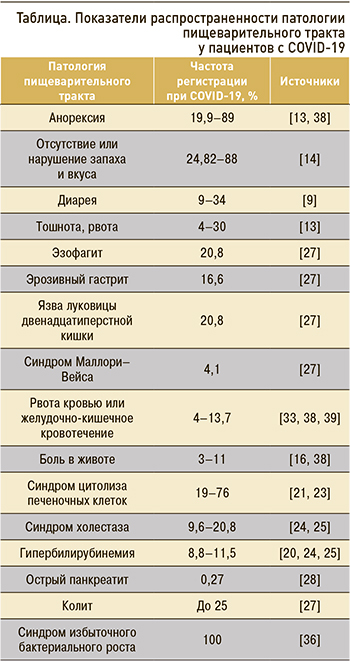 Недостаточная диагностика поражений пищеварительного тракта при COVID-19 порой объясняется более тяжелыми симптомами поражения легких. Наличие гастроинтестинальных симптомов может предвещать худший исход для пациентов, инфицированных SARS-CoV-2. Продемонстрировано, что больные без признаков поражения ЖКТ с большей вероятностью имеют лучший прогноз по сравнению с теми, у кого такие поражения есть [37]. Средние показатели распространенности отдельных симптомов поражения пищеварительного тракта у пациентов с COVID-19 представлены в таблице.
Недостаточная диагностика поражений пищеварительного тракта при COVID-19 порой объясняется более тяжелыми симптомами поражения легких. Наличие гастроинтестинальных симптомов может предвещать худший исход для пациентов, инфицированных SARS-CoV-2. Продемонстрировано, что больные без признаков поражения ЖКТ с большей вероятностью имеют лучший прогноз по сравнению с теми, у кого такие поражения есть [37]. Средние показатели распространенности отдельных симптомов поражения пищеварительного тракта у пациентов с COVID-19 представлены в таблице.
ПАТОГЕНЕТИЧЕСКИЕ АСПЕКТЫ ПОРАЖЕНИЯ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА У ПАЦИЕНТОВ С COVID-19
Предполагается, что основной причиной поражения кишечника при коронавирусной инфекции выступает ишемия [40]. Повышенные уровни D-димера и фибриногена найдены у многих пациентов с COVID-19. Данные изменения могут сопровождаться гиперкоагуляцией в сосудах пищеварительного тракта и приводить к его ишемическому повреждению [41]. При этом ишемические изменения объясняются вторичной тромбофилией, вызванной воспалением и состоянием гипоперфузии.
Поражение органов пищеварительного тракта также может быть обусловлено прямым повреждающим действием COVID-19 [42, 43]; оно опосредуется через связанный с клеточной мембраной ангиотензинпревращающий фермент 2 (ACE2) и ассоциированные с ним протеазы, такие как трансмембранная сериновая протеаза 2 (TMPRSS2) и катепсин L (CTSL), ранее идентифицированные как медиаторы проникновения SARS-CoV-2 в клетки [44, 45]. Указанные медиаторы в большей мере экспрессируются в кишечнике и в меньшей степени в верхних отделах ЖКТ и других органах пищеварения, определяя разную частоту поражения различных отделов пищеварительного тракта при коронавирусной инфекции [32, 44, 46].
Непосредственное поражение печени вирусом COVID-19 не доказано. Вместе с тем пациенты с циррозом печени подвержены высокому риску декомпенсации и повышенной летальности из-за системной реакции, наблюдаемой при COVID- 19 [47]. Кроме того, цирроз печени может иметь серьезные последствия для больных COVID-19, поскольку его наличие затрудняет проведение стандартной медикаментозной терапии и способствует активации механизмов, повреждающих структуру гепатоцитов [15]. Исследования аутопсии и прижизненной биопсии показали, что, хотя РНК SARS-CoV-2 и присутствует в печени пациентов с COVID-19 [48], однако гистологические данные в первую очередь соответствуют ишемическому гепатиту [49] или ранее существовавшему заболеванию печени [22]. Некоторые авторы описали апоптоз гепатоцитов с набуханием митохондрий, дилатацией эндоплазматического ретикулума и уменьшением гранул гликогена вместе с широко распространенным некрозом гепатоцитов у больных с фатальным COVID-19 [50]. Выявленные гистологические изменения печени лучше всего объясняются эффектами «цитокинового шторма» [51]. С этой интерпретацией непрямого поражения печени согласуются наблюдения, согласно которым экспрессия рецептора ACE 2 в печени происходит, главным образом, во внутрипеченочных желчных протоках. При этом гистологические признаки повреждения желчных путей при COVID-19 достаточно редки [52, 53]. В другом исследовании также доказывается факт размножения COVID-19 желчных протоках и желчном пузыре, способность вируса вызывать воспалительный процесс в этих структурах, что объясняется способностью их клеток к высокой экспрессии ACE 2 [32].
Высказывается обоснованное мнение, что COVID-19 способен к прямому повреждению поджелудочной железы. Это связано с тем, что в ней обнаруживается экспрессия рецепторов ACE 2. Наиболее значительная экспрессия АСЕ 2 определяется в клетках островков поджелудочной железы. Приводятся данные о возможности размножения вируса в клетках поджелудочной железы и его ассоциации с развитием сахарного диабета [46].
Двунаправленное взаимодействие между кишечником и легкими (ось кишечник–легкое) лучше всего иллюстрируется кишечными расстройствами, наблюдаемыми при заболеваниях легких, в том числе при коронавирусной инфекции. Эндотоксины и микробные метаболиты могут воздействовать на легкие через кровоток и при развитии воспаления в легочной ткани влиять на микробиоту кишечника [54]. По некоторым данным, респираторные вирусные инфекции в значительной мере изменяют кишечный биоценоз, что ассоциируется с ухудшением аппетита [55]. В сравнении с контрольной группой у больных COVID-19 обнаруживается снижение микробного разнообразия кишечника, размножение условно-патогенных микроорганизмов (Clostridium hatheway, Actinomyces viscosus, Bacteroides nordii, Streptococcus, Rothia, Veillonella) и снижение количества полезных симбионтов (лактобациллы и бифидобактерии Faecalibacterium prausnitzii, Lachnospiraceae bacterium 5_1_63FAA, Eubacterium rectale, Ruminococcus obeuml, Dorea formicigenerans) [56]. При этом COVID-19 выступает более сильным негативным фактором, воздействующим на микробиом кишечника, чем антибиотикотерапия или сахарный диабет. Отдельного внимания заслуживает информация о том, что размножение бактерий типа Firmicutes, рода Coprobacillus, видов Clostridium ramosum и C. Hathewayi является предиктором более тяжелого течения коронавирусной инфекции [36]. Значительные нарушения в микробиоме служат одним из наиболее важных патогенетических звеньев развития воспалительного процесса как в кишечнике, так и других органах пищеварительного тракта, например печени. Например, из кишечника различные метаболиты хозяина и бактерий через воротную вену переносятся в печень, оказывая отрицательное воздействие на ее функцию [57].
ДИАГНОСТИЧЕСКИЕ ОСОБЕННОСТИ ПОРАЖЕНИЯ ПИЩЕВАРИТЕЛЬНОГО ТРАКТА ПРИ COVID-19
У пациентов с COVID-19 частота выявления вируса SARS-CoV-2 в мазках из анального канала и образцах стула зависит от наличия или отсутствия симптомов поражения ЖКТ. Скажем, при наличии диареи частота обнаружения РНК SARS-CoV-2 с помощью Rrt-PCR (Real-time PCR, ПЦР в реальном времени) в образцах кала достигает 60–80%, тогда как у пациентов без диареи – 14,3%. Таким образом, использование Rrt-PCR для обнаружения SARS-CoV-2 может использоваться в целях подтверждения инфекции у пациентов с диареей [17]. У больных COVID-19, протекающим с диареей, также обнаруживалось повышенное содержание фекального кальпротектина, что является показателем воспалительной реакции в кишечнике [36].
У пациентов с COVID-19 в обязательном порядке должно проводиться биохимическое исследование функции печени, поскольку этот орган достаточно часто вовлекается в патологический процесс, а его повреждение может в значительной степени повлиять на исход заболевания.
Принимая во внимание тяжесть состояния пациентов с COVID-19 и технические трудности выполнения инструментальных методов в условиях ограничительных мер, проведение таких исследований, как колоноскопия, фиброгастродуоденоскопия, должно быть ограничено строгими показаниями, например подозрением на кровотечение или при наличии болей в брюшной полости неясного генеза.
Специальную диагностику синдрома избыточного бактериального роста, который в 100% сопутствует COVID-19, в условиях ограничительных мер проводить не следует. При этом назначение пробиотиков в схеме лечения пациентов с COVID-19 представляется обоснованным [58].
РОЛЬ ПРОТИВОВИРУСНОЙ МЕДИКАМЕНТОЗНОЙ ТЕРАПИИ В ПОРАЖЕНИИ ПИЩЕВАРИТЕЛЬНОГО ТРАКТА У ПАЦИЕНТОВ С COVID-19
Наивысший риск неблагоприятных исходов (необходимость в интенсивной терапии, искусственной вентиляции легких, смерть) у больных СOVID-19 ассоциируется с применением глюкортикостероидов (ГКС). Так, у 19% пациентов c воспалительными заболеваниями кишечника (ВЗК), принимающих ГКС, развились различные осложнения. В противоположность сказанному, у пациентов с ВЗК, получающих монотерапию анти-TNF, анти-интерлейкином-12/23 и другими биопрепаратами, неблагоприятное течение заболевания развивалось только у 2–3%, что достоверно не превышало среднестатистические показатели летальности [59]. С другой стороны, как было продемонстрировано в крупном исследовании, применение ГКС при тяжелой форме COVID-19 позволяет значительно снизить летальность, предупреждая и устраняя проявления «цитокинового шторма» (ОШ 0,72; 95% ДИ 0,57–0,87) [60]. Таким образом, представляется оптимальным проводить раннее выявление и лечение активных форм ВЗК на фоне имеющейся инфекции COVID-19, по возможности ограничивая применение стероидов, используя монотерапию биологическими агентами, соблюдая принятые клинические рекомендации [61].
Использование лопинавира/ритонавира для лечения COVID-19 приводило к увеличению вероятности повреждения печени (ОШ 4,44–5,03; p <0,01) [62]. Некроз гепатоцитов у пациентов с COVID-19 также ассоциируется с применением антибиотиков, НПВП, средств китайской медицины и интерферона [18]. Также следует указать на полученные в эксперименте данные о развитии острого панкреатита на фоне применения гидроксихлорохина, рекомендованного для лечения COVID-19 [63].
Некоторые перепрофилированные препараты против SARS-CoV-2, такие как противовирусные (особенно комбинированные лопинавир + ритонавир), противомалярийные и противомикробные средства, могут вызывать диарею, тошноту, рвоту. В этом случае, когда отмена препарата не всегда возможна, для предотвращения обезвоживания и электролитных нарушений необходимо назначать противодиарейные препараты. При этом, чтобы избежать задержки элиминации вируса из организма [18, 64], следует отдавать предпочтение антисекреторным соединениям (например, рацекадотрилу) перед лоперамидом.
Использование ингибиторов протонной помпы у пациентов с COVID-19 ассоциируется с синдромом избыточного бактериального роста, вторичными инфекциями и худшим прогнозом течения заболевания, поэтому их использование должно носить строго обоснованный характер [65].
ЗАКЛЮЧЕНИЕ
Из приведенных данных становится понятным, что COVID-19 способен поражать любой орган пищеварительного тракта, вызывая воспалительный процесс и некроз в органах пищеварения и эрозирование слизистых оболочек различных отделов ЖКТ. Эпидемиологические исследования свидетельствуют о высокой частоте поражений органов пищеварения при COVID-19, порой достигающей 50% от числа заболевших [6, 7]. Это связано с тем, что ЖКТ служит входными воротами для SARS-CoV-2, а также объясняется тропностью вируса к компонентам клеточных мембран различных клеток пищеварительного тракта [44, 45]. Показано, что органы пищеварения могут поражаться как непосредственно SARS-CoV-2, так и в результате проводимого лечения вирусной инфекции.
Наличие коморбидной патологии ЖКТ в значительной мере ухудшает жизненный прогноз у пациентов с коронавирусной инфекцией. Поэтому своевременная диагностика такой патологии органов пищеварения и выбор адекватной тактики лечения может служить важным фактором выздоровления и предупреждения фатальных осложнений у пациентов с инфекцией COVID-19.



