Инфекции мочевых путей (ИМП) являются разнородной группой заболеваний, которые встречается довольно часто и, согласно некоторым данным, по распространенности уступают только острым респираторным инфекциям. ИМП вызываются разными возбудителями и существенно различаются по клинической картине. Тяжесть этих заболеваний может варьировать от спонтанно разрешающегося цистита (или даже бессимптомной бактериурии – ББ) до угрожающего жизни септического синдрома. Учитывая, что моча здорового человека, находящаяся в мочевом тракте (за исключением нижней трети уретры у женщин), стерильна, ИМП обычно определяют как состояния, при которых микроорганизмы, вне зависимости от их количества, размножаются внутри мочевых путей. ИМП могут развиваться у самых разных людей: женщин и мужчин, детей и взрослых, больных различными заболеваниями и здоровых. Тем не менее заболеваемость, распространенность и особенности течения ИМП в разных популяциях могут существенно различаться. Например, хорошо известно, что заболеваемость ИМП у женщин в разы (или даже десятки раз) выше, чем у мужчин [1–3].
Отдельную группу высокого риска в отношении ИМП составляют пациенты с сахарным диабетом (СД). Пациенты с СД 2 типа имеют повышенный риск развития различных инфекций. При этом ИМП у них встречаются наиболее часто. Различные нарушения иммунной системы в сочетании с плохим метаболическим контролем диабета и неполным опорожнением мочевого пузыря вследствие вегетативной нейропатии могут вносить вклад в патогенез ИМП при СД. К факторам, повышающим риск развития ИМП у больных с СД, относят возраст, состояние метаболического контроля и наличие хронических осложнений, в первую очередь диабетической нефропатии и цистопатии [4, 5].
КЛАССИФИКАЦИЯ ИНФЕКЦИЙ МОЧЕВЫХ ПУТЕЙ
Общепринятой классификации ИМП до последнего времени не существовало, что чрезвычайно затрудняло работу врачей. Попытку восполнить этот пробел предприняли эксперты Европейской ассоциации урологов (ЕАУ). Начиная с 2011 г., в последовательных пересмотрах своих рекомендаций они привели ряд классификационных схем, которые различаются лишь отдельными деталями (табл. 1).
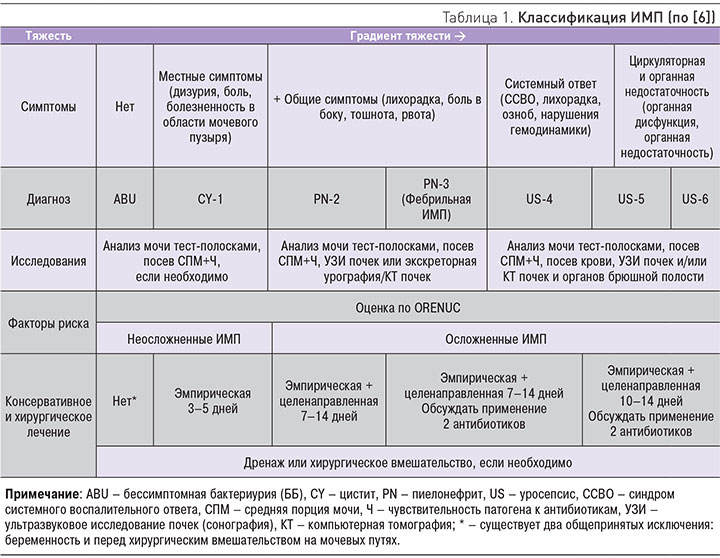
По традиции ИМП классифицируются на основании клинических проявлений, лабораторных данных и результатов микробиологических исследований. С точки зрения практики выделяют неосложненные, осложненные ИМП и уросепсис. При этом анализ имеющихся симптомов и клинических проявлений направлен на установление анатомического уровня повреждения и степени тяжести ИМП. Оценка факторов риска (ФР) призвана определить необходимость в дополнительных лечебных мероприятиях, например дренировании мочевыводящих путей (МВП). Кроме того, составители Рекомендаций ЕАУ сочли необходимым подчеркнуть, что ББ следует рассматривать, как особое состояние потому, что источник микроорганизмов может располагаться как в нижних, так и верхних МВП. При этом ББ не требует лечения, пока пациенту не потребуется оперативное вмешательство или если это не ББ у беременных (табл. 1). Степень тяжести оценивается по шкале от 1 до 6, которая соотносится с риском летального исхода (табл. 1).
В конечном итоге (табл. 2) эксперты ЕАУ предложили выделять следующие варианты ИМП: уретрит, цистит, пиелонефрит, уросепсис и «инфекции мужских половых желез» – простатит, эпидедимит, орхит. На наш взгляд, последние правильнее обозначать как «генитальные инфекции у мужчин». Заметим, что ранее генитальные инфекции у мужчин в разряд ИМП не включались. Очень важным моментом в классификационной схеме ЕАУ является выделение ФР, которые предлагается стратифицировать по специальной системе ORENUC (табл. 2, 3).
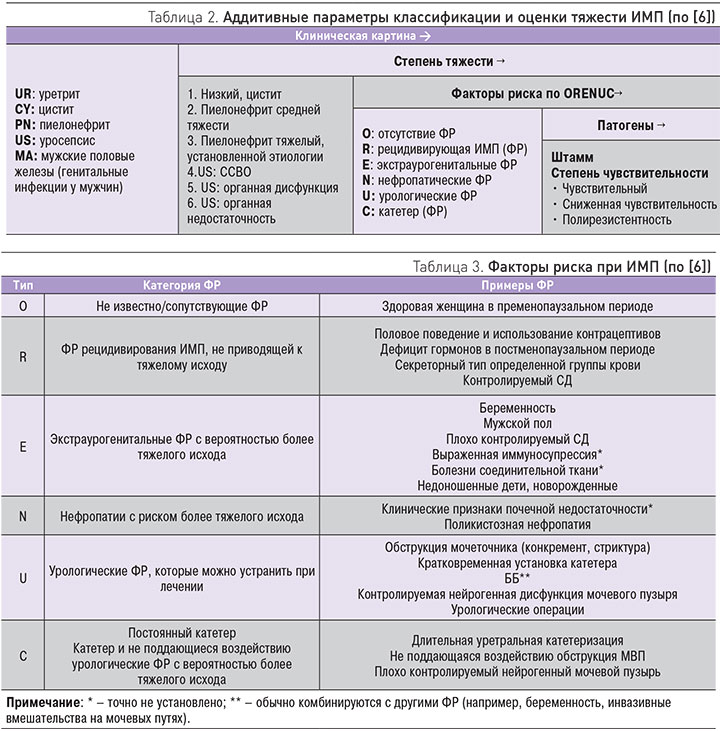
Следует отметить, что сами авторы Рекомендаций ЕАУ не дали подробного описания концепции ФР при ИМП, ограничившись приведением ряда примеров (табл. 3). Вследствие этого остается не вполне ясным, что имеется в виду под градацией «O» по системе ORENUC и, в частности, что означает «сопутствующие факторы риска» (в оригинале – no known/associated RF), особенно если в качестве примера приводится «здоровая женщина в пременопаузальном периоде» (табл. 3). Скорее всего, на наш взгляд, саму принадлежность к женскому полу следует считать ФР заболеваемости ИМП. В Рекомендациях ЕАУ не разъясняются также понятия «тяжелого исхода» или «более тяжелого исхода» (в оригинале – severe outcome и more severe outcome). Остается только гадать, является ли, например, развитие терминальной почечной недостаточности (ТПН) у пациента с ИМП «тяжелым» или «более тяжелым» исходом.
Безусловно, введение понятия ФР в классификацию ИМП следует рассматривать как значительный шаг вперед. В то же время сама концепция ФР в отношении данных о заболевании, их определение и стратификация, на наш взгляд, нуждаются в существенной доработке.
Большим достижением авторов классификации ИМП ЕАУ является точное (в их понимании) описание осложненных ИМП. До последнего времени по этому поводу в медицинской литературе существовал полный разнобой. Так или иначе, согласно точке зрения экспертов ЕАУ, ИМП следует считать осложненной (ОИМП) при наличии двух условий:
- наличие у пациента осложняющих факторов, которые могут быть устранены. Например, удаление конкремента или катетера, что соответствует категории U по шкале ORENUC (табл. 3);
- наличие у пациента осложняющих факторов, которые устранить нельзя. Например, необходимость постоянного использования катетера или неудалимого конкремента. Такая ситуация соответствует градации С по системе ORENUC (табл. 3).
Однако вопрос об ОИМП в Рекомендациях ЕАУ также окончательно не решен. Он требует дальнейшего отдельного и подробного обсуждения [6].
Особенности клинических вариантов ИМП при СД
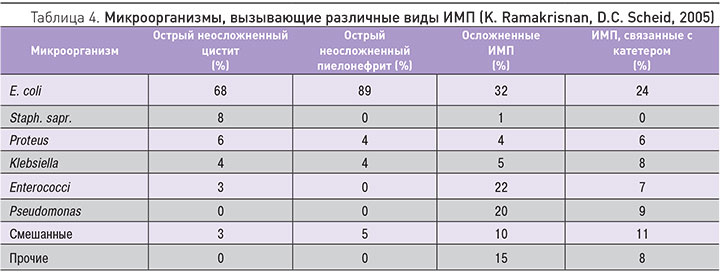
Тяжесть ИМП у пациентов с СД может варьировать от ББ до инфекции нижних отделов мочевыводящих путей (цистита), пиелонефрита и тяжелого уросепсиса. Некоторые тяжелые ИМП, например, эмфизематозный цистит и пиелонефрит, абсцессы почек и папиллярный некроз у пациентов с СД 2 типа встречаются чаще, чем в общей популяции [7]. СД 2 типа является ФР развития не только внебольничных, но и нозокомиальных, катетер-ассоциированных и посттрансплантационных ИМП. Кроме того, у таких пациентов возбудителями ИМП часто бывают устойчивые патогены, в том числе Enterobacteriaceae, продуцирующие β-лактамазы расширенного спектра (БЛРС), фторхинолон- и карбапенем-резистентные энтеробактерии, а также ванкомицин-резистентные энтерококки. СД 2 типа также является ФР развития грибковых ИМП, в основном вызванных кандидами [8]. Кроме того, наличие СД ассоциируется с ухудшением течения и исходов ИМП, в том числе с увеличением длительности госпитализаций и большей смертностью. Высокая частота ИМП у пациентов с СД, в сочетании с ростом заболеваемости и распространенности этой патологией во всем мире в последние годы, накладывает значительное дополнительное финансовое бремя на системы здравоохранения [9].
ЭТИОЛОГИЯ ИНФЕКЦИЙ МОЧЕВЫХ ПУТЕЙ
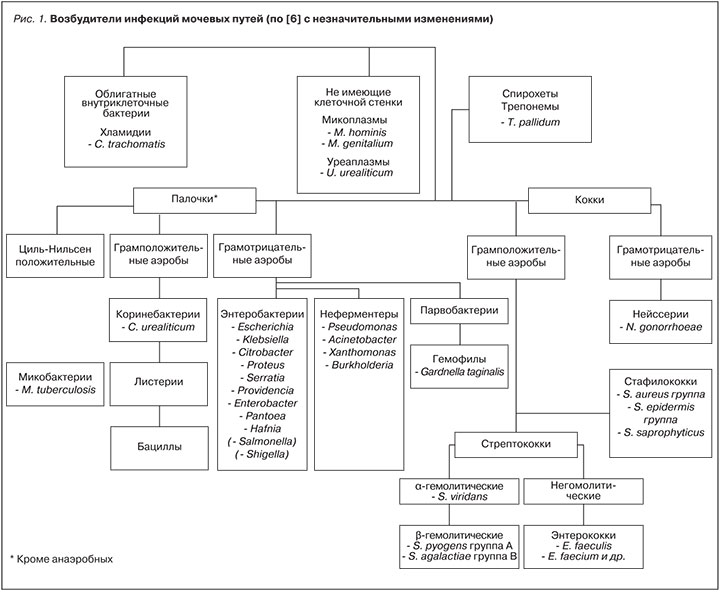
Как отмечалось выше, ИМП могут вызываться очень широким спектром возбудителей, причем не обязательно бактериального происхождения. Однако большая часть осложненных и неосложненных ИМП вызывается именно бактериальными агентами (рис. 1, табл. 4). Нетрудно заметить, что даже среди ОИМП в качестве возбудителей преобладают различные штаммы E. coli, хотя доля их в этих случаях снижается. У пациентов с СД наиболее частым возбудителем ИМП остается E. coli и другие энтеробактерии, такие как Klebsiella spp., Proteus spp., Enterobacter spp. и Enterococci [8]. Как уже отмечалось выше, возбудителями ИМП у больных СД нередко бывают резистентные к противомикробным препаратам патогены. Такую особенность связывают с рядом факторов, включая проведение множественных курсов антибиотерапии пациентам с часто бессимптомным или малосимптомным течением ИМП и высокой частотой внутригоспитальных и катетер-ассоциированных мочевых инфекций, которые обычно вызываются устойчивыми микроорганизмами.
ЭПИДЕМИОЛОГИЯ ИНФЕКЦИЙ МОЧЕВЫХ ПУТЕЙ
Как уже отмечалось выше, ИМП встречаются весьма часто, особенно у женщин [2, 3, 10–12], хотя в возрасте 70–75 лет заболеваемость ИМП у мужчин приближается к заболеваемости у женщин. Так или иначе, у женщин почти всех возрастных групп распространенность ИМП выше, чем у мужчин. При этом возможность заболеть ИМП у девочек и девушек нарастает с возрастом, достигая максимума примерно к 20-ти годам. В целом заболеваемость ИМП у женщин имеет два пика. Это период наибольшей сексуальной активности (20–40 лет) и возраст старше 60 лет (постменопауза). Наконец, у женщин вероятность развития клинически значимой ИМП в течение жизни достигает 60%. При этом половина всех женщин в период зрелого возраста переносит по крайней мере один эпизод острого цистита. Около 11% женщин старше 18 лет указывают на перенесенный эпизод ИМП на протяжении предыдущего года. ИМП очень часто приобретают рецидивирующее течение (рецидивирующие ИМП – рИМП). У женщин, заболевших ИМП, рецидивы этих заболеваний (главным образом, цистита) случаются в 16–25% всех случаев в течение 6 мес и у 40–50% на протяжении года, несмотря на антибактериальную терапию.
Пиелонефрит является менее распространенным типом ИМП, чем цистит. Согласно результатам популяционных исследований, ежегодная частота выявления пиелонефрита у амбулаторных больных равна 12–13 на 10 000, а среди госпитализированных – 3–4 на 10 000. Распространенность т.н. ББ у практически здоровых женщин увеличивается с возрастом, составляя 1% у девочек 5–14 лет и достигая 20% у 80-десятилетних.
Широкая распространенность ИМП определяет их высокую не только медицинскую, но и социальную значимость. В США ИМП ежегодно служат причиной около 7 млн амбулаторных посещений, 1 млн обращений за «скорой помощью» и 100 тыс. госпитализаций. В этой же стране в 2000 г. общие расходы на лечение пациентов с ИМП, исключая затраты на приобретение лекарств, назначенных амбулаторным пациентам, достигли примерно 2,5 млрд долл.
Распространенность ИМП в России составляет около 1000 случаев на 100 тыс. населения в год (в 2000 г. – 1245,3 на 100 тыс. населения). В 1997 г. по поводу ИМП было госпитализировано 332 239 человек. Заболеваемость острым циститом в РФ – 26–36 млн случаев в год. Следует отметить, что частота различных заболеваний отличается в регионах Российской Федерации. Так, воспалительные заболевания (хронический пиелонефрит, простатит, эпидидимит, орхит и др.) наиболее часто встречаются на Северном Кавказе (32%), Урале (48%) и в Восточной Сибири (30%).
Внутрибольничные ИМП, как и другие нозокомиальные инфекции, составляют отдельную и очень серьезную проблему. Они значительно увеличивают летальность и резко повышают затраты на лечение. При этом ИМП являются наиболее частыми внутрибольничными инфекциями, хотя их влияние на смертность меньше, чем влияние нозокомиальных пневмоний или бактериемий. Внутригоспитальные инфекции часто возникают вследствие хирургических вмешательств. Среди нозокомиальных ИМП особое место занимают процедуры, связанные с катетеризацией мочевого пузыря. Через 2 дня после установки постоянного катетера вероятность развития бактериурии увеличивается на 5–10% каждые сут. При этом даже однократная катетеризация мочевого пузыря сопряжена с 1–2% риском развития инфекции.
В больницах и учреждениях сестринского ухода в США число катетер-ассоциированных ИМП превышает 1 млн в год, что в относительном выражении составляет около 80% всех нозокомиальных инфекций мочевого тракта. Высокая распространенность мочевых инфекций, связанных в том числе с катетеризацией, определяет серьезные социальные и экономические последствия внутрибольничных ИМП, которые в целом затрагивают около 3% госпитализированных больных. В США нозокомиальные ИМП вызывают увеличение длительности госпитализации в среднем на 1 сут, что в масштабах всей страны составляет 1 млн «лишних» койко-дней. Внутригоспитальные ИМП являются в США причиной более 50 000 смертей в год. Дополнительные затраты на лечение каждого случая внутрибольничной ИМП составляют 676 долл., а в случае катетер-ассоциированной бактериемии – 29 000 долл.
Грамотрицательные микроорганизмы, в первую очередь E. coli, являются доминирующими возбудителями катетер-ассоциированных ИМП. Особую опасность представляет то, что такие инфекции часто вызываются мультирезистентными к антибиотикам штаммами кишечной палочки и других грамотрицательных бактерий, в частности, продуцирующих β-лактамазы расширенного спектра действия (БЛРС). Такие микроорганизмы зачастую мало чувствительны не только к β-лактамным антибиотикам, но и, например, к фторхинолонам. Это резко ограничивает возможности терапии ИМП, вызванных данными штаммами [2, 3, 10–12].
Эпидемиологические особенности ИМП при СД
У пациентов с СД 2 типа все виды ИМП встречаются чаще, чем у людей, не страдающих диабетом. Данные о частоте ИМП у таких больных приведены во многих работах. В обсервационном исследовании, выполненном в Великобритании, было показано, что уровень заболеваемости ИМП среди пациентов с СД составил 46,9 на 1000 человеко-лет по сравнению с 29,9 на 1000 человеко-лет у людей без диабета [13]. У женщин с давно установленным диагнозом диабета отмечался более высокий риск ИМП, чем у пациенток с недавно (в течение 6 мес) диагностированным диабетом (91,9/1000 против 70,5/1000 человеко-лет, 95% ДИ 68,2–72,8) [13]. Анализ 10 клинических испытаний, включавших в общей сложности более 6000 больных СД 2 типа, показал, что заболеваемость ИМП среди них составила 91,5 на 1000 человеко-лет у женщин и 28 на 1000 человеко-лет у мужчин [14]. В американском исследовании, выполненном по медицинской базе данных, включавшей более 70 000 пациентов с СД 2 типа, обнаружено, что ИМП в течение года диагностируется у 8,2% больных (12,9% женщин и 3,9% мужчин). При этом заболеваемость увеличивается с возрастом [9]. Анализ, проведенный на основе другой американской базы данных в 2014 г. (89 790 связанных пар пациентов с СД и без), также подтвердил, что диагноз ИМП чаще встречается у мужчин и женщин, страдающих СД, чем у людей без диабета (9,4 против 5,7% соответственно) [15].

ББ чаще встречается у женщин из-за анатомических особенностей, облегчающих колонизацию мочевых путей бактериями из кишечника. Заболеваемость ИМП увеличивается с возрастом, и ее увеличение также ассоциировано с наличием аномалий мочевых путей или использованием уретральных катетеров, стентов и т.д. [16, 17]. Во многих работах было показано увеличение распространенности ББ у пациентов с СД, частота которой варьировала от 8 до 26%. Мета-анализ 22 исследований, опубликованный в 2011 г., показал распространенность ББ у больных с СД в 12,2% по сравнению с 4,5% у здоровых людей [18]. Распространенность ББ была выше как у мужчин, так и у женщин с СД и увеличивалась с ростом длительности диабета, но не ассоциировалась с гликемическим статусом, который оценивался по уровню гликированного гемоглобина A1c(HbA1c) [18]. По результатам проспективного исследования больных, госпитализированных в индийской больнице, распространенность ББ среди пациентов с диабетом была найдена равной 30% [19].
В исследовании, выполненном в штате Вашингтон (Washington State health group), было установлено, что у женщин в пременопаузе с СД пиелонефрит встречается 4,1 раза чаще, чем у женщин, не страдающих диабетом [20]. В канадском исследовании было обнаружено, что пациентки, страдающие СД 2 типа и СД 1 типа и получающие пероральную гипогликемическую терапию или инсулин, в 6–15 раз (в зависимости от возраста) чаще госпитализируются по поводу острого пиелонефрита по сравнению с женщинами без диабета. В свою очередь, мужчины с СД госпитализировались в связи с пиелонефритом в 3,4–17 раз чаще, чем пациенты без диабета [21]. Результаты датских исследователей показали, что у больных с СД в 3 раза больше шансов быть госпитализированными по поводу пиелонефрита по сравнению с индивидуумами без диабета [22].
У мужчин с СД увеличивается риск развития острого бактериального простатита, абсцесса предстательной железы, прогрессирования хронического простатита и появления инфекционных осложнений вследствие манипуляций на простате (например, трансректальная биопсия) [23, 24].
ПАТОГЕНЕЗ ИНФЕКЦИЙ МОЧЕВЫХ ПУТЕЙ
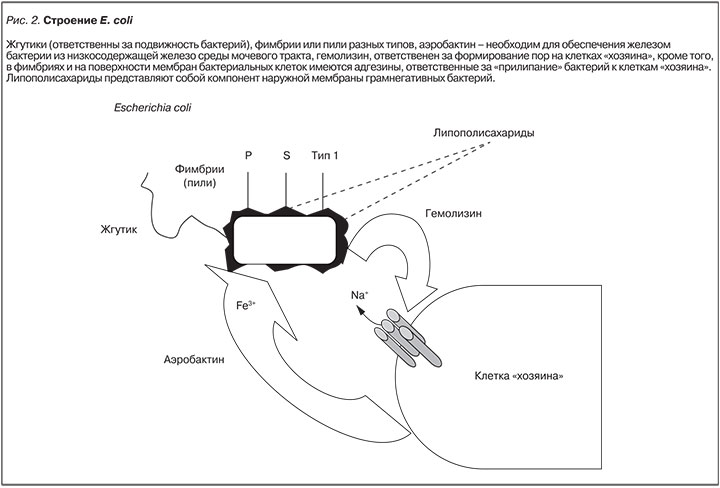
В последние 2–3 десятилетия микробиологи, иммунологи и молекулярные биологи сделали целый ряд замечательных открытий, которые перевернули многие устоявшиеся представления о механизмах развития инфекционного процесса. В полной мере это относится и к наиболее частому возбудителю ИМП – кишечной палочке. E. coli – бактериальный комменсал (микроорганизм, живущий за счет макроорганизма, но не приносящий ему вреда), существующий в кишечнике млекопитающих (рис. 2). Однако могут появляться и патогенные штаммы этого микроорганизма. Диареегенные штаммы E. coli вызывают колит и гастроэнтерит. Различные внекишечные патогенные штаммы E. coli (extraintestinal pathogenic E. coli – ExPEC) включают в себя, в частности, наиболее интересующие нас уропатогенные штаммы E. coli (uropathogenic E. coli – UPEC).
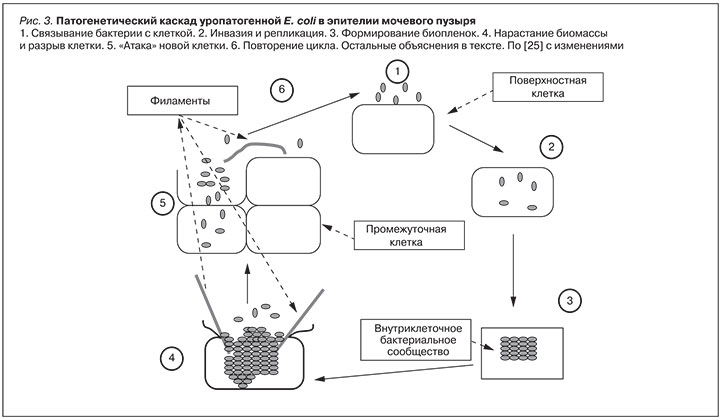
Очень интересные данные были получены в последнее время о механизмах размножения уропатогенных штаммов E. coli (рис. 3). Оказалось, что эти бактерии сначала прикрепляются к мембранам клеток «хозяина» за счет адгезинов, содержащихся на верхушках пилей, затем проникают внутрь клетки. Здесь они начинают размножаться, формируя «внутриклеточные бактериальные сообщества» и образуя т.н. биопленки, которые, по-видимому, могут располагаться как внутриклеточно, так и на поверхности клеточных мембран. Биопленки надежно защищают внутриклеточную колонию, в том числе, от воздействия антимикробных препаратов. Когда масса размножающихся бактерий достигает критического уровня, микробы просто разрывают клетку и, выходя из нее, атакуют соседние или нижележащие. При этом часть бактерий проходит процесс филаментации, значительно увеличиваясь в длину. Считается также, что в форме филамент микроорганизмы резистентны к антибиотикам (рис. 3). Такой механизм получил название «патогенетический каскад» уропатогенной E. coli [25]. В возможности его существования в эпителии мочевого пузыря практически нет сомнений. Однако вопрос о наличии такого каскада в других отделах мочевого тракта пока остается открытым. На наш взгляд, из наличия данного каскада вытекает, по крайней мере, два следствия. Во-первых, на его основе можно объяснить патогенез столь распространенного заболевания, как рецидивирующий цистит. Во-вторых, за счет кругооборота бактерий в эпителии мочевого пузыря там создается второй резервуар E. coli (первым, естественно, является толстый кишечник). По нашему мнению, наличие дополнительного резервуара бактерий непосредственно в мочевыводящих путях может облегчить проникновение микроорганизмов в вышележащие отделы мочевого тракта, в том числе – в почку.
 В фимбриях и на поверхности мембран бактериальных клеток имеются адгезины, ответственные за их «прилипание» бактерий к клеткам «хозяина». Известно несколько типов фимбрий (Р-пили, S/F1C-пили, пили типа 1 и др.). Показано, что вид заболевания, вызываемого данным штаммом E. coli, в определенной, но не абсолютной мере зависит от типа его фимбрий. В частности, наличие P-пилей часто, хотя и не всегда, ассоциируется с пиелонефритом. Например, C.K. Garofalo и соавт. [26], выполнив иммуноблот-анализ изолятов E. coli у женщин с различными видами ИМП, в том числе с пиелонефритом, пришли к следующему заключению: «К нашему удивлению ни один из “пиелонефритных” изолятов не содержал каких-либо генов внутри pap-оперона и, следовательно, не экспрессировал P-пили. Напротив, все “пиелонефритные” изоляты, так же как изоляты больных с бессимптомной бактериурией, острым и рецидивирующим циститом, имели ген fimH» [т.е. имели пили типа 1 – Прим. авт.]. Инфицирование мочевых путей происходит в основном своими собственными уропатогенными штаммами кишечной палочки (аутоинфицирование) [27]. Очевидно, что этому способствуют особенности строения мочеполовой системы женщин. Однако есть данные о том, что ИМП, вызванные E. coli, могут развиваться за счет зараженных продуктов и других предметов [28]. Имеются также сведения, что в ряде случаев ИМП могут быть и сексуально-трансмиссивными инфекциями [29]. Это необходимо учитывать при выборе тактики лечения и профилактики.
В фимбриях и на поверхности мембран бактериальных клеток имеются адгезины, ответственные за их «прилипание» бактерий к клеткам «хозяина». Известно несколько типов фимбрий (Р-пили, S/F1C-пили, пили типа 1 и др.). Показано, что вид заболевания, вызываемого данным штаммом E. coli, в определенной, но не абсолютной мере зависит от типа его фимбрий. В частности, наличие P-пилей часто, хотя и не всегда, ассоциируется с пиелонефритом. Например, C.K. Garofalo и соавт. [26], выполнив иммуноблот-анализ изолятов E. coli у женщин с различными видами ИМП, в том числе с пиелонефритом, пришли к следующему заключению: «К нашему удивлению ни один из “пиелонефритных” изолятов не содержал каких-либо генов внутри pap-оперона и, следовательно, не экспрессировал P-пили. Напротив, все “пиелонефритные” изоляты, так же как изоляты больных с бессимптомной бактериурией, острым и рецидивирующим циститом, имели ген fimH» [т.е. имели пили типа 1 – Прим. авт.]. Инфицирование мочевых путей происходит в основном своими собственными уропатогенными штаммами кишечной палочки (аутоинфицирование) [27]. Очевидно, что этому способствуют особенности строения мочеполовой системы женщин. Однако есть данные о том, что ИМП, вызванные E. coli, могут развиваться за счет зараженных продуктов и других предметов [28]. Имеются также сведения, что в ряде случаев ИМП могут быть и сексуально-трансмиссивными инфекциями [29]. Это необходимо учитывать при выборе тактики лечения и профилактики.
Следующее важное звено в этиопатогенезе ИМП – наличие у E. coli жгутика. По общему правилу он отвечает за подвижность бактерий, играя роль своеобразного «пропеллера» или, правильнее сказать, «гребного винта». Жгутики грамотрицательных бактерий имеют очень сложное строение. В основании жгутика находится базальное тельце, включающее специфическую для жгутиков секреторную систему (секреторная система тип III – T3SS), расположенную во внутренней мембране и непосредственно под ней. Гибкий «крюк», к которому далее прикрепляется жесткий филамент. Внутри жгутик полый и имеет канал диаметром около 2 нм. На верхушке канал закрыт специальной крышкой. Основным белковым компонентом жгутика является флагеллин [30]. Жгутики различных бактерий вращаются с разной скоростью. У кишечной палочки она составляет около 15 000 об./мин. В мире микробов это далеко не рекорд. Скорость вращения жгутика у Vibrio может достигать 100 000 об./ мин (!) [30]. Энергия для такого вращения поступает при гидролизе АТФ. При этом в составе базального тельца имеются белки, проявляющие свойства H+-АТФаз. У энтеропатогенных E. coli это EscN (собственно АТФаза) и EscL (регулятор АТФазы). При вращении жгутика под действием АТФазы происходит транслокация протонов внутрь бактериальной клетки. Есть основания полагать, что подвижность E. coli достаточно велика для того, чтобы они могли продвигаться по мочевым путям против тока мочи.
Жгутиковый аппарат грамотрицательных бактерий формируется путем самосборки. При этом он может собираться либо в виде собственно жгутика («пропеллера»), либо как инъекцисома. Последняя представляет, по сути, полое сверло, которое, вращаясь с большой скоростью, пронизывает цитоплазматические мембраны клеток «хозяина» (в данном случае эпителия мочевых путей и, возможно, почечных канальцев). После этого в клетку впрыскиваются специальные регуляторные протеины, которые изменяют ее деятельность в желательном для микроорганизма направлении [30]. Однако можно допустить (доказательства этого, правда, нам пока не известны), что и в вышерасположенных отделах мочевого тракта, например, в мочеточниках и почечных лоханках существует патогенетический каскад уропатогенной E. coli. Если это допущение справедливо, то на определенных этапах каскада (в момент выхода бактерий из разорванной эпителиальной клетки) может происходить инфицирование соседних клеток, в том числе вышележащих. Вероятность последнего нарастает, если момент разрыва клетки совпадет с фазой диастолы перистальтики мочеточника. Таким образом, продвижение E. coli к почке может происходить не только за счет «плавания», но и, так сказать, «по стеночке» («контактно-клеточный путь»). Пока эти соображения сугубо умозрительны и требуют проверки.
Тем не менее возникает резонный вопрос: почему E. coli, бактерия, эволюционно приспособленная для обитания в кишечнике, начинает вдруг мигрировать в мочевые пути? Ответ на него неожиданно оказался довольно простым. В его основе лежит хорошо известное свойство микроорганизмов – хемотаксис. Бактериальный хемотаксис является феноменом, за счет которого бактериальные клетки ощущают изменения в химическом составе окружающей среды и передвигаются к аттрактантам от репеллентов. Как и другие биологические сенсорные системы, бактериальный хемотаксический путь позволяет клетке адаптироваться к персистированию химических стимулов. Проще говоря, бактерии (как и другие микроорганизмы) способны мигрировать из среды обитания, содержащей неблагоприятные и опасные для них химические соединения, в другое окружение, например, изобилующее подходящими для них питательными веществами.
Основными игроками трансдукции сигнала в системе хемотаксиса у E. coli являются трансмембранный хемотаксический метил-акцептирующий белок (MCP) и шесть цитозольных протеинов: CheA, CheB, CheR, CheW, CheY and CheZ. Рецепторы формируют комплекс с гистидиновой киназой CheA с помощью адапторного протеина CheW. Аутофосфорилационная активность CheA угнетается (усиливается), когда хемоаттрактант (репеллент) связывается с рецептором. Активированная гистидинкиназа CheA получает фосфатную группу за счет аутофосфорилирования и далее передает ее регулятору ответа CheY или демитилированному энзиму CheB. Фосфорилированный Chey может связываться со жгутиковым мотором, изменяя его активность. Хемотаксической адаптации E. coli способствует метилирование и деметилирование хеморецепторов, катализируемых CheR и CheB-P соответственно [31].
В частности, выяснилось, что штаммы-комменсалы кишечной палочки хорошо приспособлены для получения энергии из углеводов кишечного содержимого, которыми оно изобилует. В то же время уропатогенные, фактически мутантные штаммы E. coli, не утрачивая эту способность, приобретают свойства, позволяющие им питаться азотистыми соединениями, которыми богата моча. Кроме того, они получают механизмы обеспечения железом, которым содержимое мочевого тракта, напротив, относительно бедно [32].
Гены, кодирующие факторы вирулентности экстраинтестинальных штаммов кишечной палочки, часто объединяются в геномные кластеры, известные как островки патогенности (ОП). Такие гены контролируют множество фимбриальных и нефимбриальных адгезинов, токсинов и систем обеспечения бактериальной клетки железом [33]. ОП у комменсалов E. coli не выявлено, геном микроорганизма в среднем составляет около 2000 генов, тогда как ожидаемое число генов, например, у «пиелонефритного» штамма CFT073 насчитывает 5388. Очевидно, что многие из этих генов кодируют уже упомянутые факторы вирулентности (в том числе способность потреблять питательные вещества, неприемлемые для непатогенных бактерий). Это расширяет возможности патогенных штаммов адаптироваться к изменениям окружающей среды и колонизировать новые места обитания, в частности мочевой тракт [32]. Если уропатогенные штаммы E. coli действительно сохраняют способность использовать углеводы и приобретают свойства потреблять азотистые соединения, то можно попытаться объяснить и смысл их продвижения вверх по мочевым путям и даже «желание» проникнуть в почечные канальцы. Именно в проксимальных канальцах в большом количестве имеется глюкоза и аминокислоты, которые полностью реабсорбируются. Поэтому с позиций хемотаксиса перемещение уропатогенных штаммов E. coli максимально вверх по мочевыводящим путям означает их стремление проникнуть в наиболее благоприятные места обитания.
Еще один важный момент, который имеет прямое отношение к патогенезу ИМП и в особенности пиелонефрита, – это взаимодействие бактерии с клеткой «хозяина». За последние годы здесь достигнуты колоссальные успехи, и связаны они с открытием т.н. Toll-like-рецепторов (TLRs), играющих ключевую роль в распознавании патоген-ассоциированных молекулярных структур (pathogen-associated molecular patterns – PAMPs) и инициации иммунного ответа [33]. В настоящее время у млекопитающих описано 13 типов TLR, из которых TLR1-TLR10 экспрессируются у человека: TLR1 и TLR2 локализованы в лейкоцитах, TLR2 и TLR4 – в моноцитах, TLR7, TLR9, TLR10 – в макрофагах, молодых дендритных клетках, клетках-киллерах, T и B-клетках. В почках TLR4 выявляют в париетальных клетках капсулы Боумена, проксимального извитого канальца (ПИК), толстого восходящего отдела петли Генле (ТолВПГ), дистального канальца (ДК), собирательной трубки (СТ). Лигандом для этих рецепторов служат липополилисахариды наружной мембраны кишечной палочки [33]. Взаимодействие липополилисахарида с TLR4-рецептором приводит к лавине очень сложных событий, что в свою очередь заканчивается активацией различных провоспалительных и противовоспалительных цитокинов и хемокинов. Цель этой реакции – уничтожить пришельца (обеспечить клиренс бактерий). Однако в ряде ситуаций воспалительная реакция может стать сверхмощной. Тогда те же самые цитокины и хемокины, которые должны уничтожать микроорганизм, начинают повреждать собственную ткань почки. В конечном итоге это заканчивается фиброзом [34] (рис. 4).
Следует отметить, что система распознавания бактериальных агентов не исчерпывается только TLRs. Существуют сравнительно недавно открытые Nacht-LRR (NLR) рецепторы, включающие Nod1 and Nod2 (видимо, поэтому их еще называют Nod-like рецепторами), RIG-like рецепторы (RLRs) и маннозосвязывающие лектины [35]. Тем не менее о лигандах и функции, а тем более участии данных рецепторно-сигнальных систем в развитии инфекционно-воспалительных процессов в мочевыделительной системе пока мало что известно.
Дополнительные патогенетические факторы, способствующие развитию ИМП у пациентов с СД
Ряд потенциальных механизмов, уникальных для СД, может способствовать увеличению риска ИМП у больных диабетом. Более высокие концентрации глюкозы в моче могут способствовать росту патогенных бактерий [36]. Однако некоторые исследования не нашли связи между уровнем HbA1c, который рассматривался в качестве косвенного признака глюкозурии, и риском развития ИМП у пациентов с СД. Кроме того, назначение ингибиторов глюкозо-натриевого котранспортера типа 2 (SGLT-2) в проксимальных канальцах, которые способствуют глюкозурии, далеко не всегда ассоциировалось с нарастанием частоты ИМП [37]. Тем не менее предполагается, что высокий уровень глюкозы в почечной паренхиме создает благоприятные условия для роста и размножения микроорганизмов, что становится причиной развития пиелонефрита, в том числе эмфизематозного [38]. Многие нарушения иммунитета, в том числе гуморального, клеточного и врожденного могут вносить вклад в патогенез ИМП при СД [39]. У пациентов с СД и ББ были обнаружены меньшие уровни интерлейкинов 6 и 8 в моче по сравнению с больными ББ, но без диабета. Наличие автономной нейропатии с вовлечением мочевого тракта приводит к дисфункции мочеиспускания и задержке мочи. Это уменьшает физический бактериальный клиренс во время мочеиспускания, способствуя тем самым росту бактерий [40]. Дисфункция мочевого пузыря наблюдается у 26–85% женщин с СД в зависимости от возраста, степени нейропатии и длительности диабета [40] и, скорее всего, имеется у всех больных диабетом с ИМП.
В статье из Саудовской Аравии были названы следующие факторы, ассоциированные с повышенным риском развития ИМП у пациентов с СД: женский пол (относительный риск [ОР] 6,1), артериальная гипертензия (ОР 1,2), инсулинотерапия (ОР 1,4), индекс массы тела (ИМТ) >30 кг/м2 (ОР 1,72) и нефропатия (ОР 1,42) [41]. Как уже отмечалось, появление ингибиторов SGLT-2, которые индуцируют глюкозурию, вызвало озабоченность тем, что эти препараты могут повышать риск ИМП [87]. Тем не менее в одном из мета-анализов найдены сходные величины заболеваемости ИМП у пациентов, получающих канаглифлозин, и в контрольной группе [42]. Назначение дапаглифлозина ассоциировалось с небольшим нарастанием частоты ИМП (4,8 против 3,7%), хотя распространенность пиелонефрита при этом не увеличивалась [43].
АНТИБАКТЕРИАЛЬНАЯ ТЕРАПИЯ ИНФЕКЦИЙ МОЧЕВЫХ ПУТЕЙ
Несмотря на успехи микробиологии, иммунологии и молекулярной биологии в раскрытии интимных механизмов взаимодействия возбудитель–«хозяин», в том числе в приложении к ИМП, пока почти не предложено каких-либо клинически приемлемых подходов, которые воздействовали бы на определенные звенья воспалительной реакции, тем самым подавляя или направляя ее в нужное русло. В силу этого терапия ИМП во многом, но не исключительно (поскольку в ряде случаев адекватное лечение ОИМП требует оперативных вмешательств или иных урологических пособий) базируется на использовании тех или иных антибактериальных препаратов.
По нашему мнению, наличие клинических проявлений ИМП, будь то острый процесс или обострение хронического, требует обязательного назначения противомикробных препаратов. В таких ситуациях категорически нельзя ограничиваться только попытками применения, например, уроантисептиков растительного происхождения. Однако очень важно, что при наличии обструкции мочевых путей антибактериальные средства не могут применяться до ее устранения. В противном случае резко возрастает вероятность развития бактериального эндотоксического шока.
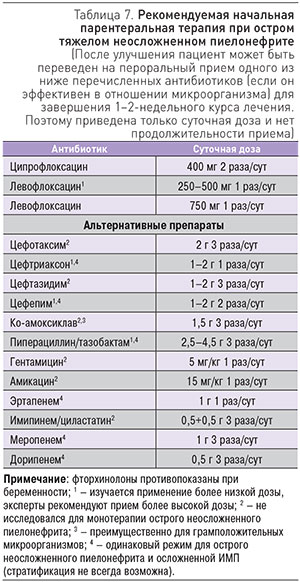
От многих противомикробных препаратов, применявшихся ранее для терапии ИМП, приходится отказываться из-за появления большого количества резистентных к ним штаммов микроорганизмов. В силу этого современный спектр лекарственных препаратов, рекомендуемых для лечения ИМП, достаточно узок. В Рекомендациях ЕАУ сделана попытка унифицировать подходы к антибактериальной терапии различных вариантов ИМП. Так, при остром несложненном цистите у женщин в пременопаузальном периоде в качестве препаратов первой линии предлагаются: фосфомицина трометамол, нитрофурантоин, в том числе в виде макрокристаллов, и пивмециллинам. В качестве альтернативных препаратов предлагаются: ципрофлоксацин, левофлоксацин, норфлоксацин, офлоксацин, цефподоксима проксетил. При локальной (для данного региона) резистентности E. coli <20% допустимо использование триметоприма (ТМП) или комбинации ТМП/сульфаметоксазол (табл. 5). Мы полагаем, что использование ко-тримаксозола (бисептола) в современных российских условиях совершенно не оправдано из-за большой доли штаммов, нечувствительных к этим препаратам.
При неосложненном пиелонефрите легкой и средней степени тяжести у женщин в пременопаузе для начала эмпирической антибактериальной терапии рекомендован пероральный прием ципрофлоксацина или левофлоксацина. Как альтернатива могут рассматриваться цефподоксима проксетил или цефибутен, которые эквивалентны фторхинолонам по клиническому, но не микробиологическому эффектам. Только при известной чувствительности патогена (т.е. не для начальной эмпирической терапии) возможно использование ТМП/сульфаметоксазола или ко-амоксиклава (табл. 6).
Начальная терапия при тяжелом течении пиелонефрита обязательно должна быть парентеральной. Средствами первой линии остаются ципрофлоксацин и левофлоксацин. Альтернативными препаратами являются: цефотаксим, цефтриаксон, цефтазидим, цефепим, ко-амоксиклав, пиперациллин/тазобактам, гентамицин, амикацин, эртапенем, имипинем/циластатин, меропенем и дорипенем. После клинического улучшения пациент может быть переведен на пероральный прием одного из вышеперечисленных антибиотиков (если он эффективен в отношении микроорганизма) для завершения 1–2-недельного курса лечения (табл. 7).
В Рекомендациях ЕАУ приведен ряд уточнений и ограничений как в отношении использования конкретных препаратов, так и особенностей антибактериальной терапии в различных популяциях пациентов с ИМП. Однако в наши задачи не входит пересказ этого документа. Поэтому ниже мы постараемся дать только отдельные комментарии по вопросам противомикробной терапии ИМП, которые представляются нам наиболее существенными.
Стоит обратить внимание на то, что Рекомендации ЕАУ, как и полагается подобным документам, построены на принципах доказательной медицины. Поэтому некоторые антибактериальные препараты, не прошедшие проверок в контролируемых рандомизированных исследованиях, в них не включены, и можно полагать, что список противомикробных средств, потенциально эффективных в лечении ИМП, несколько шире. Необходимо также иметь в виду, что формальное использование принципов доказательной медицины, произвол и методологические ошибки при построении мета-анализов и систематических обзоров могут привести к недостаточно обоснованным заключениям. Блестящий критический анализ данной проблемы дан, в частности, И.С. Палагиным [44] на примере сравнения эффективности «коротких курсов фторхинолонов» и фосфомицина. Следующий момент, заслуживающий комментария, – дозы и, особенно, длительность применения противомикробных препаратов. В целом современная стратегия предполагает наиболее возможно короткие курсы антибиотиков при ИМП, что полностью отражено в Рекомендациях ЕАУ [6]. Однако в отношении продолжительности применения отдельных препаратов при конкретных ИМП возникают вопросы. В частности, эксперты ЕАУ предлагают назначать при остром несложненном цистите у практически здоровых женщин в пременопаузальном периоде ципрофлоксацин по 250 мг × 2 раза/сут в течение 3-х дней. У многих отечественных специалистов-практиков столь небольшая доза и, в особенности, малая длительность лечения вызывает некоторое недоумение. Результаты некоторых доступных мета-анализов, в том числе выполненных в рамках Кокрановского сотрудничества, дают основания полагать, что короткие (3-дневные) курсы фторхинолонов по крайней мере не менее эффективны, чем более продолжительные программы лечения [45]. В то же время результаты других систематизированных исследований свидетельствуют о том, что 3-дневные курсы антибактериальной терапии цистита у женщин сравнимы с более длительными курсами по клиническому, но не бактериологическому эффектам [46]. В данной связи есть смысл вспомнить бум в отношении режима применения противомикробных препаратов в виде однократной дозы для лечения неосложненных ИМП, охвативший некоторое время назад многих зарубежных специалистов, который уже сошел практически на нет. В настоящее время такой режим применяется только в отношении одного препарата – фосфомицина трометамола. На наш взгляд, стремление к использованию коротких и сверхкоротких курсов антибактериальной терапии для лечения даже неосложненных вариантов цистита должно быть подтверждено в дальнейших хорошо спланированных исследованиях. Только такие разработки могли бы подтвердить или опровергнуть справедливость данной тактики в отношении долгосрочного прогноза: частоты рецидивов, появления резистентности к противомикробным средствам и, возможно, развития более тяжелых форм ИМП. Следует отметить, что в российских рекомендациях для терапии неосложненного цистита предлагаются более высокие дозы ципрофлоксацина (500 мг × 2 раза/сут в течение 3-х дней) [47].
Особенности противомикробной терапии ИМП у пациентов с СД
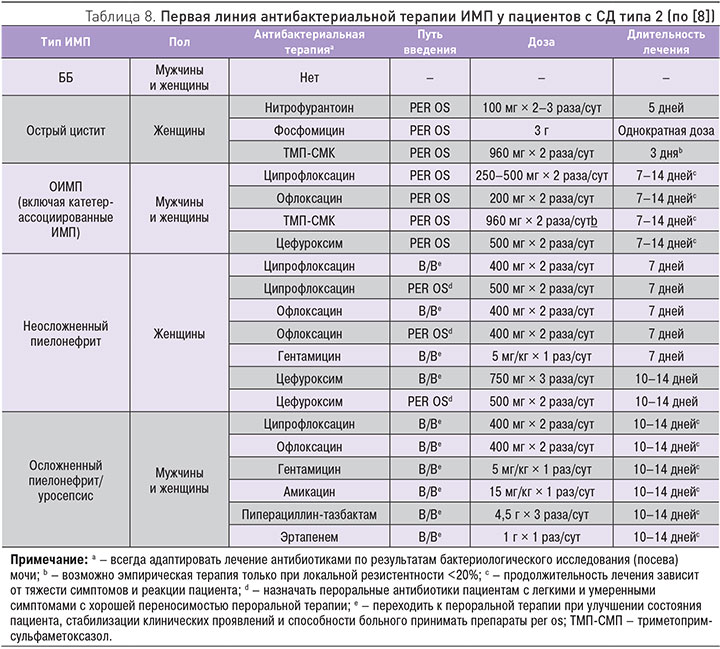
Противомикробное лечение ИМП у пациентов с СД 2 типа, в принципе, мало отличается от такового в других ситуациях и определяется несколькими факторами: наличием симптомов, локализацией инфекции (нижние мочевые пути или вовлечение почек), присутствием аномалий мочевых путей, тяжестью системных проявлений, сопутствующих метаболических нарушений и состоянием функции почек [4]. Как и при ИМП без диабета, выбирая противомикробное средство, следует руководствоваться сведениями о локальной чувствительности патогенов. Лечение также должно предполагать коррекцию метаболических сдвигов, вызванных инфекционным процессом. Подходы к антибактериальной терапии первой линии различных вариантов ИМП у пациентов с СД представлены в табл. 8 [8].
Как и в общем случае, показания к лечению ББ у пациентов с СД отсутствуют. Ранние исследования вызывали обеспокоенность в том, что ББ может ассоциироваться с прогрессированием до симптоматической ИМП и нарушением функции почек у пациентов с СД. Однако результаты более поздних работ показали, что у женщин с СД ББ не приводит к повышению риска более быстрого прогрессирования почечной дисфункции [48]. Таким образом, лечение ББ у женщин, больных диабетом, не дает никаких кратко- или долгосрочных преимуществ [49]. Плацебо-контролируемое рандомизированное проспективное исследование 105 женщин с СД обнаружило, что при среднем сроке наблюдения 27 мес антибактериальное лечение не оказывало влияния на частоту развития симптоматических ИМП, пиелонефритов или госпитализаций по поводу мочевых инфекций [49]. В исследовании, начатом в 2006 г., было установлено, что ББ сама по себе не ассоциируется с нарастанием скорости прогрессирования повреждения почек или развитием осложнений при долгосрочном наблюдении в течение 6 лет у пациентов с СД [48]. Еще в одном исследовании, в котором женщины с СД и ББ наблюдались в течение 3-х лет, было показано, что, несмотря на то, что бактериурия сохраняется или рецидивирует, у большинства пациенток она остается доброкачественной [50]. Во всех упомянутые выше исследованиях было показано, что у женщин с ББ множественные курсы антибактериальной терапии могут приводить к нарастанию устойчивости микроорганизмов к антибиотикам.
Острый цистит у женщин с СД при хорошем гликемическом контроле и отсутствии хронических осложнений диабета может лечиться, как неосложненная ИМП [4]. В таких случаях возможно эмпирическое лечение следующими препаратами: нитрофурантоин – 100 мг 3 раза/сут в течение 5 дней, фосфомицина трометамол 3 г в режиме одной дозы или ТМП-СМК 960 мг 2 раза/сут в течение 3-х дней. Эмпирическое лечение возможно, только если локальная резистентность к препарату в данной популяции составляет менее 20% и если это лекарство не применялось в предыдущие 3 мес [51]. Со своей стороны, подтвердим крайний скептицизм в отношении целесообразности применения ТМП-СМК (бисептола и др.) в настоящее время для лечения пациентов с ИМП (в том числе страдающих диабетом) в нашей стране. Хинолоны и β-лактамы служат другими, альтернативными препаратами второй линии. Лечение должно корректироваться в зависимости от результатов бактериологического исследования мочи (чувствительность к антибиотикам).
Другие случаи инфекций нижних отделов мочевыводящих путей у больных СД считаются осложненными и должны лечиться с использованием антибиотиков. У пациентов с постоянным катетером развитие ИМП требует его смены [52]. Большое разнообразие потенциальных инфицирующих агентов и высокая вероятность инфицирования резистентными штаммами ставит под сомнение возможность выработки унифицированных рекомендаций по эмпирической терапии. Всякий раз, когда это возможно, начало антибактериальной терапии должно быть отсрочено до получения результатов бактериологического исследования («посев») мочи с определением чувствительности возбудителя к антибиотикам. После этого может быть выбрано специфическое противомикробное лечение, направленное на конкретный патоген. По нашему мнению, в таких случаях «злоупотреблять» отсрочкой начала лечения (пусть эмпирического) не следует. Лучше назначить противомикробную терапию и далее ее скорректировать при необходимости в зависимости от результатов исследования культуры мочи. Возможные терапевтические подходы в данном случае – фторхинолоны, ТМП-СМП (с уже не раз отмеченными оговорками) и β-лактамы (табл. 8).
Как и в общем случае (табл. 6), пиелонефрит у пациентов с СД 2 типа может лечиться с использованием пероральных антибиотиков при небольшой или умеренной выраженности симптомов заболевания, при отсутствии нарушений всасывания в желудочно-кишечном тракте вследствие нарушений опорожнения желудка или хронической диареи на фоне диабетической нейропатии. Тем не менее больные СД с тяжелыми симптомами, гемодинамической нестабильностью, метаболическими сдвигами или проявлениями, которые исключают прием пероральных препаратов (тошнота, рвота), должны быть госпитализированы для проведения первоначальной внутривенной антибактериальной терапии. Такая терапия предполагает эмпирическое назначение антибиотиков широкого спектра действия: цефалоспоринов, фторхинолонов, аминогликозидов, пиперациллин-тазобактама или карбапенемов (табл. 8). Лечение должно корригироваться по результатам бактериологических исследований, которые необходимо выполнить как можно раньше.
Рекомендуемая продолжительность антибактериального лечения ИМП представлена в табл. 8. Она в принципе не отличается от таковой у пациентов без СД, хотя некоторые специалисты полагают, что у таких больных противомикробное лечение должно быть более длительным. Однако доказательств, полученных в рандомизированных контролируемых испытаниях, в пользу этой точки зрения пока не существует. Лечение эмфизематозного пиелонефрита, наряду с использованием антибиотиков, требует хирургического лечения и должно проводиться в условиях урологического отделения.
При выборе антибиотиков у пациентов с СД следует также принимать во внимание возможные лекарственные взаимодействия между антимикробными и антидиабетическими или антигипертензивными препаратами, а также иметь в виду, что некоторые антибиотики способны вызывать нарушения гомеостаза глюкозы. Необходимо помнить, что у больных СД со сниженной функцией почек некоторые противомикробные средства требуют коррекция дозы. Особое внимание к состоянию функции почек необходимо проявлять при назначении аминогликозидов. У пациентов с почечной дисфункцией следует также избегать применения нитрофуранов. Из-за снижения почечного клиренса накопление данных препаратов может способствовать усугублению периферической нейропатии.
Лечение рецидивирующих ИМП у пациентов с СД и без него в целом аналогично. У молодых женщин, не имеющих диабетических осложнений, может рассматриваться ежедневная или посткоитальная низкодозная профилактика антибиотиками. У больных с почечной недостаточностью, сложными аномалиями развития мочевых путей или в случаях инфицирования высокорезистентными бактериями эффект от длительной антибактериальной профилактики может быть незначительным. При необходимости длительного использования мочевого катетера вследствие неполного опорожнения мочевого пузыря интермиттирующая катетеризация предпочтительнее установки постоянного катетера.



