ВВЕДЕНИЕ
Гестационный сахарный диабет (ГСД) – наиболее распространенная форма нарушения углеводного обмена во время беременности, на которую приходится до 84% всех случаев гипергликемий. Так, гипергликемия выявляется у 20 млн беременных женщин, что составляет 16% живорождений. Таким образом, каждые 6-е роды происходят от беременности, протекавшей на фоне ГСД [1].
ГСД представляет серьезную угрозу здоровью матери и плода ввиду его высокой ассоциации с развитием краткосрочных и долгосрочных осложнений. В настоящее время известно, что ГСД повышает риск преэклампсии, рождения крупного плода, родовых травм, неонатальных гипогликемии и желтухи, респираторного дистресс-синдрома и мертворождения [2, 3]. К долгосрочным его осложнениям относят развитие ожирения, сахарного диабета 2-го типа (СД 2), сердечно-сосудистых заболеваний у матери и потомства в будущем [1, 2].
Большинство медицинских сообществ, включая Всемирную организацию здравоохранения (ВОЗ), Эндокринное общество, Международную федерацию гинекологии и акушерства, Российскую ассоциацию эндокринологов, Американскую ассоциацию диабета, рекомендуют оценивать углеводный обмен у всех беременных на 24–28-й неделях гестации с помощью перорального глюкозотолерантного теста [4–8]. Ряд медицинских сообществ также предлагает проводить универсальный, но двухэтапный подход в диагностике ГСД.
Несмотря на проведение универсального скрининга на ГСД, а также наличие эффективных методов его лечения, распространенность осложнений этой формы гипергликемии для беременных и потомства остается значимой проблемой во всем мире. Стремление улучшить исходы беременности для женщин с ГСД и их потомства, прогнозировать эффективность немедикаментозной терапии и потребность в инсулинотерапии привело к активному изучению патофизиологических аспектов формирования гипергликемии в период беременности [9–13]. В зависимости от преобладания дефекта β-клетки или нарушения чувствительности к инсулину у беременных были выделены различные подтипы ГСД. Так, в ряде исследований получены данные о том, что в основе этой формы диабета могут лежат как дефекты секреции инсулина при нормальной чувствительности к нему, так и нарушение чувствительности к инсулину с гиперинсулинемией. Эти результаты послужили основанием для выделения подтипа ГСД с преобладающей дисфункцией β-клеток и подтипа ГСД с превалирующей инсулинорезистентностью (ИР) [10–13]. В последующем появились сведения, позволяющие говорить не только о различных патогенетических подтипах ГСД, но и разных их фенотипических особенностях и рисках неблагоприятных исходов беременности [11, 12].
Очевидно, что развитие как самого ГСД, так и достижение нормогликемии зависит от образа жизни женщины, ведущая роль в котором принадлежит особенностям питания. Важнейшим фактором снижения риска развития ГСД и контроля гликемии может служить достаточное потребление пищевых волокон, которые посредством влияния на аппетит, потребление энергии, увеличение времени пассажа пищи по желудочно-кишечному тракту, снижение скорости всасывания глюкозы и уровень инсулина в плазме приводят к снижению ожирения и значения индекса HOМА [14, 15]. Различные медицинские сообщества и организации рекомендуют женщинам с ГСД употреблять ежедневно минимум 25–28 г клетчатки, что примерно эквивалентно 600 г фруктов и овощей в день (из них минимум 300 г должны составлять овощи); при этом особый акцент делается на необходимости присутствия в рационе грубых и волокнистых овощей, а также хлеба из муки грубого помола, макарон и риса [14].
Институт медицины (IОМ) рекомендует беременным ежедневно получать минимум 175 г углеводов для обеспечения нормального роста, развития и функционирования мозга плода. Предпочтение следует отдавать крахмалистым продуктам с низким гликемическим индексом и естественным высоким содержанием пищевых волокон (овощам, бобовым, фруктам и цельным зернам) [14, 16]. В метаанализе 6 рандомизированных контролируемых исследований было показано, что у женщин с ГСД на диете с низким гликемическим индексом (ГИ) значительно снижается постпрандиальная гликемия через 2 ч, при этом существенно не меняются уровень глюкозы натощак, гликированный гемоглобин, потребность в инсулине, масса тела ребенка при рождении, риск макросомии [14, 17].
Farabi S.S. et al. в 2019 г. обнаружили потенциальную связь между диетой с низким ГИ и снижением риска макросомии вследствие уменьшения вариабельности колебания уровней глюкозы [18].
В ряде исследований продемонстрировано, что употребление продуктов с высоким содержанием углеводов (фруктов, картофеля, некоторых напитков) во время беременности может быть ассоциировано с риском развития ГСД. В то же время потребление фруктов до беременности не было связано с увеличением риска этого заболевания [19]. Более высокая частота употребления картофеля увеличивала вероятность возникновения ГСД, при этом замена двух порций картофеля в неделю на другие виды овощей, бобовых или цельнозерновых продуктов приводила к снижению риска ГСД на 9, 10 и 17% соответственно [19].
Важно помнить, что значительное ограничение углеводов в рационе влечет за собой увеличение потребления жира, что может вызывать повышение уровня жирных кислот в крови, усиление ИР, а затем повышенное накопление жира у плода и ожирение у младенцев [14, 16]. Высокое потребление насыщенных жиров может нарушать передачу сигналов инсулина, а также приводить к воспалению и эндотелиальной дисфункции, которые выступают патогенными факторами при ГСД. Аминокислоты могут выступать в качестве субстратов для производства глюкозы в печени и играть определенную роль в развитии липотоксичности печени [17].
В 2012 г. Bowers К. et al. в крупном проспективном когортном исследовании диеты до беременности не выявили существенной связи между общим потреблением жиров и риском ГСД, однако отметили более высокую вероятность его развития при большем потреблении пищевого холестерина и животных жиров [20]. Данные исследований насчет оптимального потребления жиров противоречивы. Более высокое потребление животных жиров, холестерина и мононенасыщенных жирных кислот было в значительной степени ассоциировано с повышенной угрозой возникновения ГСД [19].
Особое внимание следует уделить приверженности женщин средиземноморской диете (MedDiet). Так, в работах Assaf-Balut C. et al. в 2018 г и Maged A.M. et al. в 2016 г. установлено, что ежедневное потребление мононенасыщенных жиров (как омега-3, так и омега-6 жирных кислот), витамина D позволяет снизить риск развития ГСД, в то время как избыток насыщенных жиров, сахарозы значительно его повышает. Соблюдение принципов MedDiet может снизить вероятность ГСД за счет улучшения системного окислительного стресса [21, 22].
Также в работе Assaf-Balut C. et al. в 2017 г. было показано, что прогнозируемая вероятность ГСД может быть снижена в 2 раза при снижении потребления пищевых жиров на 10% и увеличении потребления углеводов на те же 10% [23]. Полученные данные свидетельствуют о возможности уменьшения как частоты развития ГСД, так и нескольких нежелательных явлений со стороны матери и плода с помощью раннего умеренного диетического вмешательства, основанного на добавлении в диету мононесасыщенных жирных кислот за счет оливкового масла первого отжима и орехов (фисташек) [21, 23].
Необходимо отметить более низкую частоту развития ГСД среди женщин, получавших ранние рекомендации по образу жизни и особенностям диеты, относительно женщин, получавших только общие консультации. Среди женщин с ожирением (или избыточной массой тела) сочетание индивидуальной диеты с умеренно интенсивной физической активностью снижали частоту возникновения ГСД за счет значительного улучшения привычек питания [24].
Принимая во внимание изложенные выше принципы питания, а также патогенетические особенности развития разных подтипов ГСД и их фенотипические проявления, изучение особенностей фактического потребления основных групп продуктов беременными кажется нам важным. Это позволит изучить профили питания беременных и, возможно, в будущем даст основу для работ по выявлению корреляций между фактическими особенностями питания и развитием различных подтипов ГСД.
Цель исследования – оценка особенностей питания пациенток с различными подтипами ГСД.
МАТЕРИАЛ И МЕТОДЫ
Исследование проводилось на базе кафедры внутренних болезней № 3 и НИИ акушерства и педиатрии ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России.
С целью оценки особенностей питания пациенток с различными подтипами ГСД обследовано 130 беременных в возрасте 18 лет и старше вне зависимости от наличия факторов риска ГСД.
В исследование не включались беременные, прибегшие к проведению вспомогательных репродуктивных технологий, страдавшие любыми нарушениями углеводного обмена до беременности, принимающие сахароснижающие препараты.
Для реализации поставленной цели были сформированы группы пациенток в зависимости от преобладающего патогенетического механизма ГСД. Наличие ИР и дисфункции β-клеток оценивались по данным индекса Matsuda. При индексе Matsuda менее 50-го процентиля значения беременных без ГСД говорили о превалировании процессов ИР, более 50-го процентиля – о дисфункции β-клеток [26–29]. Таким образом, были сформированы 3 группы: группа I – 45 беременных с ГСД и дисфункцией β-клеток, группа II – 43 беременные с ГСД и ИР, группа III – 42 беременных без ГСД (контроль).
Известно, что питание, сбалансированное по макро- и микронутриентному составу благотворно влияет на течение всех обменных процессов, способствуя поддержанию нормогликемии [25].
В ходе настоящего исследовали был изучен фактический состав питания пациенток, для чего нами была составлена анкета, отображающая потребление основных групп продуктов (табл. 1).
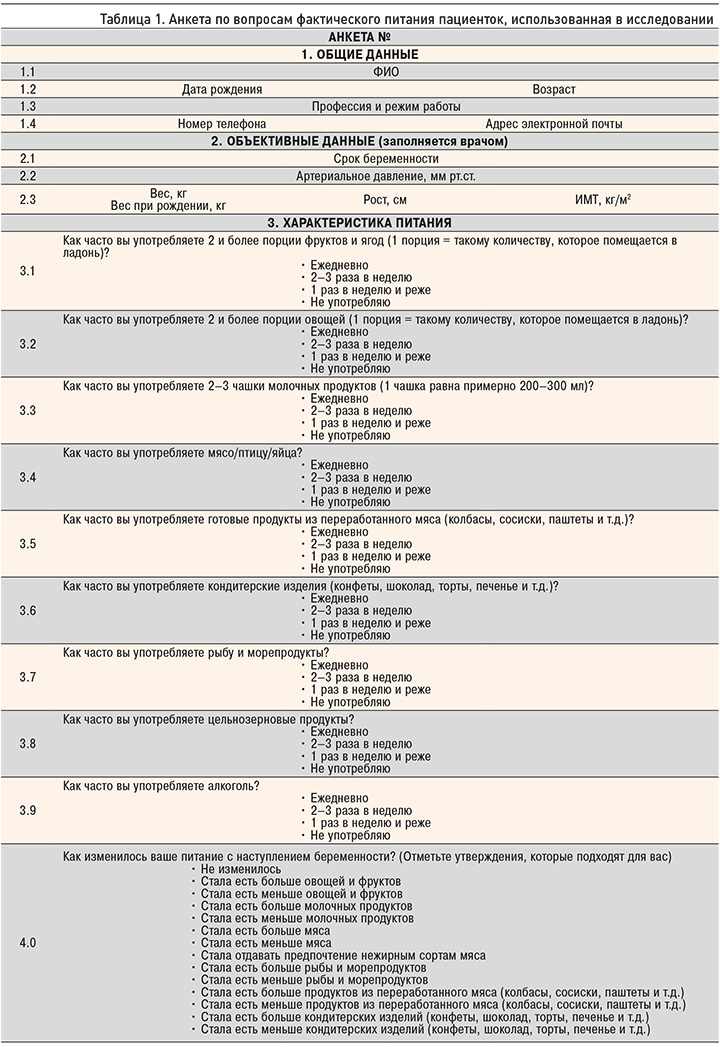
Всем женщинам было проведено полное клиническое обследование, включавшее сбор жалоб и анамнеза, осмотр. Определялись динамика веса во время беременности, артериальное давление (АД) по стандартной методике, изучался наследственный анамнез (I и II степень родства), был собран анамнез предыдущих родов.
Углеводный обмен для подтверждения ГСД оценивался посредством исследования глюкозы венозной плазмы натощак, перорального глюкозотолерантного теста (ПГТТ) с 75 г глюкозы с дополнительным определением значений инсулина натощак и после нагрузки.
Статистический анализ результатов исследования осуществлялся с использованием программы R (версия 3.2, R Foundation for Statistical Computing, Vienna, Austria). Сравнение количественных показателей в группах выполнялось при помощи теста Краскала–Уоллиса (попарные апостериорные сравнения – с помощью метода Неменьи), частот – посредством точного теста Фишера с поправкой на множественные сравнения по Холму. Данные считались статистически значимыми при р <0,05. Данные приведены в виде медиан и интерквартильных интервалов количественных показателей в группах.
РЕЗУЛЬТАТЫ
В ходе исследования проанализировано фактическое питание беременных в выделенных группах. Были выявлены значимые различия по потреблению некоторых групп продуктов. Сравнительная характеристика ежедневного употребления различных групп продуктов представлена в таблице 2.

В группе II значимо большее количество беременных относительно группы III употребляло ежедневно 2 и более порций фруктов и ягод: 29 (67%) против 22 (52%) человек (р=0,03). При этом различия между группами I и II выявлены не были. Следовательно, беременные с различными подтипами ГСД одинаково часто в своем рационе употребляют 2 и более порций фруктов и ягод. При этом беременные с ГСД и ИР чаще едят фрукты и ягоды относительно здоровых беременных.
Обследуемые группы III относительно групп I и II значительно реже употребляли в рационе 2 и более порций овощей: 21 (50%) против 27 (60%) и против 32 (74%) человек соответственно (в обоих случаях р=0,02). При этом данные между группами I и II были схожими.
Таким образом, можно говорить о том, что фактический рацион беременных с различными подтипами ГСД содержит достаточное количество овощей и более обогащен относительно рациона здоровых беременных. Потребление овощей среди беременных с различными подтипами ГСД одинаково и значимо больше, чем у беременных без нарушения углеводного обмена. Потребление молочных продуктов беременными во всех группах было сопоставимым.
Множественные различия между группами были обнаружены при оценке фактического потребления мясных продуктов (мясо/птицы/яиц). Так, в группе I указанные продукты получало меньшее количество женщин относительно групп II и III: 12 (27%) против 33 (77%) и против 26 (62%) человек соответственно (в обоих случаях р=0,001). Кроме того, большее количество беременных в группе II по сравнению с группой III ежедневно употребляло мясные продукты: 33 (77%) против 26 (62%) человек (р=0,007). При этом частота потребления продуктов из переработанного мяса среди беременных всех групп оказалась схожей, а в группе I составила 0%.
Полученные данные могут указывать на то, что большее количество беременных с ГСД и ИР относительно беременных с дисфункцией β-клетки, а также здоровых женщин ежедневно употребляет мясные продукты. Наименьшее количество беременных, ежедневно включающих в свой рацион мясо/птицу/рыбу, оказалось среди больных ГСД с дисфункцией β-клетки.
Кондитерские изделия употребляло большее количество пациенток группы II относительно группы I: 14 (33%) против 4 (9%) человек (р=0,04). Иные различия по этому параметру обнаружены не были. Таким образом, среди разных подтипов ГСД потребление кондитерских изделий чаще встречается у беременных с ИР, при этом рацион здоровых беременных и женщин с разными подтипами ГСД схож.
Различий в потреблении рыбы и морепродуктов среди обследованных всех групп установлено не было.
Цельнозерновые продукты ежедневно употреб-ляли 12 (27%) беременных группы I, что было достоверно выше аналогичного показателя в группе II (6 (14%), р=0,03) и сравнимо с группой контроля. При этом фактические рационы беременных групп II и III были сопоставимы.
Учитывая представленные данные можно утверждать, что большее количество беременных с ГСД и дисфункцией β-клеток относительно беременных с ГСД и ИР ежедневно употребляет цельнозерновые продукты. При этом количество здоровых беременных, ежедневно употребляющих цельнозерновые продукты, схоже с таковым у беременных с разными подтипами ГСД. Таким образом, различие по этому параметру выявлено только между беременными с различными подтипами ГСД.
Кроме изучения фактического рациона, у всех пациенток были проанализированы изменения, произошедшие в питании с наступлением беременности. Соответствующие данные представлены в таблице 2.
Потребление фруктов, овощей, рыбы, продуктов из переработанного мяса у женщин до и во время беременности в группах I, II, III не изменилось. Различия между самими группами также выявлены не были.
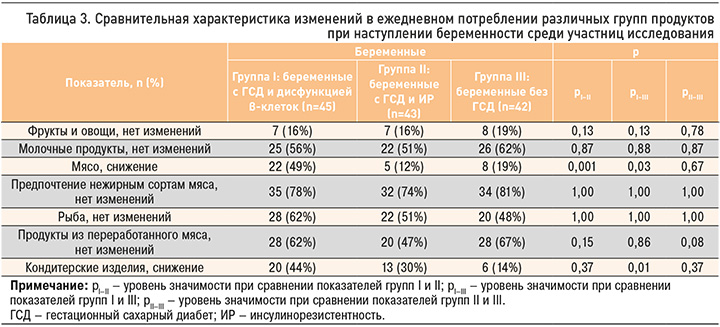
У пациенток группы I с наступлением беременности значительно снизилось потребление мяса относительно группы II и контроля: 22 (49%) против 5 (12%) и против 8 (19%) человек соответственно (р=0,001 в первом случае и р=0,003 во втором). Иные различия по этому параметру установлены не были. Вкусовые предпочтения нежирных сортов мяса сохранились у беременных всех групп вне зависимости от наличия и отсутствия ГСД.
Полученные результаты демонстрируют, что с наступлением беременности количество женщин с ГСД и дисфункцией β-клеток, ежедневно употребляющих мясо, снизилось. В то же время вкусовые предпочтения среди беременных с ГСД и ИР, а также среди здоровых лиц остались прежними.
У схожего количества беременных групп I, II ежедневное употребление кондитерских изделий осталось на прежнем уровне. При этом было выявлено различие по этому показателю между пациентками групп I и III – 20 (44%) против 6 (14%) человек (р=0,1). Эти данные указывают на отсутствие изменений в потреблении кондитерских изделий при наступлении беременности как у женщин с различными подтипами ГСД, так и у здоровых.
ОБСУЖДЕНИЕ
В целом результаты нашего исследования свидетельствуют, что питание беременных пациенток значительно различалось во всех группах. Так, по сравнению со здоровыми беременными достоверно большее количество беременных с ГСД и ИР ежедневно употребляет более 2 порций фруктов и ягод (29 (67%) против 22 (52%) человек, р=0,03) и свыше 2 порций овощей (32 (74%) против 21 (50%) человек, р=0,02). Также среди беременных с этим подтипом ГСД больше женщин, употребляющих мясо, птицу и яйца: 33 (77%) против 26 (62%) человек (р=0,007).
В то же время среди беременных с ГСД и дисфункцией β-клеток по сравнению со здоровыми беременными отмечена более высокая доля женщин, принимающих более 2 порций овощей в сутки (27 (60%) против 21 (50%) человек, р=0,02), и меньшее количество женщин, употребляющих мясо, птицу и яйца (12 (27%) против 26 (62%) человек, р=0,001).
При сравнении особенностей питания у беременных с разными подтипами ГСД обращает на себя внимание тот факт, что пациентки с ГСД и ИР относительно беременных с ГСД и дисфункцией β-клеток ежедневно употребляют больше мяса, птицы и яиц (33 (77%) против 12 (27%) человек, р=0,001), кондитерских изделий (14 (33%) против 4 (9%) человек, р=0,04) и меньше – цельнозерновых продуктов (6 (14%) против 12 (27%) человек, р=0,04), что дополнительно способствует прогрессированию ИР.
Если говорить об изменении питания после наступления беременности, то можно отметить значительное снижение приема мяса, птицы и яиц у беременных с ГСД и дисфункцией β-клеток относительно пациенток с ГСД и ИР (22 (49%) против 5 (12%) человек, р=0,001) и здоровых беременных (22 (49%) против 8 (19%) человек, р=0,003). Но наиболее важным аспектом видится уменьшение употребления кондитерских изделий у беременных с ГСД и дисфункцией β-клеток относительно пациенток с ГСД и ИР (20 (44%) против 6 (14%) человек, р=0,1), что также не может не сказываться на прогрессировании ИР.
ЗАКЛЮЧЕНИЕ
В настоящее время определение различных подтипов ГСД может иметь крайне важное клиническое значение, поскольку от механизмов, лежащих в основе патогенеза нарушений углеводного обмена, может зависеть выбор тактики и своевременность назначения лечения и, как следствие, улучшение прогноза пациенток. Выявление особенностей рациона женщин с разными подтипами ГСД – важное звено в понимании процессов, приводящих к развитию гипергликемии в период беременности.
Нами изучено фактическое потребление беременными различных групп продуктов, а также изменения в питании, произошедшие с наступлением беременности. Представленные результаты говорят о том, что рационы беременных с различными подтипами ГСД во многом схожи, однако существуют и некоторые различия в этом плане, которые могут оказывать влияние на развитие данных подтипов заболевания и требовать определенных мер коррекции в процессе лечения таких пациенток.



