ВВЕДЕНИЕ
Сахарный диабет (СД) остается одним из самых распространенных неинфекционных заболеваний в мире, в том числе у пациенток женского пола. Если в 2019 г. им страдали 223 млн женщин во всем мире, то к 2045 г. это число, по прогнозам, может достичь 343 млн (Diabetes Atlas, 2019). Крайне серьезной проблемой видится широкая распространенность различных форм гипергликемии во время беременности, до 84% из которых связаны именно с гестационным диабетом. Так, гипергликемия была выявлена у 20 млн беременных женщин, что составляет 16% живорождений. Таким образом, каждые 6-е роды происходят от беременности, протекавшей на фоне гестационного сахарного диабета [1].
Гестационный сахарный диабет (ГСД) – заболевание, которое характеризуется гипергликемией, впервые выявленной в период беременности, но при этом не соответствующей критериям манифестного диабета [2]. McIntyre H. et al. в своей работе указывают следующие факторы риска развития ГСД: избыточный вес и ожирение матери, поздний возраст при рождении ребенка, ранее перенесенный ГСД, отягощенную наследственность по СД 2-го типа, этническую принадлежность [3].
ГСД представляет серьезную угрозу здоровью матери и плода ввиду его высокой ассоциации с развитием преэклампсии, рождением крупного плода, родовыми травмами, неонатальной гипогликемией и мертворождением [4]. Помимо этого, ГСД выступает фактором риска развития ожирения, СД 2-го типа и сердечно-сосудистых заболеваний у матери и потомства в будущем [1, 4]. Таким образом, ГСД является актуальной проблемой современной медицины.
Методы терапии ГСД направлены прежде всего на предотвращение чрезмерного роста плода и развитие других осложнений. Среди них выделяют немедикаментозные методы, включающие модификацию образа жизни (коррекция диеты, увеличение физической нагрузки, контроль за набором веса), а также выполнение регулярного самоконтроля гликемии. Помимо этого, до 30% беременных с ГСД требуется терапия определенными видами инсулина, разрешенными к применению при беременности. Однако такой вид терапии может причинять пациенткам ряд неудобств, связанных со снижением качества жизни из-за страха перед иглами, стоимостью лечения, а главное, с риском развития гипогликемий [2, 3]. Вопрос выбора терапии ГСД решается в каждом случае индивидуально в зависимости от целого ряда условий.
Один из факторов, определяющих эффективность немедикаментозной терапии и необходимость фармакологической коррекции ГСД, может быть связан с патофизиологическими аспектами формирования гипергликемии в период беременности. Опираясь на предположение, что дефект секреции инсулина или чувствительности к нему служат основными факторами развития СД 2-го типа у небеременных людей, так и, по всей вероятности, ГСД у беременных, выделены различные подтипы ГСД. Powe C. et al. в своем исследовании (2016) на группе беременных женщин (809 человек) показали, что в основе ГСД могут лежат как дефекты секреции инсулина при нормальной чувствительности к нему (1/3 женщин), так и дефекты чувствительности к инсулину с гиперинсулинемией. Более того, пациентки с преобладающей инсулинорезистентностью (ИР) имели измененный профиль адипокинов, более крупных детей при рождении, более высокий риск ГСД-ассоциированных осложнений даже в сравнении с женщинами с нормальной толерантностью к глюкозе (НТГ). У женщин с ГСД на фоне дефекта секреции инсулина показатели индекса массы тела (ИМТ), глюкозы натощак, массы тела ребенка при рождении и риск осложнений были схожи с аналогичными показателями у беременных с нормальным углеводным обменом [6].
В 2018 г. Liu Y. et al. в ходе изучения влияний различных подтипов ГСД на перинатальные исходы выделили 3 подтипа ГСД: с преобладанием дисфункции β-клеток, с преобладанием ИР и смешанный тип (оба признака выражены равнозначно). Было установлено, что женщины, страдающие ГСД с сочетанием дисфункции β-клеток и ИР, характеризуются наибольшей частотой неблагоприятных перинатальных исходов [7].
Схожие данные были получены в исследовании Feghali M. et al. (2019). В нем ГСД был установлен у 33 из 111 обследованных женщин. В зависимости от преобладания ИР, дефекта β-клеток или сочетания этих факторов были выделены соответствующие типы ГСД. У женщин, имевших ГСД с комбинацией ИР и дефекта β-клеток, относительно женщин с нормальным углеводным обменом были выявлены более высокий ИМТ до беременности, уровень глюкозы крови, рождение крупного ребенка и большая частота встречаемости ГСД-ассоциированных осложнений, включая неблагоприятные неонатальные исходы [8].
В проспективное когортное исследование, выполненное Benhalima K. et al. в 2019 г., вошли 1813 беременных женщин. В зависимости от выраженности ИР были определены подтипы ГСД и показано, что у женщин, страдающих ГСД с высокой ИР, наблюдаются более неблагоприятный метаболический профиль, более высокие степени гипергликемии, ИМТ, значения артериального давления, уровни липидов и более высокий риск неблагоприятных исходов беременности, чем у женщин с НТГ и женщин с ГСД и меньшей ИР. Кроме того, женщины с ГСД и выраженной ИР имели более высокую степень гипергликемии как на ранних, так и поздних сроках беременности, по сравнению с женщинами с меньшей резистентностью к инсулину [9].
Опираясь на данные исследований последних лет, можно говорить о различных подтипах ГСД, исходя из преобладания дефекта β-клеток, ИР или комбинации этих факторов. При этом разные подтипы ГСД имеют различные фенотипы и риски неблагоприятных исходов беременности. Так, у женщин с ГСД и преобладающей ИР наблюдалась значительно большая частота кесарева сечения и рождения крупных младенцев, относительно женщин с НТГ [6]. Помимо этого, ГСД может быть ассоциирован с повышением частоты преждевременных родов, индукции родов, кесарева сечения, гипогликемии новорожденных, госпитализации в отделение интенсивной терапии относительно женщин с НТГ [9].
Определение различных подтипов ГСД может иметь крайне важное клиническое значение, поскольку от механизмов, лежащих в основе патогенеза нарушений углеводного обмена, может зависеть выбор тактики лечения пациенток и, как следствие, достижение нормогликемии. Учитывая, что различные подтипы ГСД имеют различные фенотипы и риски неблагоприятных исходов беременности, целью исследования стало установление факторов риска развития различных подтипов ГСД.
МАТЕРИАЛ И МЕТОДЫ
Клиническая часть работы была выполнена на базе кафедры внутренних болезней № 3, научно-исследовательского института акушерства и педиатрии ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России.
С целью выявления факторов риска развития различных подтипов ГСД было обследовано 130 беременных в возрасте 18 лет и старше вне зависимости от факторов риска этого заболевания. Все беременные, включенные в исследование, не прибегали к вспомогательным репродуктивным технологиям, не страдали какими-либо нарушениями углеводного обмена до беременности и не принимали сахароснижающие препараты.
Диагноз ГСД подтверждался на основании перорального глюкозотолерантного теста (ПГТТ) с 75 г глюкозы и дополнительной оценки значений инсулина натощак через 1 и 2 ч после нагрузки глюкозой для расчета индексов ИР. Все лабораторные показатели определялись в венозной плазме, индексы – расчетным методом.
Определение подтипа ГСД проводилось по индексу Matsuda [10–13]. При индексе Matsuda менее 50-го процентиля значения беременных без ГСД говорили о превалировании процессов ИР, более 50-го процентиля – о дисфункции β-клеток. В зависимости от преобладающего патогенетического механизма были сформированы следующие группы пациенток:
- группа I – 45 беременных с ГСД и нарушением функции β-клеток;
- группа II – 43 беременных с ГСД и ИР;
- группа III – 42 беременных без ГСД (контрольная группа).
В ходе исследовали были изучены факторы риска, чей вклад в развитие ГСД хорошо известен: избыточный вес и ожирение матери, поздний возраст при рождении ребенка, ранее перенесенный ГСД, отягощенная наследственность по СД 2-го типа, этническая принадлежность [3]. Помимо этого, анализировались другие факторы, которые, по нашему мнению, могут влиять на развитие ГСД. К ним мы отнесли объективные данные, такие как срок беременности, показатели артериального давления (АД), признаки ИР (наличие бархатистых гиперпигментированных бляшек на коже в области шеи, подмышечных впадин или другой локализации – acanthosis nigricans), сведения гинекологического анамнеза и анамнеза предшествующих беременностей и родов. При исследовании анамнеза жизни изучалось наличие различных хронических заболеваний как у женщины, так и ее родственников. При характеристике текущей беременности мы обращали внимание на данные о прегравидарной подготовке и приеме различных витаминов, биологически активных добавок, лекарств. В качестве важного фактора риска ГСД рассматривался образ жизни: характер физической активности (ФА), особенности пищевого рациона. С целью оценки этих факторов была разработана специальная анкета для пациенток.
Статистический анализ результатов исследования проводился с использованием программы R (версия 3.2, R Foundation for Statistical Computing, Vienna, Austria). Сравнение количественных показателей в группах осуществлялось с помощью теста Краскала–Уоллиса (попарные апостериорные сравнения – методом Неменьи), частот – с использованием точного теста Фишера с поправкой на множественные сравнения по Холму. Различия результатов считались статистически значимыми при р <0,05. Данные приведены в виде медиан и интерквартильных интервалов количественных показателей в группах.
Проведение исследования было одобрено локальным независимым этическим комитетом ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России (протокол от 11 марта 2021 г. № 5/21).
РЕЗУЛЬТАТЫ
В ходе анализа факторов риска развития ГСД были установлены значимые различия в возрасте беременных в различных группах исследования. Так, пациентки с ГСД и дефектом β-клеток были значительно моложе беременных с ГСД и ИР: 29 (27; 31) против 32 (29; 35) лет (р=0,02). При этом различий с группой контроля по этому показателю не было. В то же время беременные с ГСД и ИР были значимо старше беременных без ГСД: 32 (29; 35) против 29,5 (25; 33) лет (р=0,009). Сравнительная характеристика объективных данных, гинекологического анамнеза, а также анамнеза предшествующих беременностей и родов в группах исследования представлена в таблице 1.
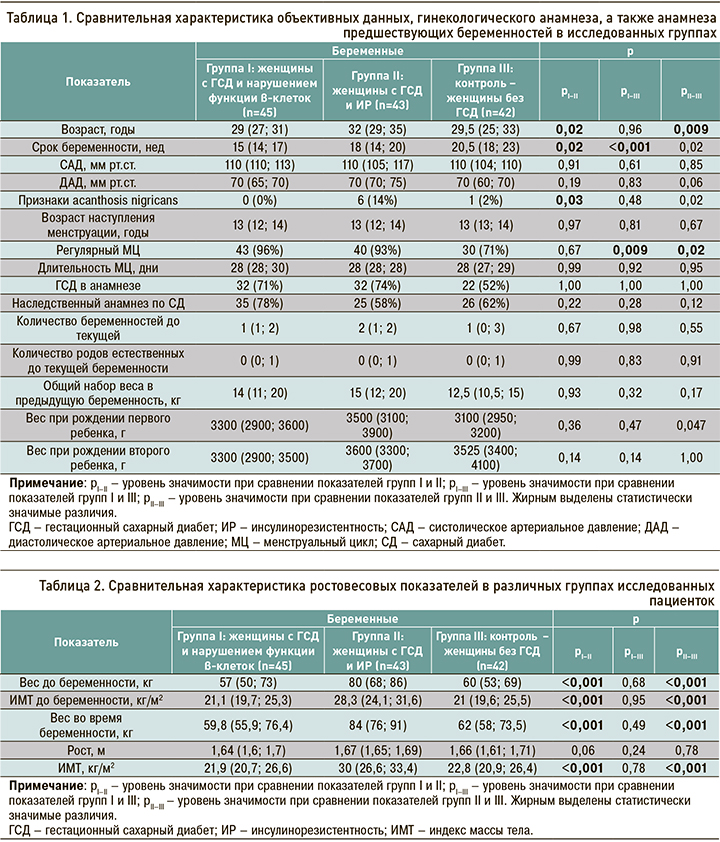
Значимые различия между всеми группами были выявлены в сроке беременности, на котором был диагностирован ГСД. Так, пациентки группы I имели значительно больший срок гестации относительно пациенток группы II (65 (54,2%) против 6 (30%) нед, р=0,02), а также беременных группы III (65 (54,2%) против 8 (57,1%) нед, р <0,001). При этом беременные с ГСД и ИР имели меньший срок гестации относительно беременных без ГСД: 6 (30%) против 8 (57,1%) нед (р=0,02). У 14% беременных с ГСД и ИР были обнаружены признаки acanthosis nigricans, что значимо превышало этот показатель среди беременных с ГСД и дисфункцией β-клеток (р=0,03), но не различалось с показателями в группе беременных без ГСД (р=0,22).
В части признаков, описывающих гинекологический анамнез (возраст наступления менструации и характер менструального цикла, а также количество беременностей и родов до текущей беременности), профили групп различались по одному признаку. Среди беременных без ГСД регулярный менструальный цикл имел место у меньшего количества женщин относительно беременных с ГСД и дисфункцией β-клеток и беременных с ГСД и ИР: 71 против 96% (р=0,009) и 71 против 93% (р=0,02) соответственно. При этом различий в группах беременных с разными подтипами ГСД выявлено не было.
Вес при рождении первого ребенка у пациенток с ГСД и ИР был значимо больше, чем у беременных без ГСД, но значимо не отличался от такового у беременных с ГСД и дисфункцией β-клеток: 3500 (3100; 3900) против 3100 (2950; 3200) г (р=0,047) и против 3300 (2900; 3600) г (р=0,36) соответственно. В то же время вес при рождении первого ребенка в группах беременных ГСД с дисфункцией β-клеток и без ГСД не различались.
Важными в контексте нашего исследования представляются данные, описывающие росто-весовые показатели пациентки как до, так и в ходе текущей беременности (табл. 2).
Между группами I и II были установлены значимые различия в росте до беременности:1,64 (1,6; 1,7) против 1,67 (1,65; 1,69) м (р=0,01). Иных различий по этому показателю выявлено не было. Беременные с ГСД и ИР до наступления беременности имели вес 80 (68; 86) кг, что значимо превышало показатели беременных с ГСД и дисфункцией β-клетки (57 (50; 73) кг, р <0,001), а также беременных без ГСД (60 (53; 69) кг, р <0,001). При этом весовые показатели беременных с ГСД и дисфункцией β-клеток и без ГСД были схожими. Аналогичные различия наблюдались и в отношении показателей ИМТ по группам.
В ходе исследуемой беременности вес в группе беременных с ГСД и ИР достиг 84 (76; 91) кг, что превысило показатели беременных ГСД и дисфункцией β-клеток (59,8 (55,9; 76,4) кг, р <0,001), а также беременных без ГСД (62 (58; 73,5) кг, р <0,001). Весовые показатели беременных с ГСД и дисфункцией β-клеток и без ГСД были схожими.
Принимая во внимание характер профиля веса, аналогичные изменения были установлены по ИМТ до и во время беременности. В группе пациенток с ГСД и ИР до беременности этот показатель составлял 28,3 (24,1; 31,6) кг/м2 и возрос до 30 (26,6; 33,4) кг/м2 к моменту верификации ГСД, что было значимо больше аналогичных значений в группе беременных с ГСД и дисфункцией β-клеток (21,1 (19,7; 25,3) и 21,9 (20,7; 26,6) кг/м2 соответственно, р <0,001 в обоих случаях), а также в группе женщин без ГСД (21 (19,6; 25,5) и 22,8 (20,9; 26,4) кг/м2 соответственно, р <0,001 в обоих случаях). При этом профили веса и ИМТ как до, так во время беременности среди женщин с ГСД с дисфункцией β-клеток и без ГСД были схожими.
Отдельно изучались анамнез жизни и наследственный анамнез пациенток. Исследуемые пациентки всех групп имели схожие профили по признакам наличия хронических заболеваний, наследственному отягощенному анамнезу по ожирению, нарушениям углеводного обмена, сердечно-сосудистым, аутоиммунным и онкологическим заболеваниям.
При анализе признаков, описывающих текущую беременность, были обнаружены различия между группами в части прегравидарной подготовки (табл. 3). Среди беременных без ГСД прегравидарная подготовка была проведена у 9% женщин, что оказалось значимо меньше показателей как среди беременных с ГСД и дисфункцией β-клеток (47%, р=0,03), так и с ГСД и ИР (33%, р=0,03). При этом в различных группах беременных с ГСД значимых различий по данному показателю отмечено не было. Подавляющее большинство беременных из всех групп на момент включения в исследование принимают или принимали во время текущей беременности витамины, биодобавки, лекарственные препараты. Профили показателей, отражающих прием поливитаминов, прогестерона, препаратов железа, колекальциферола, калия йодида, ацетилсалициловой кислоты, были схожими в исследованных группах. Вместе с тем беременные с ГСД и дисфункцией β-клеток чаще принимали фолиевую кислоту, чем беременные с ГСД и ИР (56 против 16%, р <0,001).
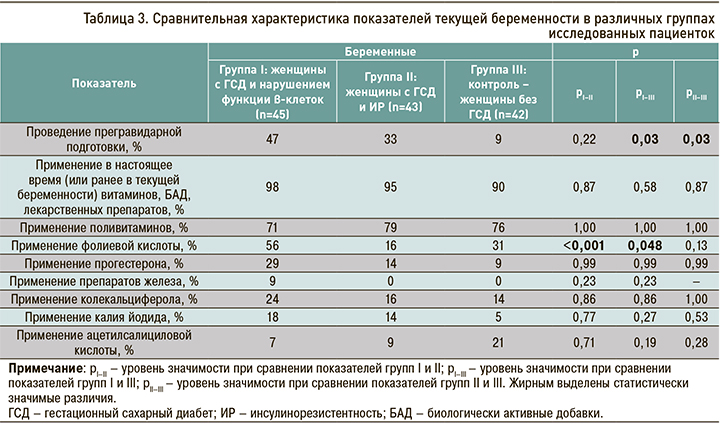
Данные, описывающие такой важный фактора риска ГСД, как физическая активность, представлены в таблице 4. Беременные с ГСД и дисфункцией β-клеток до гравидарного периода имели большую физическую активность относительно беременных с ГСД и ИР и беременных без ГСД, тогда как у беременных с ГСД и ИР и без ГСД значения этого параметра были схожи. Частота низкой физической активности до наступления текущей беременности у пациенток группы I была статистически значимо меньше, чем в группах II и III: 42 против 63% (р=0,001) и против 47% (р=0,02) соответственно. В период текущей беременности схожий процент низкой физической активности был установлен во всех группах. Таким образом, низкая физическая активность встречалась одинаково часто среди беременных как с разными подтипами ГСД, так и без ГСД.
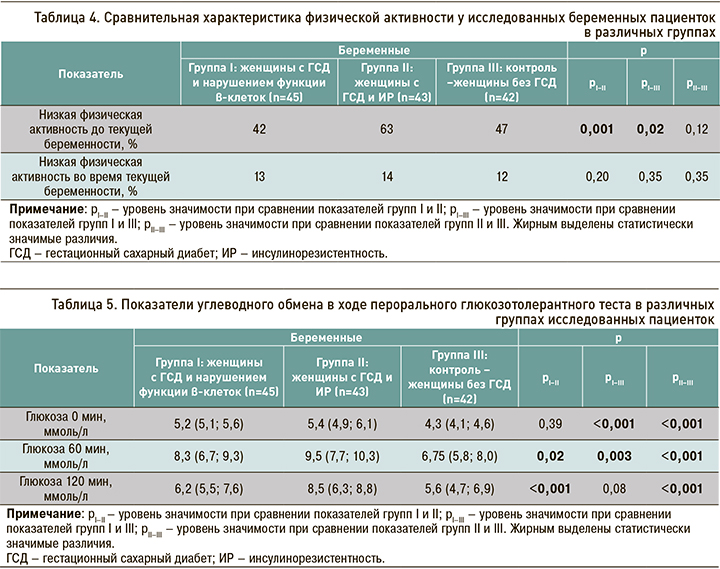
Также нами изучались особенности питания беременных в различных группах. Соответствующие результаты планируется представить в дальнейших публикациях.
У всех беременных оценивалось состояние углеводного обмена (табл. 5). В группах были обнаружены значимые изменения углеводного обмена в ходе ПГТТ, а также уровней гликолизированного гемоглобина (НbА1с). Так, у беременных без ГСД показатели гликемии натощак были ниже, чем у беременных с ГСД и дисфункцией β-клеток (4,3 (4,1; 4,6) против 5,2 (5,1; 5,6) ммоль/л, р <0,001) и беременных с ГСД и ИР (4,3 (4,1; 4,6) против 5,4 (4,9; 6,1) ммоль/л, р <0,001). Показатели гликемии в ходе ПГТТ гликемии натощак, через 60 и 120 мин, уровень НbА1с у беременных с ГСД и ИР значимо превышали аналогичные показатели у беременных без ГСД (р <0,001). Вместе с тем у беременных с ГСД и дисфункцией β-клеток и беременных без ГСД оказались схожими значения глюкозы крови через 120 мин после нагрузки: 6,2 (5,5; 7,6) против 5,6 (4,7; 6,9) ммоль/л (р=0,08).
Между различными группами беременных с ГСД профили показателей углеводного обмена различались по нескольким параметрам. Для беременных с ГСД и ИР относительно беременных c ГСД и дисфункцией β-клеток были характерны более высокие значения глюкозы через 60 мин – 9,5 (7,7; 10,3) против 8,3 (6,7; 9,3) ммоль/л (р=0,02), а также через 120 мин после нагрузки глюкозой – 8,5 (6,3; 8,8) против 6,2 (5,5; 7,6) ммоль/л (р <0,001).
Таким образом, в ходе исследования были выявлены различия как между группами беременных с ГСД и беременных без ГСД, так и среди групп пациенток с различными подтипами ГСД. Так, беременные с ИР относительно беременных с дисфункцией β-клетки были старше, имели меньший срок гестации в момент верификации ГСД, что может говорить о более раннем дебюте этого заболевания.
Кроме того, беременные с ГСД и ИР имели больший вес и ИМТ относительно беременных с ГСД и дисфункцией β-клеток и беременных без ГСД, как перед наступлением беременности, так во время нее. При этом у беременных с ГСД и дисфункцией β-клеток и без ГСД были схожие показатели веса и ИМТ. Среди беременных с ГСД и ИР чаще, чем у беременных с ГСД и дисфункцией β-клеток, отмечались клинические признаки ИР, однако различий по этому параметру с беременными без ГСД не наблюдалось. Указанные изменения еще раз подчеркивают ведущую роль массы тела и ее избытка в формировании ИР. Весьма интересным видится тот факт, что нарушение менструального цикла среди беременных ГСД встречалось чаще, чем среди беременных с различными подтипами ГСД. При этом у беременных с ГСД с ИР и дисфункцией β-клетки подобные различия выявлены не были.
Беременные с ГСД и дисфункцией β-клеток и с ГСД и ИР одинаково часто выполняли прегравидарную подготовку. При этом фолиевую кислоту беременные с ГСД и дисфункцией β-клеток принимали значительно чаще беременных с ГСД и ИР. Физическая активность до гравидарного периода у беременных с ГСД и дисфункцией β-клеток была выше, чем у беременных как с ГСД и ИР, так и без ГСД. При этом беременные последних двух групп имели схожую интенсивность физической активности.
Повышение гликемии после нагрузки 75 г глюкозы было более значимо выражено в группе беременных с ГСД и ИР относительно как беременных без ГСД, так и беременных с ГСД и дисфункцией β-клеток. При этом профили гликемии натощак, а также уровни НbА1с среди беременных с разными подтипами ГСД были схожими.
ОБСУЖДЕНИЕ
Полученные результаты продемонстрировали, что не все общеизвестные факторы риска свойственны для различных подтипов ГСД. Так, для беременных с ГДС и ИР (группа II) характерен более старший возраст при наступлении беременности (32 (29; 35) лет, р=0,009) и более высокая масса тела (84 (76; 91) кг, р <0.001). С другой стороны, пациентки с ГСД и дисфункцией β-клеток (группа I) имели более молодой возраст (29 (27; 31) лет; р=0,02], меньшей массой тела (59,8 (55,9; 76,4) кг, р <0,001) и ИМТ (21,9 (20,7; 26,6) кг/м2, р <0,001).
В то же время среди факторов риска ГСД, которые мы изучали дополнительно, у беременных группы I (ГСД с дисфункцией β-клеток) имели место такие характеристики, как отсутствие регулярного менструального цикла до наступления беременности (93%, р=0,02) и более частое применение фолиевой кислоты (р=0,048).
У беременных группы II (ГСД с ИР) были выявлены следующие факторы риска ГСД: верификации ГСД на малом сроке беременности, признаки acanthosis nigricans (14%, р=0,03), высокий вес первого ребенка при рождении (р=0,047), более редкий прием фолиевой кислоты (р <0,001), низкая физическая активность до наступления беременности (р <0,001).
Следует добавить, что среди факторов риска, которые мы изучали дополнительно, один встречался при обоих подтипах ГСД. Им оказалось отсутствие прегравидарной подготовки (p=0,03).
ЗАКЛЮЧЕНИЕ
В настоящее время определение различных подтипов ГСД может иметь крайне важное клиническое значение, поскольку от механизмов, лежащих в основе патогенеза нарушений углеводного обмена, может зависеть выбор тактики и своевременность назначения лечения и, как следствие, улучшение прогноза пациенток. Выявление факторов риска развития различных подтипов ГСД – важное звено в понимании процессов, приводящих к гипергликемии во время беременности.
Нами были изучены известные факторы риска ГСД, а также факторы, которые потенциально могут вызывать развитие гипергликемии при беременности. Выяснилось, что, помимо влияния возраста и массы тела пациентки до беременности, немаловажный вклад в развитие различных подтипов ГСД оказывает низкая физическая активность и отсутствие прегравидарной подготовки.
Поиск и анализ новых факторов риска развития ГСД могут быть ценными для последующей диагностики и назначения своевременного эффективного лечения, что позволит улучшить прогноз как матери, так и ребенка.



