ВВЕДЕНИЕ
Известно, что грипп, являясь наиболее серьезным заболеванием среди ОРВИ, вызывает значительные негативные последствия у людей из так называемых групп риска [1]. Ежегодная сезонная вакцинация является эффективным способом профилактики гриппозной инфекции. Обязательной вакцинации по рекомендациям ВОЗ подлежат в том числе и лица с иммунодефицитными состояниями [2]. Одной из групп риска развития тяжелых и осложненных форм гриппа и летальных исходов являются ВИЧ-инфицированные лица [3].
В литературе широко освещены исследования по вакцинопрофилактике гриппа у ВИЧ-инфицированных. В целом доказана высокая клиническая безопасность и переносимость гриппозных вакцин, не отличающаяся от таковой у здоровых лиц [4]. Оценка вирусологической безопасности показала возможное, но редкое и транзиторное повышение вирусной нагрузки ВИЧ в плазме крови в поствакцинальный период, не сопровождающееся снижением количества CD4-лимфоцитов и клиническими эффектами в течение ВИЧ-инфекции [5]. При этом однозначная оценка эффективности вакцинопрофилактики гриппа у больных ВИЧ-инфекцией затруднительна. Так, в исследованиях разных лет клинический профилактический эффект вакцинации составлял от 30 до 85%. Большинство исследователей отмечают недостаточную иммунологическую эффективность однократной вакцинации: защитные титры антител ВИЧ-инфицированные больные вырабатывают хуже, и титр их снижается быстрее, чем у здоровых лиц. При наличии единодушных международных рекомендаций в пользу необходимости вакцинации ВИЧ-инфицированных пациентов против гриппа тем не менее до настоящего времени не существует однозначного мнения касательно схемы и выбора вакцины. В частности, Австралийским национальным руководством по иммунизации рекомендована двукратная иммунизация ВИЧ-инфицированных против гриппа независимо от возраста [6]. Таким образом, поиск оптимальных средств, схем и сроков вакцинопрофилактики гриппа, позволяющих повысить иммуногенность у больных ВИЧ-инфекцией, определяет вектор исследований в этой области [7, 8].
Ряд национальных и международных ассоциаций по изучению ВИЧ-инфекции сформулировали для своих стран рекомендации по вакцинации ВИЧ-инфицированных от гриппа. Их общий принцип: необходима ежегодная вакцинация инактивированной трех- или четырехвалентной вакциной [9].
В России Национальный календарь профилактических прививок рекомендует вакцинацию детей с 6 мес, подростков и беременных, при этом отсутствуют нормативные документы по вакцинации от гриппа взрослых, больных ВИЧ-инфекцией. Разработка национальных рекомендаций необходима для клинической практики. Первым шагом для этого является исследование безопасности и эффективности вакцинопрофилактики гриппа у взрослых, больных ВИЧ-инфекцией.
Цель исследования: оценить иммуногенность вакцины против гриппа у ВИЧ-инфицированных взрослых, исходно серонегативных к вирусам гриппа.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
На базе Республиканского центра по профилактике и борьбе со СПИДом и инфекционными заболеваниями (Республика Башкирия, г. Уфа) в ноябре 2016 г. провели вакцинацию от гриппа 225 человек. Основную группу составили 175 больных ВИЧ-инфекцией в возрасте от 20 до 70 лет (средний возраст 38 лет) со стадией ВИЧ-инфекции III–IVБ, из них 124 человека получали антиретровирусную терапию (АРВТ). В группу сравнения включили 50 практически здоровых добровольцев в возрасте от 17 до 60 лет (средний возраст 41 год).
С целью вакцинопрофилактики применяли гриппозную тривалентную инактивированную субъединичную вакцину для внутримышечного и подкожного введения. В ее состав входят антигены (гемагглютинин и нейраминидаза), выделенные из очищенных вирусов гриппа типа А и В, выращенных на куриных эмбрионах, и иммуноадъювант без консервантов. Вакцину вводили однократно, одну дозу внутримышечно.
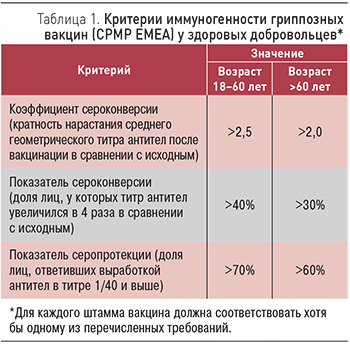 Всем привитым проводили серологические исследования для оценки напряженности иммунного ответа к вирусам гриппа. Применяли стандартную методику определения титров антител в реакции торможения гемагглютинации (РТГА) в соответствии с описанием МУ 3.3.21758–03 [9]. Титры антител определяли до вакцинации (0 день), на 21 и 150 дни после вакцинации. Результаты РТГА оценивали согласно критериям иммуногенности Комитета по патентованным лекарственным препаратам (СРМР ЕМЕА; табл. 1) [11].
Всем привитым проводили серологические исследования для оценки напряженности иммунного ответа к вирусам гриппа. Применяли стандартную методику определения титров антител в реакции торможения гемагглютинации (РТГА) в соответствии с описанием МУ 3.3.21758–03 [9]. Титры антител определяли до вакцинации (0 день), на 21 и 150 дни после вакцинации. Результаты РТГА оценивали согласно критериям иммуногенности Комитета по патентованным лекарственным препаратам (СРМР ЕМЕА; табл. 1) [11].
Согласно цели исследования определили группу привитых, исходно серонегативных к вирусам гриппа (титр антител до введения вакцины (0 день) <1/40), и провели анализ иммуногенности в этой группе вакцинированных.
Протокол исследования и информированное согласие для участников были одобрены Локальным этическим комитетом Республиканского центра по профилактике и борьбе со СПИДом и инфекционными заболеваниями (г. Уфа).
Статистический анализ выполнен в программном обеспечении R (версия 3.4.2, 2017, R Foundation for Statistical Computing, Vienna, Austria). При сравнении титров (дни 0, 21, 150) в основной и контрольной группах в качестве общего теста использовали дисперсионный анализ с повторными измерениями на ранжированных данных (непараметрический аналог стандартного дисперсионного анализа). При этом в модель включали факторы группы, дня и фактор взаимодействия группы и дня. Post hoc сравнения между группами для каждого дня выполняли с помощью теста Манна–Уитни с поправкой Бенджамини–Хочберга на множественность сравнений. Post hoc сравнения дней 21 и 150 с референтным днем 0 выполняли с помощью теста Уилкоксона с поправкой Бенджамини–Хочберга на множественность сравнений. Значимыми считали различия при р<0,05. Доверительные интервалы для геометрического среднего рассчитывали методом бутстрапа (симуляция Монте-Карло) с 1000 повторений.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Серонегативными к вирусу гриппа А (H1N1) до вакцинации оказались 12 больных ВИЧ-инфекцией (7%) и 11 человек из контрольной группы (22%), из них также не показали защитного уровня антител к вирусам гриппа А (H3N2) и В (Brisbane) 3 и 5 пациентов из основной группы и 6 и 10 здоровых соответственно. В контрольной группе еще 2 человека исходно не имели серопротекции к вирусу гриппа В (Brisbane).
Среди ВИЧ-инфицированных было 8 мужчин и 4 женщины в возрасте от 28 до 66 лет (средний возраст 38,5±10,0 лет). У восьмерых была III стадия ВИЧ-инфекции, у трех – IVА и у одного пациента – стадия IVБ. Уровень CD4-лимфоцитов в период исследования составил от 128 до 651 кл/мкл (среднее количество 388,8±176,5 кл/мкл). АРВТ получали 8 больных. У части больных выявили сопутствующую патологию: хронические вирусные гепатиты – у 4 человек, хронические заболевания пищеварительной системы – у 3, хронические заболевания почек, туберкулез в анамнезе и онихомикоз – по одному. Контрольная группа состояла из 4 мужчин и 9 женщин от 19 до 59 лет (средний возраст 42,8±13,2 года).
 Ранний и отдаленный поствакцинальные периоды у привитых протекали гладко, без серьезных нежелательных явлений. Случаи транзиторных местных и общих реакций слабой степени выраженности не потребовали медикаментозной коррекции. В период наблюдения у привитых не было случаев гриппа и острых респираторных вирусных инфекций.
Ранний и отдаленный поствакцинальные периоды у привитых протекали гладко, без серьезных нежелательных явлений. Случаи транзиторных местных и общих реакций слабой степени выраженности не потребовали медикаментозной коррекции. В период наблюдения у привитых не было случаев гриппа и острых респираторных вирусных инфекций.
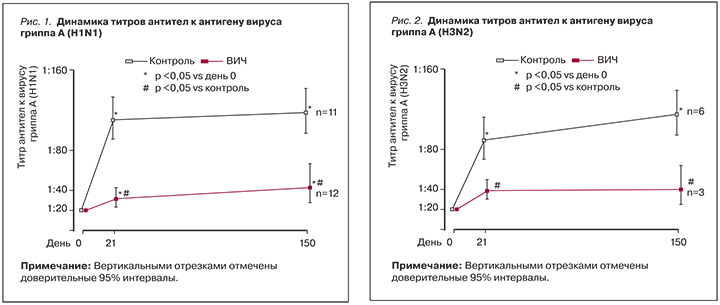
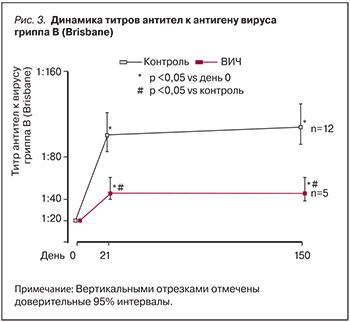
Рисунки 1–3 иллюстрируют динамику титров антител к антигенам вирусов гриппа. Четырехкратный прирост титров антител ко всем трем вакцинальным штаммам вируса гриппа отмечен в группе контроля уже к 21 дню, протективный уровень сохранился до 150 дня наблюдения. Антителогенез у ВИЧ-инфицированных не достиг четырехкратного увеличения титра ни к одному из антигенных вариантов вируса гриппа и в динамике значимо не изменился.
Отмечены значимые различия средних геометрических титров антител (СГТА) здоровых лиц на 21 и 150 дни по сравнению с исходными значениями (табл. 2). У привитых ВИЧ-инфицированных они значимо отличались от исходных СГТА к вирусам гриппа А (H1N1) и В (Brisbane). В группе контроля СГТА для каждого вакцинального варианта вируса гриппа значимо превышали показатели больных ВИЧ-инфекцией в динамике наблюдения.

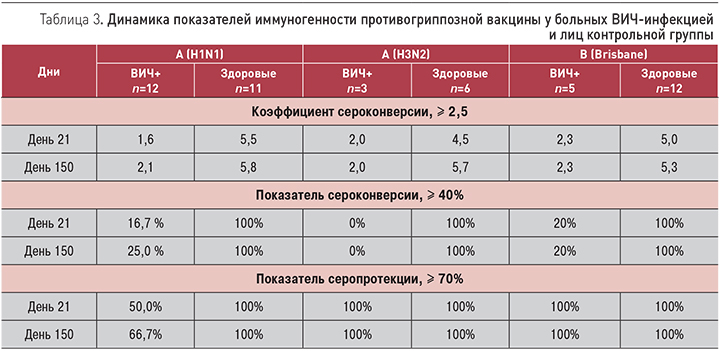
Все показатели иммуногенности в контрольной группе для всех трех вакцинальных штаммов вируса гриппа соответствовали критериям иммуногенности за весь период наблюдения (табл. 3). У ВИЧ-инфицированных привитых показатель серопротекции (выработка антител в титре ≥1/40) был высоким к вирусам гриппа A (H3N2) и B (Brisbane), но не достиг 70% критериального уровня к вирусу A (H1N1). К 150 дню наблюдения снижения значений показателей не произошло.
Анализ динамики титров антител, в зависимости от числа CD4-лимфоцитов в сыворотке крови, показал, что у большинства вакцинированных независимо от количества CD4-лимфоцитов прослеживалась схожая тенденция недостаточной выработки защитного уровня антител. У 5 привитых с числом CD4-лимфоцитов >200 кл/мкл серопротекция к вирусу гриппа A (H1N1) к 21 дню достигла достаточного уровня (титр антител ≥1/40). К этому же сроку четырехкратная сероконверсия произошла у 2 привитых (CD4 >350 кл/мкл) к вирусу гриппа A (H1N1) и у одного больного (CD4 200–350 кл/мкл) к вирусу гриппа В. В динамике наблюдения ни в одном случае снижения напряженности иммунного ответа не произошло.
Таким образом, показатели иммуногенности у ВИЧ-инфицированных лиц, не имевших исходно антител к гриппу, не соответствовали критериям полноценного поствакцинального антителогенеза. При этом период сохранения протективного уровня антител был достаточен для сезонной защиты от гриппа: за весь период наблюдения (150 дней) не зарегистрировано случаев гриппа и острых респираторных инфекций у привитых ВИЧ-инфицированных. У больных с разными стадиями ВИЧ-инфекции отмечен хороший профиль безопасности вакцины.
ЗАКЛЮЧЕНИЕ
Наши данные подтверждают недостаточную эффективность стандартной однократной вакцинации больных ВИЧ-инфекцией. В то же время результаты, полученные на ограниченном количестве исходно серонегативных ВИЧ-инфицированных пациентов, свидетельствуют о том, что даже при низких показателях сероконверсии и кратности прироста титров антител однократная вакцинация приводила к формированию высоких показателей серопротекции к двум из трех вакцинных штаммов, которые сохранялись в течение 5 мес после вакцинации. Безусловно, малое число наблюдений не позволяет нам делать конкретные выводы об эффективности вакцинопрофилактики и формулировать практические рекомендации по вакцинации от гриппа больных ВИЧ-инфекцией. Для этого необходимо продолжить исследования и учитывать данные о меньшей иммуногенности противогриппозных вакцин у ВИЧ-инфицированных. Однако бесспорной в настоящее время остается рекомендация о необходимости проведения вакцинопрофилактики гриппа у больных ВИЧ-инфекцией.



