ВВЕДЕНИЕ
Согласно определению Guilleminault С. (1976), синдром обструктивного апноэ сна (СОАС) – это состояние, характеризующееся наличием храпа, периодическим спадением верхних дыхательных путей на уровне глотки и прекращением легочной вентиляции при сохраняющихся дыхательных усилиях, снижением уровня кислорода крови, грубой фрагментацией сна и избыточной дневной сонливостью [1]. Ряд авторов рассматривает СОАС как наиболее клинически значимое расстройство сна в связи с тем, что это заболевание может значительно ухудшать качество жизни пациента из-за таких симптомов, как избыточная дневная сонливость, храп, снижение внимания, памяти, плохой сон, головные боли [2]. Наличие СОАС без адекватного терапевтического контроля увеличивает медицинские расходы на лечение таких пациентов в первую очередь из-за затрат на лечение сопутствующих сердечно-сосудистых заболеваний, включая артериальную гипертензию (АГ) [3].
По данным систематического обзора Senaratna C. et al. (2017), общая распространенность СОАС в различных странах находится в диапазоне от 9 до 38%, а частота СОАС с показателями индекса апноэ/гипопноэ (ИАГ) не менее 15 событий в час среди взрослого населения варьирует в пределах от 6 до 17%, достигая показателя 49% у пожилых людей [4]. В России, согласно результатам популяционного исследования Хоркиной А. и соавт. (2020), встречаемость клинически значимых среднетяжелых и тяжелых форм СОАС у населения в возрасте 30–70 лет составила 18,1% и ассоциировалась с повышенной распространенностью АГ [5].
Методы лечения дыхательных расстройств сна должны активно применяться у пациентов с СОАС и сопутствующей АГ [6]. Одним из наиболее эффективных методов лечения СОАС является СРАР-терапия [7]. В случае сопутствующей АГ Американская академия медицины сна (AASM) рекомендует применять СРАР-терапию у пациентов с любой степенью тяжести СОАС, отмечая особую необходимость ее использования при наличии у таких пациентов выраженных симптомов дневной сонливости [8]. Данный метод лечения с первых дней может устранить большинство дыхательных нарушений обструктивного генеза у пациентов. Однако, несмотря на высокую эффективность, существуют и достаточно серьезные проблемы с приверженностью к долгосрочному лечению с помощью СРАР-терапии [9].
Уровень приверженности к СРАР-терапии в различных странах может существенно различаться – от 30 до 88% [10, 11]. Проведенный анализ различных факторов, определяющих способность предсказания оптимальной приверженности к СРАР-терапии, не выявил какого-либо общего фактора [12].
Вышеперечисленные обстоятельства обусловливают необходимость поиска новых критериев приверженности к СРАР-терапии и дополнения существующей классификации степени тяжести СОАС для выработки оптимальной тактики лечения каждого конкретного пациента.
Цель исследования – выявить дополнительные критерии приверженности к долгосрочной СРАР-терапии у пациентов с СОАС и АГ.
МАТЕРИАЛ И МЕТОДЫ
Исследование выполнялось в филиале № 8 ФГБУ «Главный военный клинический госпиталь им. академика Н.Н. Бурденко» Минобороны России в пульмонологическом отделении в нештатном сомнологическом кабинете. В исследование включались пациенты с диагностированной ранее АГ любой степени тяжести, избыточным весом различной степени и жалобами на сильный храп. Все участники подписывали добровольное информированное согласие на проведение исследований.
Из исследования исключались пациенты с синдромом центральных апноэ сна, синдромом ожирения – гиповентиляции, нестабильной стенокардией, выраженными психическими расстройствами, с храпом, но без АГ, пациенты, с которыми через 1 год не удалось по различным причинам установить связь.
Всего было обследовано 302 пациента, из которых для исследования отобрано 260 человек.
На начальном этапе всем пациентам выполнялись следующие диагностические процедуры: оценка уровня дневной сонливости с помощью Эпвортского опросника сна; исследование общего анализа крови; исследование биохимических показателей крови (уровень общего холестерина, глюкозы крови утром натощак, креатинина, мочевой кислоты, тиреотропного гормона); эхокардиография (ЭхоКГ). Затем с целью уточнения степени и характера дыхательных расстройств сна всем пациентам проводилось респираторное мониторирование (РМ) в течение 7 ч ночного сна аппаратами Somnea (Compumedics, Австралия).
После выявления у пациентов любой степени тяжести СОАС в качестве лечения предлагалось пройти пробный курс СРАР-терапии.
Согласие на инициацию СРАР-терапии дали 132 (50,8%) пациента – 110 (55,6%) мужчин и 22 (35,5%) женщины. Отказались от инициации СРАР-терапии 128 (49,2%) пациентов – 88 (44,4%) мужчин и 40 (64,5%) женщин.
Инициация СРАР-терапии пациентам проводилась с помощью автоматических аппаратов для СРАР-терапии (Somnobalance E, Wienmann, Германия). Для контроля насыщения крови кислородом на фоне СРАР-терапии применялась мониторинговая компьютерная пульсоксиметрия (МКП) с помощью приборов PulseOx 7500 (SPO medical, Израиль). Для субъективной оценки влияния СРАР-терапии были разработаны 2 визуальные шкалы, применявшиеся до начала и после окончания пробного курса СРАР-терапии: визуальная шкала оценки качества сна (ВиШОКС) и визуальная шкала оценки общего самочувствия пациентом в течение дня (ВиШООС; табл. 1). Визуальные шкалы предполагали 10-балльную оценку пациентом качества своего сна или общего самочувствия в течение дня, где 1 балл соответствовал наиболее плохому показателю, а 10 баллов – наилучшему качеству состояния. После заполнения шкал врачом оценивалась разница между показателями после и до СРАР-терапии.
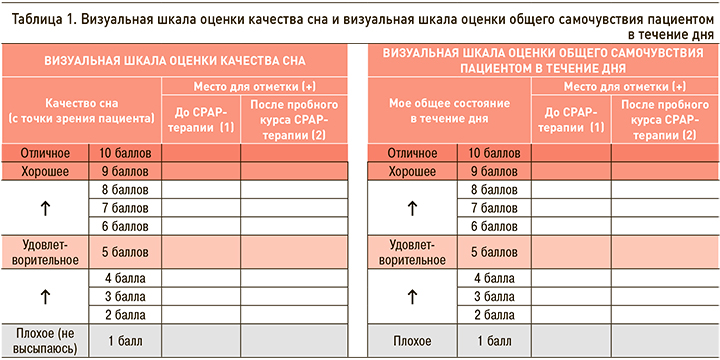
После окончания пробного курса СРАР-терапии в стационаре пациентам давались рекомендации по дальнейшему лечению в домашних условиях. Через 1 год была оценена приверженность к рекомендованному лечению и оценена его эффективность. Пациенты, продолжившие СРАР-терапию в течение 1 года, приглашались на контрольное обследование, во время которого с помощью компьютерных программ считывались данные с приборов для СРАР-терапии.
В соответствии с полученными данными все пациенты были разделены на 3 группы:
- 1-я группа – 56 пациентов, продолживших после выписки СРАР-терапию в течение 1 года в домашних условиях (использование аппаратов в течение года составило 88% [75–93], среднее использование СРАР за ночь – 6 ч [5–6,5]);
- 2-я группа – 76 пациентов, прошедших пробный курс СРАР-терапии, но в дальнейшем не продолживших долгосрочную СРАР-терапию;
- 3-я группа – 128 больных, отказавшихся от пробного курса СРАР-терапии и в дальнейшем не использовавших этот метод лечения.
Материалы исследования были подвергнуты статистической обработке с использованием методов параметрического и непараметрического анализа. Статистический анализ осуществлялся в 3 этапа.
На 1-м этапе сравнивались между собой 3 группы пациентов. Каждая из сравниваемых совокупностей оценивалась на предмет ее соответствия закону нормального распределения с применением критерия Колмогорова–Смирнова. В последующем в случае нормального распределения данных статистическая значимость различия сравниваемых количественных показателей в трех группах фиксировалась при уровне р <0,05 в результате однофакторного дисперсионного анализа. Статистическая значимость в случае распределения данных, отличного от нормального, фиксировалась при уровне р <0,05 с помощью критерия Краскела–Уоллиса. Для формирования дополнительных объективных признаков приверженности по данным РМ применялся RОС-анализ, анализ многопольных таблиц сопряженности и рost-hoc-анализ с поправкой Бенджамини–Хохберга.
На 2-м этапе сравнивались между собой 1-я и 2-я группы исследования с целью обнаружения различий между пациентами, которые проходили пробный курс СРАР-терапии. На основании разработанных шкал ВиШОКС и ВиШООС были выделены субъективные признаки приверженности пациентов к СРАР-терапии. Статистические различия фиксировались с помощью критерия Манна–Уитни. Посредством дискриминантного анализа были выявлены наиболее значимые признаки для прогноза приверженности к лечению.
На 3-м этапе субъективные и объективные признаки приверженности были сгруппированы в дополнительные критерии приверженности к долгосрочной СРАР-терапии (субъективный и объективный). Формирование дополнительного субъективного критерия приверженности осуществлялось на основании дискриминантного анализа. Дополнительный объективный критерий приверженности к СРАР-терапии был выделен в результате статистического анализа многопольных таблиц сопряженности различного сочетания дополнительных объективных признаков приверженности в группах исследования (статистическая значимость устанавливалась при помощи точного критерия Фишера и рost-hoc-анализа при помощи поправки Бенджамини–Хохберга). Затем проводился анализ наличия предложенных дополнительных критериев приверженности в зависимости от степени тяжести СОАС. В результате был сделан вывод о том, что дополнительные критерии приверженности к СРАР-терапии встречаются только при среднетяжелых и тяжелых формах СОАС и одновременно служат дополнительными субъективным и объективным критериями тяжести заболевания. Полученные данные легли в основу формирования модифицированной классификации степени тяжести СОАС по критерию приверженности к СРАР-терапии.
Статистический анализ осуществлялся на персональном компьютере с использованием программы IBM SPSS Statistics 26.
РЕЗУЛЬТАТЫ
Анализ клинико-лабораторных и инструментальных данных пациентов по группам
Клиническая характеристика групп пациентов в зависимости от уровня приверженности к долгосрочной СРАР-терапии представлена в таблице 2.

Для группы приверженных к СРАР-терапии пациентов были характерны мужской пол, более выраженная дневная сонливость по данным опросника Эпворта, большая масса тела. Кроме того, среди них преобладали пациенты с тяжелым СОАС. Из сопутствующих заболеваний у пациентов 1-й группы чаще встречались эпизоды атриовентрикулярной блокады (АВ-блокады) 2 степени в ночное время, сахарный диабет (СД) 2-го типа, хроническая обструктивная болезнь легких (ХОБЛ) и доброкачественная гиперплазия предстательной железы (ДГПЖ). Все пациенты из трех групп были сопоставимы по применяемой антигипертензивной терапии. Из лабораторных показателей в группе приверженных к лечению пациентов чаще отмечалось повышение уровня глюкозы и мочевой кислоты, тогда как статистически значимых различий в показателях общего анализа крови, уровня холестерина, креатинина, тиреотропного гормона выявлено не было. Во всех трех группах фракция выброса левого желудочка (ФВ ЛЖ) была в норме, однако у пациентов 1-й группы отмечена тенденция к снижению этого показателя.
Определение объективного критерия приверженности к долгосрочной СРАР-терапии по данным респираторного мониторирования
При проведении РМ было выявлено, что исследуемые группы различались по следующим признакам, которые обозначены как дополнительные объективные признаки приверженности к долгосрочной СРАР-терапии (табл. 3): № 1 – средняя SрO2; № 2 – минимальная SрO2 на фоне апноэ; № 3 – средняя длительность апноэ; № 4 – максимальная длительность апноэ; № 5 – общая длительность апноэ. По результатам RОС-анализа были получены оптимальные пороговые значения этих признаков, соответствующие точке cut-off (табл. 4).
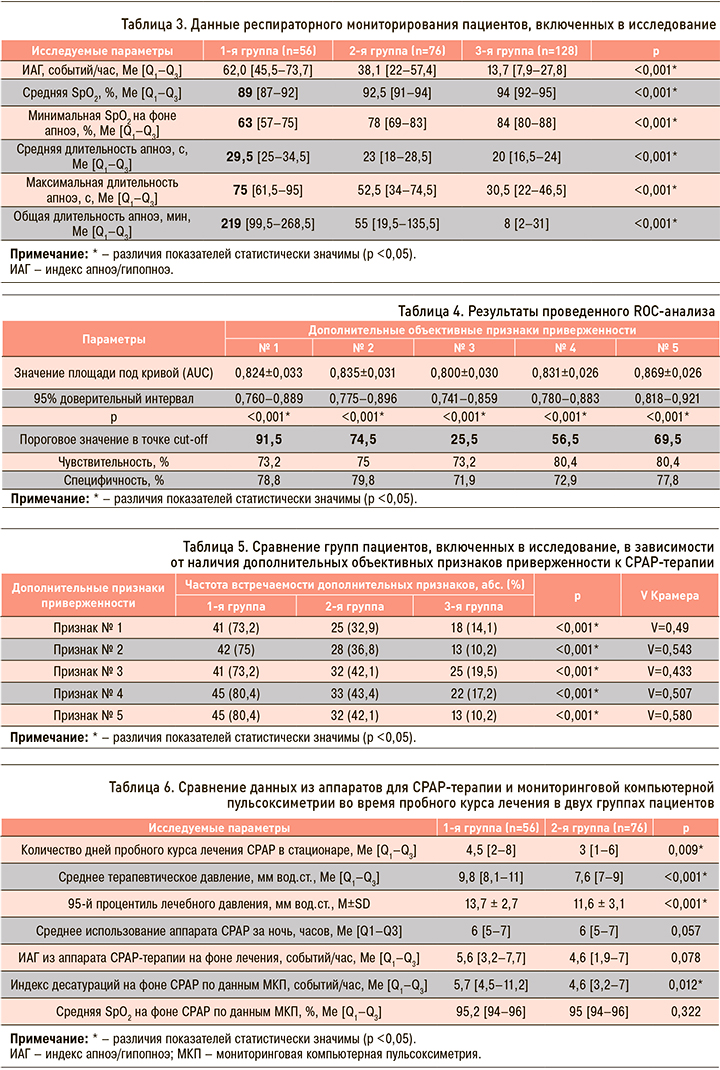
Графические данные RОС-анализа представлены на рисунке 1.
В результате комплексного статистического анализа были получены дополнительные объективные признаки приверженности к СРАР-терапии по данным РМ: признак № 1 – средняя SрO2 ≤91,5%; признак № 2 – минимальная SрO2 на фоне апноэ ≤74,5 %; признак № 3 – средняя длительность апноэ ≥25,5 с; признак № 4 – максимальная длительность апноэ ≥56,5 с; признак № 5 – общая длительность апноэ ≥69,5 мин (табл. 5).
Вместе с тем в реальной практике у каждого конкретного пациента могут встречаться различные сочетания дополнительных объективных признаков, поэтому для клинической работы более практично было бы иметь представление об уровне приверженности пациента к CPAP-терапии в зависимости от различных сочетаний данных признаков. В связи с этим был проведен сравнительный анализ в 1-й и 2-й группах пациентов (т.е. среди пациентов, прошедших пробный курс СРАР-терапии) в зависимости от различного сочетания дополнительных объективных признаков приверженности к терапии по данным респираторного мониторирования (рис. 2).
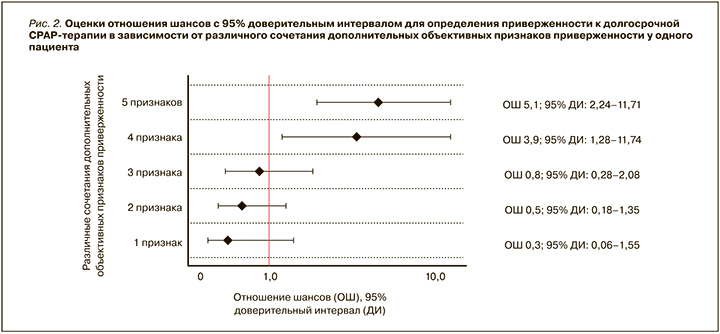
Выявлено, что сочетание у одного пациента 4 любых дополнительных объективных признаков по данным РМ в 3,9 раза достоверно увеличивало шансы долгосрочной СРАР-терапии (отношение шансов (ОШ) 3,9; 95% доверительный интервал (ДИ): 1,28–11,74). При наличии же у пациента всех 5 дополнительных объективных признаков шанс долгосрочного лечения с помощью СРАР-терапии достоверно увеличивался в 5,1 раза (ОШ 5,1; 95% ДИ: 2,24–11,71).
Таким образом, одновременное наличие 4 или 5 дополнительных объективных признаков приверженности к СРАР-терапии по данным РМ было выделено в дополнительный критерий приверженности к СРАР-терапии – объективный.
Анализ данных пробного курса СРАР-терапии и выявление субъективного критерия приверженности к долгосрочной СРАР-терапии по данным визуальных шкал
Для группы пациентов, приверженных к долгосрочному лечению, были характерны более длительный период пробного курса лечения, более высокие цифры терапевтического давления в аппаратах СРАР-терапии. Среднее использование аппаратов за ночь превышало 5 ч, что удовлетворяет установленным требованиям. На фоне терапии данные ИАГ из аппаратов в 1-й и 2-й группах пациентов превышали 10 событий в час, что свидетельствует об удовлетворительном контроле заболевания. Показатели сатурации на фоне терапии также находились в пределах допустимых значений (табл. 6).
Исходно до начала СРАР-терапии всем пациентам был выполнен анализ результатов анкетирования по Шкале сонливости Эпворта. Однако данный опросник не может применяться для оценки динамики состояния пациента при краткосрочных наблюдениях, в связи с чем были разработаны новые визуальные шкалы, позволяющие сделать вывод о субъективном влиянии терапии на самочувствие пациента в течение короткого промежутка времени.
Для прогностической оценки приверженности к долгосрочной СРАР-терапии, исходя из данных опросника Эпворта и параметров таблицы 7, была разработана следующая модель (1):
YСРАР = -1,811 + 0,282×XВиШОКС (2–1) + 0,448×ХВиШООС (2–1), (1),
где YСРАР – дискриминантная функция, характеризующая вероятность долгосрочного использования СРАР-терапии пациентом, который согласился на пробный курс СРАР-терапии; XВиШОКС (2–1) – количество баллов, соответствующее разнице визуальных шкал ВиШОКС-2 и ВиШОКС-1; ХВиШООС (2–1) – количество баллов, соответствующее разнице визуальных шкал ВиШООС-2 и ВиШООС-1.
Значение константы дискриминации составило 0,1725. Принадлежность пациентов к группе с высокой вероятностью долгосрочного использования СРАР-терапии определялась исходя из рассчитанных значений прогностической дискриминантной функции (2): при значении функции более 0,1725 пациенты относились к группе с высокой вероятностью долгосрочного использования СРАР-терапии, при значении функции менее 0,1725 – к группе с низкой вероятностью долгосрочного использования СРАР-терапии. Чувствительность модели равнялась 82,1%, специфичность – 90,8%. Диагностическая эффективность модели составила 87,1%.
Показатель разницы между шкалами ВиШОКС-2 и ВиШОКС-1, а также ВиШООС-2 и ВиШООС-1, равный 4 и более баллов, является прогностическим маркером долгосрочного лечения пациентом в последующем. Наличие этих двух субъективных признаков позволило выделить новый «субъективный» критерий приверженности к СРАР-терапии.
Формирование дополнительных критериев тяжести синдрома обструктивного апноэ сна
Оценить наличие/отсутствие у пациента дополнительных критериев приверженности (субъективного и объективного) возможно только после проведения пробного курса СРАР-терапии. В связи с этим для определения ОШ приверженности к долгосрочному лечению по итогам курса инициации СРАР-терапии в стационаре был выполнен сравнительный анализ пациентов 1-й и 2-й групп (рис. 3).
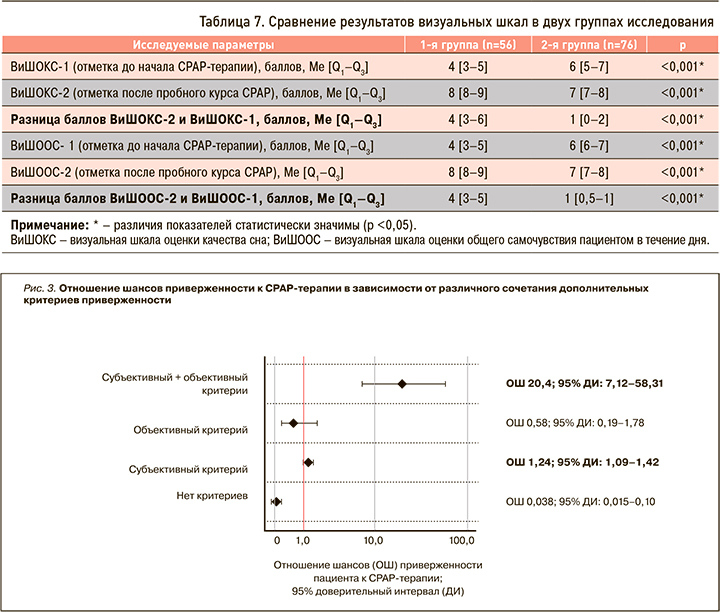
Наличие дополнительного субъективного критерия у пациентов в 1,24 раза увеличивало вероятность долгосрочной приверженности к СРАР-терапии (ОШ 1,24; 95% ДИ: 1,09–1,42). Одновременное же наличие у пациентов субъективного и объективного критериев после пробного курса лечения в 20,4 раза увеличивало вероятность долгосрочной приверженности к СРАР-терапии (ОШ 20,4; 95% ДИ: 7,12–58,31).
При анализе наличия у пациентов дополнительных субъективного и объективного критериев приверженности к СРАР-терапии в зависимости от степени тяжести СОАС было установлено, что субъективный критерий встречался у пациентов со среднетяжелым и тяжелым СОАС, в отличие от больных с СОАС легкой степени, тогда как объективный критерий статистически значимо чаще наблюдался только у пациентов с тяжелым СОАС. Сочетание двух критериев у одного пациента одновременно также было отмечено только при СОАС тяжелой степени (табл. 8).
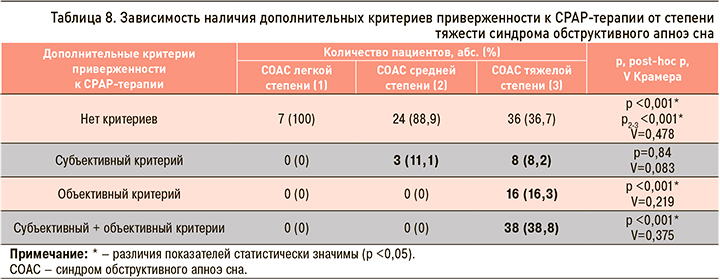
Таким образом, предложенные субъективный и объективный критерии приверженности к долгосрочной СРАР-терапии одновременно служат и дополнительными субъективным и объективным критериями тяжести СОАС.
ОБСУЖДЕНИЕ
Ученые разных стран предпринимают попытки определить факторы, влияющие на приверженность пациентов к СРАР-терапии, чтобы разработать эффективные методики для длительного и частого использования аппаратов СРАР-терапии. В нашем исследовании приверженность к этому методу лечения СОАС в течение 1 года составила 42%.
Анализ результатов показал, что в группе приверженных к терапии пациентов преобладают мужчины, что согласуется со многими зарубежными исследованиями [13, 14]. Средний возраст приверженных к СРАР-терапии пациентов в нашей работе соответствовал пожилому (57,7±10,4 лет), что также сообразуется с данными ряда зарубежных исследований [10, 15]. Уровень избыточной дневной сонливости, определяемый с помощью опросника Эпворта, во многих ранее проведенных исследованиях, как и в нашей работе, был выше у пациентов, остающихся впоследствии приверженными к долгосрочной СРАР-терапии [16, 17]. В исследовании Tsuyumu M. еt al. (2020), изучавшем факторы приверженности к терапии за 10-летний период наблюдения, одним из ведущих таких факторов было значение индекса массы тела (ИМТ) [13]. Результаты нашей работы согласуются с этими данными: в группе приверженных к СРАР- терапии пациентов отмечались статистически значимо более высокие показатели ИМТ.
Пациенты 1-й группы нашего исследования, помимо тяжелого СОАС и АГ, как правило, имели достаточно тяжелую сопутствующую патологию, что подтверждает данные различных исследований о взаимосвязи тяжелого СОАС и СД 2-го типа, нарушений проводимости сердца, а также ХОБЛ [18, 19].
Причина поиска дополнительных признаков приверженности к CPAP-терапии по данным РМ основывается на том факте, что ИАГ в настоящее время требует уточнения и дополнения для более полного представления о продолжительности обструктивных событий и степени снижения насыщения крови кислородом на фоне апноэ [20]. Кроме того, данные приверженности к долгосрочной СРАР-терапии, назначаемой преимущественно на основании показателя ИАГ, демонстрируют низкие значения в большинстве исследований [21].
Недавнее исследование среди скандинавских врачей, назначающих СРАР-терапию, показало, что они считают мотивацию и личное отношение пациентов к СРАР-терапии основными факторами, определяющими долгосрочную приверженность к этому методу лечения [22]. Аналогичные выводы относительно мотивации пациентов как одного из главных факторов приверженности к долгосрочному лечению были получены и в исследовании Baratta F.et al. (2018) [12]. На наш взгляд, одним из главных стимулов к использованию CPAP-терапии для пациента является клиническое улучшение самочувствия на фоне лечения, в связи с чем и были разработаны визуальные шкалы оценки самочувствия.
Выделение дополнительных субъективного и объективного критериев приверженности было проведено впервые для создания на их основе модификации классификации степени тяжести СОАС, которая означала бы более тяжелое течение СОАС с хорошей приверженностью к СРАР- терапии и учитывала бы эти критерии для более рационального подхода к назначению СРАР пациентам.
Для модификации существующей классификации (табл. 9) каждой степени тяжести СОАС был присвоен номер группы (0 – неосложненный храп; I – СОАС легкой степени; II – СОАС средней степени тяжести; III – СОАС тяжелой степени), а при помощи дополнительных критериев приверженности группы с наиболее тяжелым течением (II и III группы) были разделены на подгруппы (подгруппа А – пациенты без дополнительных критериев приверженности; подгруппа В – пациенты с наличием только субъективного или объективного критерия приверженности; подгруппа С – больные с наличием двух критериев приверженности одновременно).
На основании модифицированной классификации предложен новый двухэтапный алгоритм назначения СРАР-терапии пациентам с СОАС и АГ (рис. 4). Он построен на последовательном двухэтапном определении наличия или отсутствия у пациента сначала дополнительного объективного критерия, а затем субъективного критерия приверженности к терапии. По итогам завершения пробного курса СРАР-терапии пациент относится в одну из предложенных подгрупп (А, В или С), после чего принимается решение о целесообразности назначения СРАР-терапии при СОАС.
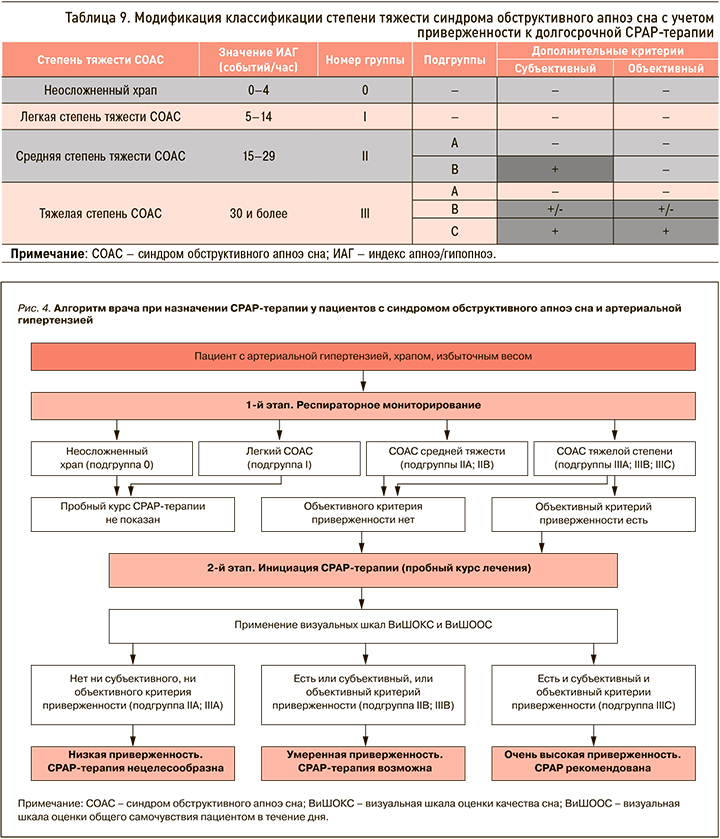
Отсутствие критериев определяет пациента в подгруппу А: таким пациентам рекомендация СРАР-терапии нецелесообразна. У них, равно как и у больных с легким СОАС или неосложненным храпом, рекомендовано рассмотреть консервативные методики либо оперативное лечение при наличии показаний.
Пациентам со средней степенью тяжести СОАС при наличии субъективного критерия, а также больным с тяжелым течением СОАС при наличии субъективного либо объективного критерия (подгруппа В) возможно назначение СРАР-терапии.
Одновременное присутствие у пациента с тяжелым течением СОАС дополнительных субъективного и объективного критериев относит его к подгруппе С. Эта категория больных является самой тяжелой, и им целесообразно настоятельно рекомендовать продолжить СРАР-терапию в домашних условиях. Следует отметить, что больные из IIIС группы в нашем исследовании оказались наиболее приверженными к аппаратному методу лечения СОАС.
ЗАКЛЮЧЕНИЕ
1. Для группы пациентов, приверженных к СРАР-терапии, характерны более частые жалобы на избыточную дневную сонливость, более высокие значения по шкале сонливости Эпворта, более высокие показатели ИМТ, наличие сопутствующего СД 2-го типа, ХОБЛ, АВ-блокады 2 степени в ночное время, ДГПЖ.
2. Для субъективной оценки общего самочувствия и качества сна у больных СОАС разработаны визуальные шкалы, с помощью которых по завершении пробного курса СРАР-терапии можно прогнозировать долгосрочную приверженность к лечению. Разница баллов между визуальными шкалами оценки общего самочувствия и/или оценки качества сна после и до пробного сеанса СРАР-терапии, равная 4 или более баллов, относит пациентов в группу приверженных к СРАР- терапии.
3. Выделены 5 дополнительных объективных признаков приверженности к долгосрочной СРАР- терапии по данным респираторного мониторирования: 1) средняя SрO2 ≤91,5%; 2) минимальная SрO2 на фоне апноэ ≤74,5%; 3) средняя длительность апноэ ≥25,5 с; 4) максимальная длительность апноэ ≥56,5 с; 5) общая длительность апноэ ≥69,5 мин. Сочетание у одного пациента 4 любых дополнительных объективных признаков в 3,9 раза увеличивает шансы долгосрочной СРАР-терапии (ОШ 3,9; 95% ДИ: 1,28–11,74), а при наличии всех 5 дополнительных объективных признаков шанс долгосрочного лечения с применением этого метода увеличивается в 5,1 раза (ОШ 5,1; 95% ДИ: 2,24–11,71).
4. Выделены 2 дополнительных критерия приверженности к долгосрочной СРАР-терапии – субъективный и объективный. Субъективный критерий приверженности – это разница баллов 4 и более между визуальными шкалами оценки качества сна и/или оценки субъективного самочувствия после и до пробного сеанса СРАР-терапии. Объективный критерий приверженности – это одновременное наличие у пациента 4 или 5 дополнительных объективных признаков приверженности к СРАР-терапии по результатам РМ. Наличие только субъективного критерия приверженности определяет пациента в группу со среднетяжелым или тяжелым течением СОАС. Наличие только объективного критерия либо совместное присутствие субъективного и объективного критериев относит больного только в группу с СОАС тяжелой степени.
5. На основании предложенных дополнительных критериев приверженности (объективного и субъективного) модифицирована классификация степени тяжести СОАС в зависимости от приверженности к СРАР-терапии. Выделены подгруппы А и В при средней степени СОАС и А, В, С – при тяжелой степени. Для пациентов подгруппы А приверженность к СРАР-терапии будет низкой. При наличии только объективного критерия также можно прогнозировать низкую приверженность к СРАР-терапии (ОШ 0,58; 0,19–1,78). При выявлении только субъективного критерия приверженность к СРАР-терапии будет умеренной (ОШ 1,24; 95% ДИ: 1,09–1,42). У пациентов подгруппы С (наличие субъективного и объективного критериев) можно ожидать очень высокую приверженность к СРАР-терапии (ОШ 20,4; 95% ДИ: 7,12–58,31).



