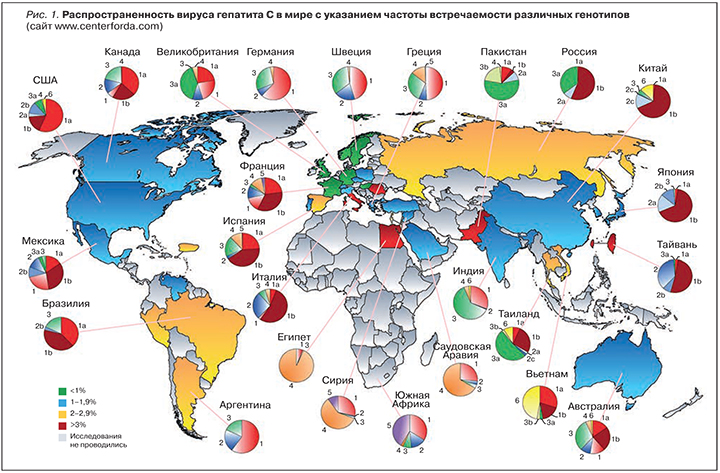
У вируса гепатита С (ГС) выделяют 7 основных генотипов, по-разному распространенных в регионах мира [1]. Первое место по распространенности занимает генотип 1 – на него приходится почти половина всех диагностированных случаев заражения. Он преобладает в Европе, Северной Америке и Австралии. Самый распространенный подтип этого генотипа – 1b, на него приходится до 22% всех случаев заражения. Второй по встречаемости генотип 3 характерен для стран Азии (Индия, Пакистан, Бангладеш и др.) [2]. Третье место делят генотипы 2 и 4 [3]. Эпидемиология хронического ГС (ХГС) представлена на рис. 1.
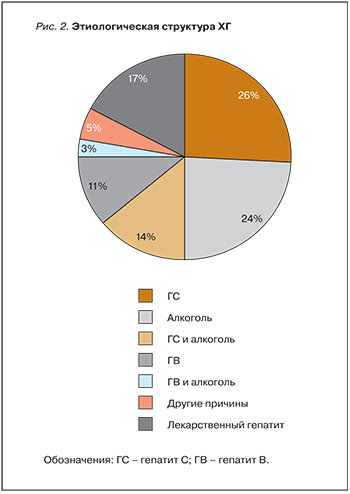
Вирусный ГС занимает лидирующее место в сравнении с алкогольными, лекарственными и другими гепатитами (рис. 2) [4]. Он является одной из основных причин цирроза печени (ЦП) и гепатоцеллюлярной карциномы (ГЦК) во всем мире. Глобальная распространенность вируса ГС (HCV) среди населения составляет 2,8%, что соответствует 185 млн инфицированных [5]. В Европейском союзе смертность, связанная с вирусными гепатитами, приблизительно в 10 раз больше, чем от вируса иммунодефицита человека (ВИЧ). Две трети смертей от вирусных гепатитов связанны с ГС. Аналогичные данные были зарегистрированы в США, где связанная с ГС смертность превысила таковую от ВИЧ в 2007 г. [6].
 В последнее время в России отмечается активизация эпидемической ситуации по ГС. Отмечен рост показателей заболеваемости ХГС с 31,8 случая на 100 тыс. населения в 2005 г. до 39,9 – в 2011 г. [7], часто поражаются лица молодого возраста, имеет место высокий уровень хронизации с возможным исходом в ЦП и ГЦК.
В последнее время в России отмечается активизация эпидемической ситуации по ГС. Отмечен рост показателей заболеваемости ХГС с 31,8 случая на 100 тыс. населения в 2005 г. до 39,9 – в 2011 г. [7], часто поражаются лица молодого возраста, имеет место высокий уровень хронизации с возможным исходом в ЦП и ГЦК.
У 75% пациентов, инфицированных HCV, развивается ХГС. От 20 до 40% пациентов с ХГС страдают ЦП, и у них с частотой 1–4% случаев в год возникает ГЦК. У пациентов с ЦП также отмечаются осложнения портальной гипертензии, которые могут проявляться асцитом, гиперспленизмом и внутренним кровотечением [8].
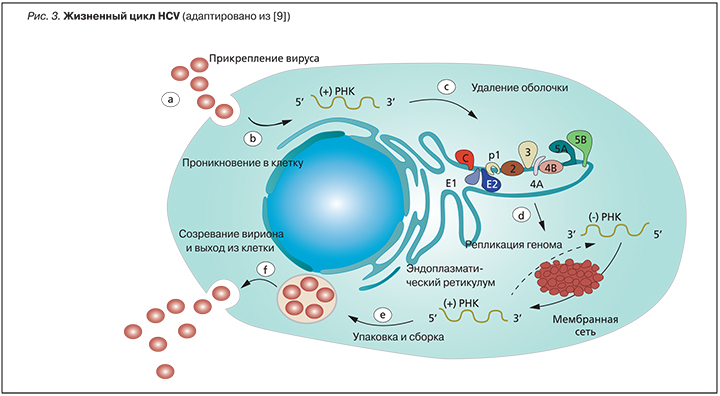
HСV – член семейства флавивирусов. Геном HСV представлен однонитевой РНК протяженностью около 10 000 нуклеотидов. HСV вызывает заболевание только у человека. По внешним параметрам это обычный мелкий сферический вирус, имеющий оболочку. У HСV очень маленький геном, в нем всего один ген, в котором зашифрована структура 9 белков. Эти белки участвуют в проникновении вируса в клетку, создании и сборке вирусных частиц, переключении на себя некоторых функций клетки. Три белка вируса, участвующие в формировании вирусной частицы, называются структурными, остальные шесть белков выполняют разные ферментативные функции и носят название неструктурных. Схематично жизненный цикл HСV представлен на рис. 3.
ДИАГНОСТИКА ГЕПАТИТА С
С целью диагностики ГС и мониторирования HСV-инфицированных пациентов используются следующие лабораторные методы:
- Серологические – определение специфических анти-HСV класса IgG или суммарных IgG и IgМ иммунохимическими методами: ИФА, иммунохемилюминесценция, иммуноблоттинг и т.д. Диагностика проводится с использованием скрининговых и подтверждающих наборов реагентов. В подтверждающем тесте, как правило, проводится определение антител к индивидуальным белкам HСV – core, NS3, NS4, NS5 методом ИФА или иммуноблоттинга.
- Молекулярные – в диагностике ГС используются качественные тесты, позволяющие выявить РНК HСV; количественные тесты, оценивающие степень вирусной нагрузки; генотипирующие тесты, позволяющие определить генотип (субтип) HСV. Основным молекулярно-биологическим методом, используемым в современной диагностике, является ПЦР, в т.ч. ПЦР с гибридизационно-флуоресцентной детекцией в режиме реального времени, которая используется для проведения качественных и количественных тестов.
- Генотипирование HСV, которое должно выполняться всем пациентам до начала противовирусной терапии (ПВТ) в целях планирования ее продолжительности, эффективности, в отдельных случаях – расчета дозы противовирусных препаратов.
- Определение генотипа пациента по совокупности аллельных вариантов однонуклеотидных полиморфизмов rs12979860 и rs8099917 в гене интерлейкина 28В (IL28В), который, по данным проведенных исследований, для пациентов с генотипом 1 HСV служит надежным предиктором достижения устойчивого вирусологического ответа (УВО) на фоне проведения двойной и тройной ПВТ.
Следует отметит, что определение генотипа IL28B потеряло свое прогностическое значение с появлением новых эффективных безинтерефероновых схем терапии. Теперь генотипирование IL28B используется исключительно в тех случаях, когда доступны только пегилированный интерферона-α (PegIFN-α) и рибавирин, или для того, чтобы выбрать экономически выгодные схемы лечения при ограниченных экономических ресурсах.
 Исследование анти-HСV в сыворотке крови должно выполняться лицам из групп риска, а также пациентам с предполагаемым диагнозом острого или хронического ГС. В тех случаях, когда у пациента в сыворотке крови определяются анти-HСV и/или планируется ПВТ, необходимо исследование РНК HСV высокочувствительным методом (рекомендованная диагностическая чувствительность качественного исследования – 50 МЕ/мл и выше). Пациентам с заболеванием печени неуточненной этиологии, даже при отрицательном результате исследования анти-HСV, рекомендуется определение РНК HСV; также этот тест целесообразно выполнять пациентам с иммунодефицитом либо получающим иммуносупрессивную терапию [10].
Исследование анти-HСV в сыворотке крови должно выполняться лицам из групп риска, а также пациентам с предполагаемым диагнозом острого или хронического ГС. В тех случаях, когда у пациента в сыворотке крови определяются анти-HСV и/или планируется ПВТ, необходимо исследование РНК HСV высокочувствительным методом (рекомендованная диагностическая чувствительность качественного исследования – 50 МЕ/мл и выше). Пациентам с заболеванием печени неуточненной этиологии, даже при отрицательном результате исследования анти-HСV, рекомендуется определение РНК HСV; также этот тест целесообразно выполнять пациентам с иммунодефицитом либо получающим иммуносупрессивную терапию [10].
ДИАГНОСТИКА ХРОНИЧЕСКОГО ГЕПАТИТА С [1]
- Определение анти-HСV в крови (скрининговый тест).
- Определение РНК HСV в сыворотке и плазме крови качественным (выявляется ее наличие) и количественным (измеряется уровень виремии) методами. Специфичность используемых тестов достигает 98–99%. Большинство доступных сегодня диагностических тест-систем позволяет определять HСV в количестве более 50 МЕ/мл. Во время ПВТ желательно проводить анализы в одной и той же лаборатории.
- Определение генотипа HСV – общепринятая практика, поскольку от результата этого исследования зависит выбор противовирусных препаратов и продолжительность терапии.
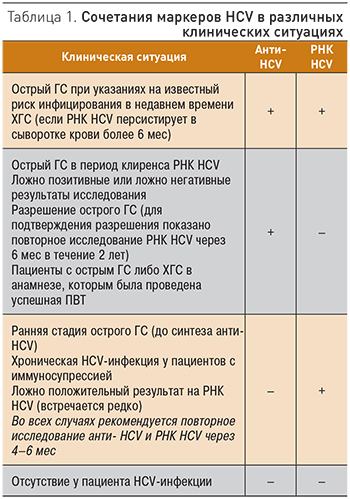
Если у пациента РНК HСV определяется в сыворотке крови на протяжении более 6 мес, можно говорить о ХГС. В том случае, если зарегистрирован положительный тест на анти-HСV, но РНК HСV обнаружить не удалось, оснований для диагноза ХГС недостаточно. Кроме того, нужно помнить о необходимости дифференциального диагноза ХГС с острым ГС, который в 80% случаев протекает в безжелтушной форме. РНК HСV может определяться в крови уже через 2 нед от момента заражения, еще до появления анти-HСV; последние могут не выявляться в течение первых 8–12 нед. Дифференциальный диагноз острого и хронического ГС обязательно должен включать анализ клинических, биохимических и эпидемиологических данных, например наличие симптомов интоксикации и появление желтухи, высокий уровень АЛТ и АСТ, особенно в сочетании с данными о недавнем переливании крови, инъекционном введении наркотических средств или других факторах риска инфицирования. Следует помнить, что анти-HСV и РНК HСV могут выявляться в крови в различных сочетаниях, и это требует дополнительной оценки клинических данных (табл. 1).
 Для формирования окончательного диагноза целесообразно, особенно при выявлении только одного из двух маркеров ХГС, проводить повторное тестирование анти-HСV и РНК HСV.
Для формирования окончательного диагноза целесообразно, особенно при выявлении только одного из двух маркеров ХГС, проводить повторное тестирование анти-HСV и РНК HСV.
Пункционная биопсия печени является «золотым стандартом» диагностики хронического гепатита (ХГ). Перед проведением пункции в течение недели необходимо определить количество тромбоцитов и протромбиновое время либо протромбиновый индекс:
- если количество тромбоцитов ≥90 тыс. в 1 мм3, то манипуляцию можно выполнить рутинным способом (чрескожная слепая биопсия печени);
- если количество тромбоцитов менее указанной цифры, то решение о выполнении биопсии печени принимается в индивидуальном порядке после сопоставления пользы и риска от планируемой манипуляции;
- если протромбиновое время удлинено менее чем на 3 с в сравнении с контрольным значением (предоставляется лабораторией, в которой выполняется исследование образца крови), протромбиновый индекс не менее 70%, тромбиновое время и активированное частичное тромбопластиновое время не превышают 1,5 нормы, биопсию можно проводить чрескожным доступом.
Во всех других случаях решение о выполнении биопсии печени принимается в индивидуальном порядке, взвесив пользу и риск от планируемой манипуляции. В случае необходимости проведения биопсии печени у пациента с гипокоагуляцией или низким количеством тромбоцитов требуется заместительная терапия.
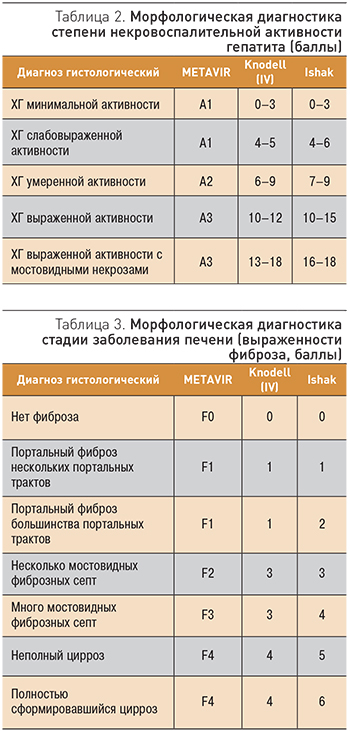
Оценка результатов пункционной биопсии печени проводится с применением полуколичественных шкал описания степени некровоспалительных изменений и стадии фиброза в ткани печени (Knodell, Ishak, METAVIR и т. д.; табл. 2, 3).
КЛИНИКА ГЕПАТИТА С
Обстоятельства, определяющие течение HCV-инфекции:
- бессимптомное течение острой инфекции: пациенты могут не подозревать о наличии у них инфекции и служить невольным источником заражения окружающих;
- прогрессирование в ХГ: более чем у 60% инфицированных вирусом после острой фазы не происходит элиминации вируса и развивается ХГС;
- риск развития ЦП и ГЦК: ХГС является потенциально фатальным заболеванием. Неуклонно прогрессирующее поражение печени протекает часто бессимптомно, проявляясь клинически только на стадии ЦП или ГЦК, когда лечение становится неэффективным.
К факторам риска хронизации HCV-инфекции относятся: посттрансфузионное заражение (попадание большого количества вирусов в отличие от спорадических случаев), парентеральное заражение, массивные гемотрансфузии, тяжелое течение острой инфекции, высокий уровень АЛТ во время острой инфекции, значительные колебания уровня АЛТ во время острой инфекции, выявление анти-HCV. Инкубационный период при НCV-инфекции составляет в среднем около 2-х нед, но может достигать и 26 нед. Острая HCV-инфекция сопровождается желтухой (30% случаев), при этом преджелтушный период у многих больных отсутствует. Характерно изменение уровня печеночных ферментов (АЛТ), которое в целом менее выражено, чем при гепатите В. РНК вируса обнаруживается в сыворотке крови и печеночной ткани очень рано, а продукция антител к неструктурным антигенам HCV является довольно поздней.
В большинстве случаев течение HCV-инфекции является хроническим. Такое течение заболевания наблюдается примерно у 70% пациентов, перенесших острую HCV-инфекцию, но часто ХГС развивается и без предшествующей острой формы. Как правило, заболевание протекает клинически бессимптомно и сопровождается периодическим повышением уровня ферментов (преимущественно АЛТ) и характерными гистологическими изменениями. Степень повышения активности печеночных ферментов при этом не коррелирует с тяжестью повреждения ткани печени. Хроническая НСV-инфекция примерно у 20% больных приводит к развитию ЦП (вероятность цирроза при ГС значительно выше, чем при гепатите В), а у части пациентов – к последующему развитию ГЦК.
При HCV-инфекции наблюдается широкий спектр внепеченочных поражений, условно разделенных на три основные группы: внепеченочные поражения иммунокомплексного генеза (васкулиты различной локализации; кожный васкулит, синдром Рейно, гломерулонефрит, периферическая нейропатия узелковый периартериит и др.); внепеченочные изменения иммуноклеточного и иммунокомплексного генеза (артриты, полимиозиты, синдром Сегрена, фиброзирующий альвеолит и др.); поражения системы крови, в том числе В-клеточная злокачественная лимфопролиферация. Полагают, что лимфотропность HCV (репликация в клетках крови, преимущественно в В-лимфоцитах) обусловливает хроническую стимуляцию В-лимфоцитов и, как следствие, их активацию, повышенную продукцию иммуноглобулинов (различных аутоантител, поли- и моноклонального IgM с активностью ревматоидного фактора) с образованием иммунных комплексов, в т.ч. смешанных криоглобулинов. В развитии внепеченочных поражений обсуждается также роль возможной репликации HCV в различных органах и тканях (помимо печени и кроветворной системы) с развитием цитотоксических Т-клеточных реакций, направленных на антигены вируса, аутоантигены, образовавшиеся вследствие непосредственного повреждающего действия вируса на клеточном уровне.
 В последнее время многие исследователи изучали влияние HCV на сердечно-сосудистые заболевания [11–13]. Имеющиеся данные свидетельствуют о том, что вирус ГС может прямо или косвенно вмешиваться в метаболизм глюкозы и липидов, что приводит к высокой распространенности инсулинорезистентности, гипергликемии, стеатозу печени, висцеральному ожирению и дефициту витамина D. Эти метаболические факторы, а также генетический фон (включая полиморфизмы IFNL3 и PNPLA3) и образ жизни, могут синергетически увеличить риск сердечно-сосудистых заболеваний. Кроме того, хронические воспалительные реакции, связанные с HCV, усиливают накопление железа в печени, что также связано с более высоким риском сердечно-сосудистых заболеваний. Кроме того, есть некоторые доказательства того, что больные ХГС имеют низкий уровень адипонектина и высокие значения фактора некроза опухоли-α и интерлейкина-6 в сыворотке крови. Такие изменения содержания адипонектина, фактора некроза опухоли и интерлейкина-6 приводят к сердечно-сосудистым изменениям. Наличие прямых вирусных механизмов атеросклероза также было предположено в некоторых исследованиях, которые показали прямую связь между вирусной нагрузкой ГС и сосудистыми изменениями, ведущими к заболеваниям коронарной артерии. Применение интерферона и рибавирина для лечения ГС, как представляется, значительно уменьшает риск сердечно-сосудистых заболеваний [11].
В последнее время многие исследователи изучали влияние HCV на сердечно-сосудистые заболевания [11–13]. Имеющиеся данные свидетельствуют о том, что вирус ГС может прямо или косвенно вмешиваться в метаболизм глюкозы и липидов, что приводит к высокой распространенности инсулинорезистентности, гипергликемии, стеатозу печени, висцеральному ожирению и дефициту витамина D. Эти метаболические факторы, а также генетический фон (включая полиморфизмы IFNL3 и PNPLA3) и образ жизни, могут синергетически увеличить риск сердечно-сосудистых заболеваний. Кроме того, хронические воспалительные реакции, связанные с HCV, усиливают накопление железа в печени, что также связано с более высоким риском сердечно-сосудистых заболеваний. Кроме того, есть некоторые доказательства того, что больные ХГС имеют низкий уровень адипонектина и высокие значения фактора некроза опухоли-α и интерлейкина-6 в сыворотке крови. Такие изменения содержания адипонектина, фактора некроза опухоли и интерлейкина-6 приводят к сердечно-сосудистым изменениям. Наличие прямых вирусных механизмов атеросклероза также было предположено в некоторых исследованиях, которые показали прямую связь между вирусной нагрузкой ГС и сосудистыми изменениями, ведущими к заболеваниям коронарной артерии. Применение интерферона и рибавирина для лечения ГС, как представляется, значительно уменьшает риск сердечно-сосудистых заболеваний [11].
ЛЕЧЕНИЕ ГЕПАТИТА С
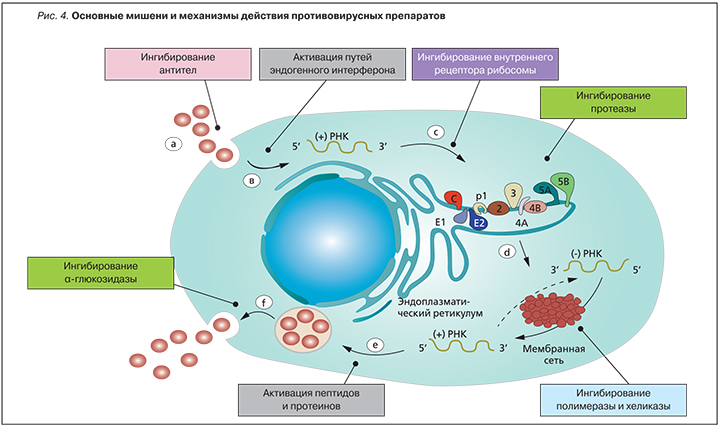
Процессы на основных этапах жизненного цикла HCV являются главными мишенями при разработке препаратов для лечения ХГС (рис. 4):
- Рецепторы для закрепления и входа вируса в гепатоцит могут быть заблокированы ингибиторами входа и антителами нейтрализации. Комплекс рецепторов вируса ГС содержит несколько компонентов, включая факторы закрепления/прикрепления, которые концентрируют вирус на поверхности гепатоцита (например, рецептор липопротеина низкой плотности).
- Непокрытие вируса и вирусный выпуск РНК активирует эндогенные интерфероновые пути.
- РНК в эндоплазматическом ретикулуме активирует врожденный иммунитет. Внутренний вход рибосомы (IRES) действует как система GPS, чтобы направить вирус к эндоплазматическому ретикулуму. Антисенсорные, рибосомальные (heptazyme), siRNA, IRES-eIF3-binding блокаторы – все они являются потенциальными ингибиторами IRES.
- Трансляция и полипротеиновая обработка требуют вирусной протеазы NS3/NS4a и могут быть заблокированы ингибиторами протеазы.
- Транскрипция может быть заблокирована трансляционным торможением (ингибиторы протеазы), ингибицией закрепления РНК и полимеразы к репликационному комплексу (ингибиторы циклофилина), ингибицией полимеразы NS5A/B (ингибиторы полимеразы), а также предотвращением раскручивания шаблона и потомства плюсовой нити РНК (ингибиторы хеликазы).
- Вирусная сборка и экспорт могут быть заблокированы ослаблением гликозилирования (UT-231B, celgosivir) или ингибированием NS5A.
 Основная цель лечения ХГС – полное излечение инфекции. Под УВО понимают неопределяемость РНК HCV через 12 (УВО12) или 24 нед (УВО24) после окончания лечения. Полное излечение наблюдается более чем у 99% пациентов с УВО. Лечение показано всем больным ГС с компенсированным и декомпенсированным хроническим поражением печени, ранее получавшим или не получавшим терапию, готовым получать ее и не имеющим противопоказаний. Поскольку не каждый пациент с ХГС может быть пролечен в течение года, необходимо выделить приоритетные группы (табл. 4).
Основная цель лечения ХГС – полное излечение инфекции. Под УВО понимают неопределяемость РНК HCV через 12 (УВО12) или 24 нед (УВО24) после окончания лечения. Полное излечение наблюдается более чем у 99% пациентов с УВО. Лечение показано всем больным ГС с компенсированным и декомпенсированным хроническим поражением печени, ранее получавшим или не получавшим терапию, готовым получать ее и не имеющим противопоказаний. Поскольку не каждый пациент с ХГС может быть пролечен в течение года, необходимо выделить приоритетные группы (табл. 4).
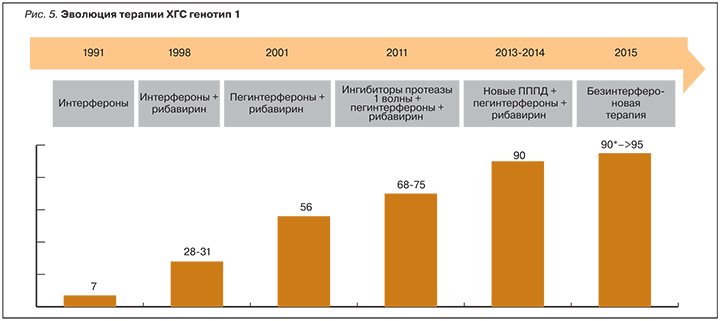
До 2011 г. официально рекомендованным лечением ХГС было применение комбинации PegIFN-α и рибавирина в течение 24 или 48 нед [14]. При этом режиме частота УВО у пациентов с HCV генотипа 1 составляет около 40% в Северной Америке и 50% в Западной Европе. Более высокая частота УВО достигалась у пациентов, инфицированных HCV генотипов 2, 3, 5 и 6 (до 80%, выше для генотипа 2 по сравнению с генотипами 3, 5 и 6). Промежуточное место занимает частота УВО у пациентов с HCV генотипа 4 [15].
РegIFN-α
PegIFN-α2a следует применять в дозе 180 мкг/ нед, а доза PegIFN-α2b зависит от массы тела и составляет 1,5 мкг/кг/нед.
 Противопоказаниями для терапии с применением PegIFN-α являются [16, 17]:
Противопоказаниями для терапии с применением PegIFN-α являются [16, 17]:
- сердечно-сосудистая и легочная патология (сердечная недостаточность, ишемическая болезнь сердца, прогрессирующая стенокардия или острый инфаркт миокарда, тяжелая артериальная гипертензия, хроническая обструктивная болезнь легких);
- трансплантация органов (почка, сердце или легкие);
- сопутствующая патология (неконтролируемая депрессия, биполярное расстройство, судороги; плохо контролируемый диабет; аутоиммунный гепатит или декомпенсация болезни печени; состояния, обостряющиеся при приеме PegIFN-α и рибавирина; заболевания щитовидной железы без терапии; ретинопатия средней/тяжелой степени);
- лабораторные отклонения и осложнения (нейтропения <750/мкл; гемоглобин <10 г/дл или гемоглобинопатия; тромбоцитопения <50 000/мкл; гиперчувствительность);
- беременность (несоблюдение контрацепции) и детский возраст.
Рибавирин
Доза рибавирина составляет 1000 или 1200 мг/ сут в зависимости от массы тела (<75 или ≥75 кг соответственно).
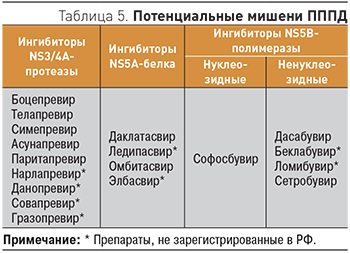
В 2011 г. для лечения инфекции, вызванной HCV генотипа 1, было разрешено применение телапревира и боцепревира. Эти два препарата относятся к противовирусным препаратам прямого действия (ПППД) первой волны первого поколения. Мишенью для обоих препаратов служит сериновая протеаза HCV NS3–4A, поэтому их называют ингибиторами протеазы (табл. 5). И телапревир, и боцепревир следует применять в комбинации с PegIFN-α и рибавирином.
После одобрения в 2014 г. в Европе трех новых ПППД для терапии ХГС широкое применение получили безинтерфероновые схемы лечения (рис. 5). Эти схемы использовались преимущественно для лечения пациентов с тяжелым поражением печени (F3, F4). Комбинация софосбувира и рибавирина показана пациентам с HCV генотипа 2 (12 нед) или 3 (24 нед), у которых она обеспечивает частоту УВО около 80–95%. Применение безинтерфероновой комбинации софосбувира и симепревира с рибавирином или без него основано на результатах небольшого исследования II фазы СOSMOS, в котором ее использовали для лечения пациентов, инфицированных HCV генотипа 1. Частота УВО составила 93–100% [18].
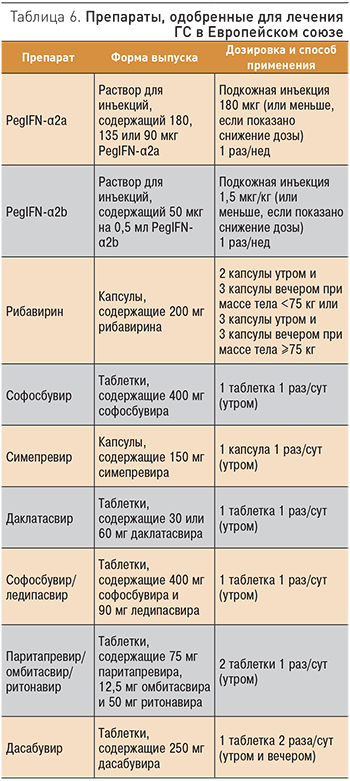
В табл. 6 представлены препараты, которые применяют в ЕС. Здесь перечислены их известные лекарственные взаимодействия. Более подробно лекарственные взаимодействия с наиболее часто используемыми лекарственными препаратами представлены в табл. 8, 9 [19].
Софосбувир следует принимать в дозе 400 мг (1 таблетка) 1 раз/сут. Примерно 80% софосбувира выводятся почками c мочой, 15% – через кишечник. У пациентов с легкой степенью почечной недостаточности системное воздействие софосбувира значимо не меняется, у пациентов с умеренной почечной недостаточностью оно повышается в 2,3 раза. Прием софосбувира в течение 12–14 нед хорошо переносится. Чаще всего (≥20% случаев) при комбинации софосбувира с рибавирином встречались такие нежелательные явления, как головная боль и утомляемость, а при комбинации с PegIFN-α и рибавирином – утомляемость, головная боль, тошнота, бессонница и анемия. Отмечалось также клинически незначимое повышение активности креатинкиназы, амилазы и липазы.
Софосбувир не метаболизируется с участием цитохрома Р450, но переносится Р-гликопротеидом (P-gp). Препараты, являющиеся высокоактивными индукторами P-gp, в значительной степени снижают концентрацию софосбувира в плазме и могут привести к снижению терапевтического эффекта. Поэтому софосбувир не следует принимать совместно с другими известными стимуляторами P-gp: рифампином, карбамазепином, фенитоином или зверобоем. Возможны взаимодействия в комбинации с рифабутином, рифапентином и модафинилом. Сообщений о других значимых лекарственных взаимодействиях, в частности со всеми из исследованных антиретровирусных препаратов, включая эмтрицитабин, тенофовир, рилпивирин, эфавиренз, дарунавир/ритонавир и ралтегравир, не поступало. С остальными антиретровирусными препаратами лекарственных взаимодействий не обнаружено. Совместный прием амиодарона (и, возможно, дронедарона) и софосбувира в комбинации с даклатасвиром, симепревиром или ледипасвиром противопоказан из-за серьезного риска клинически значимой брадикардии (1 сообщение о летальном исходе). Механизм взаимодействия, а также роль других сопутствующих препаратов неизвестны и нуждаются в изучении. Брадикардия наблюдалась от нескольких часов до нескольких дней с момента начала терапии ПППД, однако за данными пациентами наблюдение продолжалось до 2 нед с момента начала лечения гепатита С.
 Софосбувир и ледипасвир доступны в виде комбинированного препарата, содержащего 400 мг софосбувира и 90 мг ледипасвира в одной таблетке. Рекомендуемая доза для приема – 1 таблетка в день независимо от приема пищи.
Софосбувир и ледипасвир доступны в виде комбинированного препарата, содержащего 400 мг софосбувира и 90 мг ледипасвира в одной таблетке. Рекомендуемая доза для приема – 1 таблетка в день независимо от приема пищи.
Основной путь элиминации ледипасвира – выделение с желчью, почечная экскреция минимальна (примерно 1%), тогда как софосбувир, как отмечалось выше, выводится преимущественно почками. Средний период полувыведения софосбувира и его основного метаболита GS-3310007 после приема софосбувира или ледипасвира составляет 0,5 и 27 ч соответственно. Ни один из этих препаратов не является субстратом для транспортеров печеночного захвата; GS-3310007 не является субстратом для транспортеров почечного захвата.
Площадь под фармакокинетической кривой (AUC) ледипасвира у пациентов с тяжелой печеночной недостаточностью и у лиц из контрольной группы с нормальной функцией печени была одинаковой. Популяционный анализ фармакокинетики у HCV-позитивных пациентов показал, что цирроз (в т.ч. декомпенсированный) не оказывает клинически значимого влияния на AUC ледипасвира.
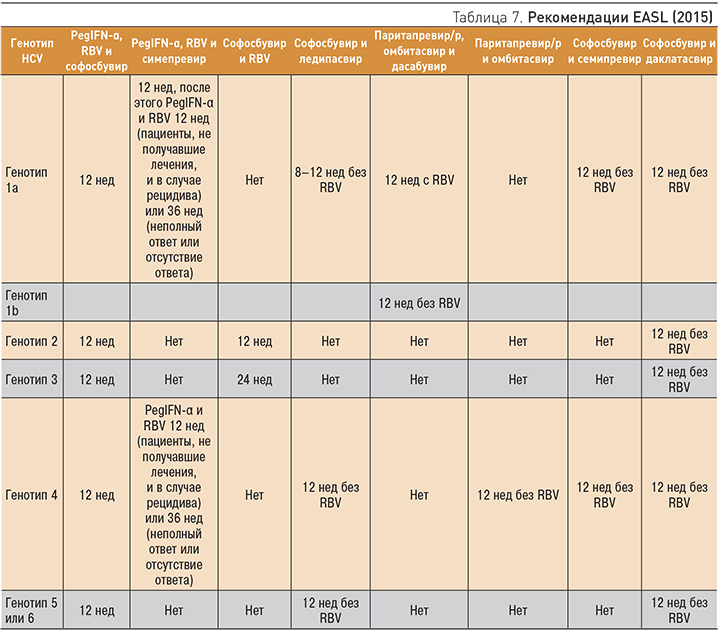
В табл. 7 представлены рекомендации EASL 2015 по моноинфицированным ХГС или ко-инфицированным ВИЧ/ХГС пациентам без цирроза [19].
Даклатасвир следует принимать в дозе 60 мг (1 таблетка) 1 раз/сут или, при необходимости коррекции дозы, 30 мг (1 таблетка) 1 раз/сут. Примерно 90% даклатасвира выводятся с калом (половина – в неизменном виде), менее 10% препарата выделяется с мочой (преимущественно в неизмененном виде).
Среди побочных эффектов даклатасвира чаще всего отмечают утомляемость, головную боль и тошноту. Даклатасвир служит субстратом для CYP3A, а также субстратом и ингибитором P-гликопротеина. Кроме того, он является ингибитором ОАТР1В1 и BCRP. Совместное назначение даклатасвира с препаратами, которые сильно индуцируют CYP3A4 и P-гликопротеин, вследствие чего снижают концентрацию даклатасвира, противопоказано. К ним относятся противосудорожные средства (карбамазепин, фенитоин, окскарбазепин, фенобарбитал), антимикобактериальные препараты (рифампицин, рифабутин, рифапентин), дексаметазон системного действия и зверобой. Сильные ингибиторы CYP3A4 повышают уровень даклатасвира в плазме, вследствие чего рекомендуется коррекция дозы последнего. Если пациент получает антиретровирусную терапию с использованием схем с атазанавиром/ритонавиром и кобицистатом, дозу даклатасвира следует снизить до 30 мг 1 раз/сут. При использовании дарунавира/ритонавира или лопинавира/ритонавира, как показывают результаты недавно выполненных исследований, коррекция дозы даклатасвира не требуется. В исследовании ALLY-2 участвовали ВИЧ-коинфицированные пациенты, получавшие софосбувир и даклатасвир. Установлено, что у больных, которым доза даклатасвира была снижена до 30 мг (на основании исходных данных исследования атазанавира/ритонавира), наблюдалась более низкая частота УВО12, особенно в группе 8-недельной терапии. Это свидетельствует о необходимости применения стандартных доз даклатасвира у пациентов, получающих усиленный ингибитор протеазы. При сочетании с эфавирензом (индуктором микросомальных ферментов печени) рекомендуется увеличить дозу даклатасвира до 90 мг. Из-за недостаточного объема данных нельзя дать аналогичную рекомендацию в случаях применения этравирина и невирапина, также являющихся индукторами микросомальных ферментов печени. Не установлено лекарственного взаимодействия даклатасвира с тенофовиром, эмтрицитабином, абакавиром, ламивудином, зидовудином, ставудином, рилпивирином, ралтегравиром, долутегравиром или маравироком.
 Дозу даклатасвира также следует снизить до 30 мг при сочетании с антибактериальными (кларитромицин, телитромицин, эритромицин) и противогрибковыми (кетоконазол, итраконазол, позаконазол и вориконазол) средствами. Проведены клинические исследования с применением препаратов, подавляющих кислотность желудочного сока (фамотидин, омепразол), эсциталопрама, пероральных контрацептивов без коррекции дозы даклатасвира или принимаемых с ним препаратов. Очевидно, поскольку даклатасвир ингибирует многие транспортные белки, при его использовании совместно с дабигатраном, дигоксином и другими субстратами P-гликопротеина необходимо контролировать возможные проявления соответствующих лекарственных взаимодействий.
Дозу даклатасвира также следует снизить до 30 мг при сочетании с антибактериальными (кларитромицин, телитромицин, эритромицин) и противогрибковыми (кетоконазол, итраконазол, позаконазол и вориконазол) средствами. Проведены клинические исследования с применением препаратов, подавляющих кислотность желудочного сока (фамотидин, омепразол), эсциталопрама, пероральных контрацептивов без коррекции дозы даклатасвира или принимаемых с ним препаратов. Очевидно, поскольку даклатасвир ингибирует многие транспортные белки, при его использовании совместно с дабигатраном, дигоксином и другими субстратами P-гликопротеина необходимо контролировать возможные проявления соответствующих лекарственных взаимодействий.
Рассмотрим схему: усиленный ритонавиром паритапревир + омбитасвир + дасабувир. Паритапревир – ингибитор NS3–4A-протеазы, метаболизируется преимущественно CYP3A4 и применяется в сочетании с низкими дозами ритонавира, который, являясь ингибитором CYP3A4, служит фармакокинетическим усилителем. Это позволяет назначать препарат 1 раз/сут и в более низких дозах, чем требовалось бы без приема ритонавира.
Омбитасвир – ингибитор NS5A. Его применяют в комбинации с фиксированной дозой паритапревира/ритонавира. Рекомендуемая дозировка этой комбинации – 2 таблетки ритонавира/паритапревира/омбитасвира (50 мг/75 мг/12,5 мг в одной таблетке) внутрь 1 раз/сут во время еды. Дасабувир – ненуклеозидный ингибитор РНК-зависимой РНК полимеразы HCV (таблетки по 250 мг). Этот препарат назначают пациентам с HCV генотипа 1 в комбинации с ритонавиром/паритапревиром/омбитасвиром 2 раза/сут.
Паритапревир выделяется преимущественно с калом. Омбитасвир характеризуется линейной кинетикой, также выводится преимущественно с калом. Дасабувир метаболизируется в печени, его основной метаболит выделяется преимущественно с желчью и калом, почечный клиренс незначителен.
Результаты изучения фармакокинетики паритапревира в клинических исследованиях у больных печеночной недостаточностью показали, что у пациентов с тяжелой печеночной недостаточностью (класс С по шкале Чайлда–Пью) значение AUC паритапревира было повышено в 9,5 раза, AUC омбитасвира – снижено на 54%, а AUC дасабувира – увеличено в 3,3 раза. Таким образом, пациентам с легкой степенью печеночной недостаточности (класс А по шкале Чайлда–Пью) не требуется коррекция дозы. Это же верно и для пациентов с умеренной степенью печеночной недостаточности (класс B по шкале Чайлда–Пью). Пациентам с тяжелой степенью печеночной недостаточности (класс С по шкале Чайлда–Пью) данная комбинация противопоказана.
У пациентов с тяжелой почечной недостаточностью (клиренс креатинина 15–29 мл/мин) AUC паритапревира была увеличена на 45%, ритонавира – на 114%, дасабувира – на 50%. Таким образом, согласно имеющимся данным, пациентам с любой степенью почечной недостаточности коррекция дозы паритапревира не требуется. В какой степени паритапревир, омбитасвир и/или дасабувир удаляются при диализе, не известно.
К наиболее частым побочным эффектам комбинации паритапревир/ритонавир + омбитасвир + дасабувир относятся утомляемость и тошнота.
Паритапревир преимущественно метаболизируется CYP3A4, дасабувир – CYP2С8, а омбитасвир подвергается гидролизу. Однако и омбитасвир, и дасабувир могут метаболизироваться CYP3A4. Важную роль в кинетике этих лекарственных средств играют белки-переносчики; паритапревир ингибирует ОАТР1В1/В3, P-гликопротеид и BCRP. Дасабувир и ритонавир также способны ингибировать P-гликопротеид и BCRP.
Метаболический профиль этих препаратов и присутствие в комбинации ритонавира создают предпосылки для множественных лекарственных взаимодействий. Программа по глубокому изучению лекарственных взаимодействий базировалась на данных EMA и Управления по контролю за качеством пищевых продуктов и лекарственных средств США (FDA). Профиль лекарственного взаимодействия следует рассматривать для комбинации в целом (с дасабувиром или без него), поскольку препараты действуют друг на друга.
Ритонавир – сильный ингибитор CYP3A4, поэтому его совместный прием с лекарственными средствами, метаболизирующимися данным ферментом, может характеризоваться значительным повышением их концентрации в плазме. Некоторые препараты противопоказаны в связи с тем, что их повышенная концентрация в плазме может вызывать серьезные побочные эффекты. К их числу относятся алфузосин, амиодарон, астемизол, терфенадин, цизаприд, препараты спорыньи, ловастатин, симвастатин, аторвастатин, мидазолам для приема внутрь, триазолам, кветиапин, хинидин, сальметерол, силденафил, используемый для лечения легочной артериальной гипертензии. Также противопоказаны индукторы ферментов (карбамазепин, фенитоин, фенобарбитал, рифампицин, зверобой, энзалутамид), которые могут отрицательно повлиять на вирусологическую активность препарата, и ингибиторы ферментов (противогрибковые азолы, некоторые макролидные антибиотики), которые могут повышать системное воздействие паритапревира.
В дополнение к выше перечисленным есть много других препаратов, которые требуют осторожного использования и коррекции дозы, чередования по времени приема или дополнительного мониторинга. Лекарственные взаимодействия следует особо учитывать при выборе комплексной терапии при коинфекции HCV и ВИЧ.
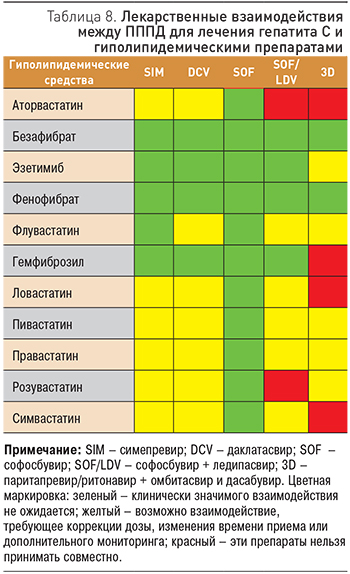
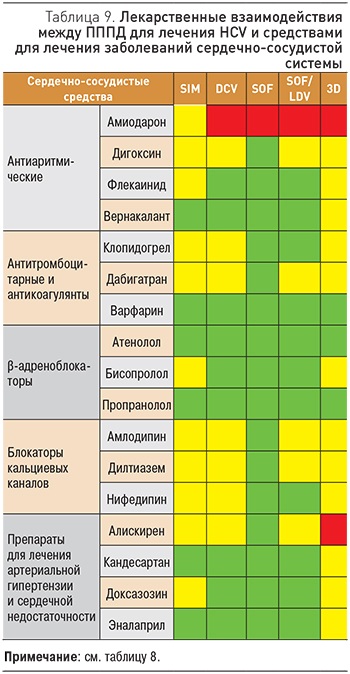
Учитывая возможные лекарственные взаимодействия при лечении ХГС у пациентов с сопутствующими сердечно-сосудистыми заболеваниями, необходимо подбирать лекарственные средства с учетом данных, представленных в табл. 8, 9.



