АКТУАЛЬНОСТЬ ПРОБЛЕМЫ
Хроническая обструктивная болезнь легких (ХОБЛ) – гетерогенное легочное состояние/заболевание с характерными хроническими респираторными симптомами (диспноэ/одышкой, кашлем/мокротой, частыми обострениями) из-за поражения мелких дыхательных путей (бронхит, бронхиолит) и/или альвеол (эмфизема), которое вызывает персистирующую/длительную и часто прогрессирующую обструкцию дыхательных путей [1]. Несмотря на высокую распространенность ХОБЛ в людской популяции (≈11,7%), связанную с ней высокую смертность (≥2,8 млн человек в год – третья причина смерти от любых причин), особенно среди пациентов старше 75 лет, развитие заболевания возможно профилактировать/предотвращать и эффективно контролировать [1–3]. Более того, именно возраст (≥60 лет) считается одним из ключевых факторов риска развития тяжелых обострений ХОБЛ с острой дыхательной недостаточностью (ОДН). Следует признать, что большинство больных ХОБЛ старше 60 лет имеет более двух коморбидных заболеваний, негативно влияющих на прогноз, гериатрический статус и продолжительность жизни таких пациентов.
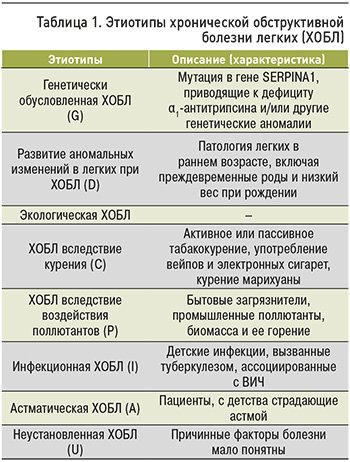
В настоящее время выделяют несколько этиопатогенетических причин развития ХОБЛ (этиотипы болезни), например, взаимодействие генов (G) с окружающей средой (E) в течение жизни человека (T), способствующее повреждению легких и/или нарушению физиологических процессов старения (получившее название GET-номики). К другим факторам, приводящим к формированию ХОБЛ, относятся аномальное развитие легких с ускоренным (преждевременным) старением, табакокурение (активное и пассивное), регулярные ингаляции токсичных частиц и газов, инфекционные процессы, бытовое загрязнение воздуха, экологическое загрязнение среды обитания человека (табл. 1) [1].
Важно отметить, что пожилые пациенты ХОБЛ чаще всего не обращают внимание на симптомы болезни, не осознают ее прогрессирования и поздно обращаются за врачебной помощью. Это связано с их «стремлением к стоицизму», «преодолению ситуации», поскольку изменение качества жизни, нарастание бронхообструкции и ощущение одышки они воспринимают как «старение». Более того, такое восприятие болезни устраняет мотивацию к ежедневной систематической терапии ХОБЛ, что закономерно увеличивает риски развития ее тяжелых обострений со смертельным исходом [2].
ОСОБЕННОСТИ ФУНКЦИОНАЛЬНОЙ ДИАГНОСТИКИ ХОБЛ У ПАЦИЕНТОВ СТАРШЕГО ВОЗРАСТА
Диагноз ХОБЛ рекомендуется устанавливать на основании жалоб и анамнестических данных пациента, результатов функциональных методов обследования и исключения других заболеваний (уровень убедительности рекомендаций – C, уровень достоверности доказательств – 5) [3].
Функциональная диагностика заболевания основана на верификации не полностью обратимого ограничения скорости воздушного потока (отношение объема форсированного выдоха за первую секунду к форсированной жизненной емкостью легких (ОФВ1/ФЖЕЛ) <0,70 после пробы с бронходилататором) в ходе спирометрического обследования. При этом важно, чтобы измерения дыхательных объемов были выполнены в полном соответствии с методическим руководством «Спирометрия: методическое руководство по проведению исследования и интерпретации результатов», поскольку снижение качества измерения ниже категории «А» и «B» делает интерпретацию результатов ошибочной [4].
В ряде случаев, особенно у лиц старшей возрастной группы, могут иметься респираторные симптомы (кашель, мокрота, одышка) и/или структурные поражения легких (например, эмфизема) и/или абнормальные функциональные показатели (сниженный до нижней границы нормы показатель ОФВ1, признаки воздушной ловушки, гиперинфляция легких, сниженная диффузионная способность легких) без ключевого признака – не полностью обратимого ограничения скорости воздушного потока (т.е. ОФВ1/ФЖЕЛ после пробы с броходилататором у этих пациентов ≥0,7). Таких лиц следует рассматривать как пациентов с «пред-ХОБЛ», имеющих высокий риск развития обструкции дыхательных путей с течением времени и нуждающихся в назначении соответствующей симптоматической терапии ХОБЛ.
Отдельную клиническую категорию составляют лица с респираторными симптомами, сниженным ОФВ1 (<80% от должных значений после пробы с броходилататором) без ключевого признака ХОБЛ (ОФВ1/ФЖЕЛ ≥0,70 после пробы с броходилататором), обозначаемые как PRISm-пациенты (от англ. Preserved Ratio Impaired Spirometry – PRISm). В ряде популяционных исследований распространенность таких пациентов, особенно в старшей возрастной группе, колеблется от 7,1 до 20,3%. Более того, среди активных и бывших табакокурильщиков (со стажем ≥10 пачка/лет) старшей возрастной группы (≥60 лет) встречаемость PRISm-пациентов превышает 43% и имеет прямую взаимосвязь с низкими показателями индекса массы тела (ИМТ) и повышенной смертностью от всех причин. Их следует рассматривать как пациентов с начальным ХОБЛ и высоким риском развития не полностью обратимого ограничения скорости воздушного потока с течением времени, нуждающихся в обязательном назначении соответствующей симптоматической терапии ХОБЛ [1].
ОСОБЕННОСТИ ТЕЧЕНИЯ ХОБЛ У ПАЦИЕНТОВ ПОЖИЛОГО И СТАРЧЕСКОГО ВОЗРАСТА
Очевидно, что у пациентов ХОБЛ пожилого и старческого возраста тяжесть и клинические симптомы заболевания напрямую зависят от гериатрического статуса и коморбидной патологии.
ХОБЛ и коморбидность
Установлено, что совокупность факторов GET-номики и «преждевременного старения легкого» приводят к развитию ХОБЛ с сопутствующей коморбидной патологией. Так, по данным исследования Putcha N. et al. (2013), 86–98% пациентов ХОБЛ имеют в среднем от 1,2 до 4,3 сопутствующих заболеваний [5]. Согласно крупному метаанализу Yin H.L. et al. (2017), распространенность коморбидных патологий у пациентов с ХОБЛ в 1,9–2,8 раза выше, чем у лиц, не имеющих этого заболевания [6]. Более того, тяжесть функциональных нарушений у пациентов с ХОБЛ (или тяжесть ХОБЛ) напрямую ассоциирована с количеством коморбидных заболеваний [7].
Некоторые коморбидные патологии, типичные для пациентов с ХОБЛ, приобретают особый «вес» в старшей возрастной группе и требуют пристального клинического внимания, поскольку оказывают негативное влияние на автономность пациента, прогноз заболевания и продолжительность жизни. Патогенетическим обоснованием взаимосвязи ХОБЛ с другими коморбидными заболеваниями является синдром системного воспаления, ассоциированный с возрастом [8].
Коморбидность пациентов с ХОБЛ представлена следующими патологиями [9].
1. Заболевания сердечно-сосудистой системы: ишемическая болезнь сердца, цереброваскулярная болезнь, болезнь периферических артерий, хроническая сердечная недостаточность, легочная гипертензия, аритмии (фибрилляция предсердий и др.), артериальная гипертензия.
2. Заболевания дыхательных путей: бронхиальная астма, обструктивное апноэ во сне, пневмония, фиброз легких.
3. Метаболические нарушения/заболевания: сахарный диабет 2-го типа, дислипидемия и др.
4. Гематологические заболевания/коагулопатии: вторичная полицитемия, анемия, венозный тромбоз и эмболия легочной артерии.
5. Заболевания опорно-двигательного аппарата: саркопения, остеопороз.
6. Заболевания желудочно-кишечного тракта: гастроэзофагеальная рефлюксная болезнь, язвенная болезнь, цирроз печени.
7. Хроническая болезнь почек.
8. Психические заболевания: депрессия, тревога.
9. Онкологические заболевания легких, пищевода, поджелудочной железы, молочных желез.
Сопутствующие заболевания при ХОБЛ негативно сказываются на самооценке пациентами состояния здоровья, а наличие ≥3 коморбидных патологий влияет на качество жизни пациента больше, чем прогрессивное снижение спирометрических показателей [10]. Коморбидные заболевания многократно повышают риски тяжелых обострений у пациентов с ХОБЛ, что увеличивает число госпитализаций, смертность таких пациентов и повышает прямые и непрямые затраты на здравоохранение («бремя болезни») [11].
Важно отметить, что при лечении пожилых пациентов с ХОБЛ распространено явление «лекарственной полипрагмазии», когда для регулярной терапии хронических заболеваний одному пациенту назначаются 5–10 лекарственных препаратов с плохо прогнозируемым клиническим эффектом. Такая практика существенно повышает риск нежелательных явлений (НЯ) и снижает комплаентность к регулярной терапии [12].
Коморбидные патологии у пациентов ХОБЛ старшей возрастной группы существенно повышают число и тяжесть обострений заболевания (≥2 в год), усиливают симптомы и степень дыхательной недостаточности, что требует изменения базисной терапии на «трехкомпонентную» с регулярным медицинским контролем каждые 6 мес [13].
Таким образом, улучшение качества и продолжительности жизни пациентов с ХОБЛ старшей возрастной группы напрямую зависит от раннего выявления и эффективной коррекции основных коморбидных заболеваний.
ХОБЛ и гериатрические синдромы
Помимо типичных коморбидных заболеваний, у пациентов с ХОБЛ старших возрастных групп особое значение имеют гериатрические синдромы, являющиеся как причиной потери автономности (появление и нарастание зависимостей и потребности в посторонней и медицинской помощи), так и фактором снижения продолжительности жизни. Качество жизни, инвалидизация пожилых больных с ХОБЛ существенно зависят от их гериатрического статуса. Высокий риск тяжелых обострений и госпитализаций, характерный для пациентов с ХОБЛ старшей возрастной группы, негативно влияет на этот статус.
«Гериатрический синдром» – многофакторное возраст-ассоциированное клиническое состояние, ухудшающее качество жизни, повышающее риск неблагоприятных/фатальных исходов (смерти, зависимости от посторонней помощи, повторных госпитализаций, потребности в долгосрочном уходе) и функциональных нарушений. В отличие от привычных клинических симптомов хронического заболевания, гериатрический синдром не выступает проявлением патологии одного органа или «органной системы», а отражает комплекс изменений в нескольких системах одновременно. Возникновение одного гериатрического синдрома многократно повышает риск развития других гериатрических нарушений [14].
К наиболее распространенным гериатрическим синдромам, клинически и патогенетически взаимосвязанным с прогрессированием ХОБЛ, относятся:
- старческая астения;
- саркопения;
- мальнутриция;
- остеопороз;
- падения;
- расстройства сна (инсомния) и обструктивное апноэ во сне.
Следует заметить, что, помимо основных гериатрических синдромов, важными для пациентов ХОБЛ старшей возрастной группы являются когнитивные нарушения, тревога и депрессия, хронический болевой синдром, зависимость в базовой функциональной активности, недержание мочи, сенсорные дефициты, ортостатическая гипотензия.
Синдром старческой астении («хрупкость», ССА) – гериатрический синдром, характеризующийся возраст-ассоциированным снижением физиологического резерва и функций различных органных систем и вызывающий повышенную уязвимость организма к воздействию эндо- и экзогенных факторов, высокий риск развития неблагоприятных исходов для здоровья, потери автономности и преждевременной смерти. ССА тесно связан с другими гериатрическими синдромами и коморбидными заболеваниями. При раннем распознавании и терапии он может быть потенциально обратим.
Установлено, что риск развития ССА у пожилых пациентов с ХОБЛ увеличивается вдвое [15]. Кроме того, отмечается увеличение риска тяжелых бронхообструктивных нарушений (30%≤ ОФВ1 ≤50%) у больных ХОБЛ, имеющих частые обострения болезни (>2 в год) и продолжающих курить [16].
Установлено, что наличие у пациента с ХОБЛ ССА повышает число ежегодных тяжелых обострений заболевания, требующих госпитализации, многократно увеличивает риск смерти от любых причин. [17]. При этом частые госпитализации пожилого пациента по любому поводу негативно влияют на функциональное состояние и потерю им автономности.
Рекомендовано проводить скрининг ССА с использованием специализированного вопросника «Возраст не помеха» у пациентов ≥60 лет, обратившихся за медицинской помощью в учреждения амбулаторного или стационарного типа, с целью выявления гериатрических синдромов и определения тактики ведения [14]. При подозрении на наличие ССА следует направить пациента в гериатрический кабинет или назначить консультацию гериатра.
Мальнутриция (недостаточность питания) – серьезный фактор неблагоприятного прогноза у пациентов старшего возраста. Низкий индекс свободной массы жира сильно коррелирует со смертностью больных ХОБЛ [18]. Мальнутриция служит предиктором общей смертности, более значимым, чем возраст и коморбидность (относительный риск (ОР) смерти 1.82; 95% доверительный интервал (ДИ): 1,19–2,79; р=0,006) [19].
У пациентов с ХОБЛ старше 65 лет распространенность мальнутриции достигает 15–25% [20]. Кроме того, это состояние значительно снижает выживаемость больных ХОБЛ после обострения (показатель выживаемости – 67 против 95% у пациентов без мальнутриции) [21].
В амбулаторной практике для выявления мальнутриции используют краткую шкалу оценки пищевого статуса (Mini Nutritional Аssessment – MNA), универсальный скрининг недостаточности питания (Malnutrition Universal Screening Tool – MUST), а у госпитализированных пациентов – скрининг риска недостаточности питания (Nutritional Risk Screening 2002 – NRS-2002) [22].
Саркопения – прогрессирующее генерализованное заболевание скелетных мышц, связанное с повышенной вероятностью неблагоприятных исходов, включающих падения, переломы, физическую нетрудоспособность и смерть [23]. Распространенность саркопении при ХОБЛ составляет 21,6% (95 ДИ: 14,6–30,9) [24].
Саркопения и динапения коррелируют с уровнем интерлейкина 6 и высокочувствительного фактора некроза опухоли-альфа, что может интенсифицировать воспаление в бронхиальном дереве, в то время как цитокины, ассоциированные с ХОБЛ, могут усугублять саркопению [25]. К другим этиологическим факторам саркопении, связанной с ХОБЛ, относятся [26]:
- хроническая гипоксия, индуцирующая снижение мышечной массы в результате взаимодействия нескольких молекулярных посредников, таких как воспаление, сигнальный путь гипоксии, индуцируемый фактор-1;
- окислительный стресс со снижением способности окислительного фермента и уменьшением количества капиллярных сосудов;
- гиперкапния, которая может ухудшаться во время обострений и негативно влиять на мышечную массу через ацидоз (повышает активность убиквитин-протеоразомы протеолитической системы), и/или снижение белкового анаболизма;
- табакокурение;
- лекарства, особенно системные кортикостероиды;
- гиподинамия.
У пациентов с ХОБЛ при наличии саркопении повышается риск нарушений мобильности, зависимости в базовой функциональной активности, падений, остеопороза и переломов, увеличения числа госпитализаций, снижения качества жизни и смерти [27].
Установлено, что при саркопении прогрессивно ухудшается показатель функции внешнего дыхания (ОФВ1, %), что влечет за собой прогрессирование ХОБЛ [28].
Рекомендуется обсуждать здоровье мышц при каждой встрече с пациентом, страдающим ХОБЛ. Для скрининга саркопении может использоваться опросник SARC-F (имеет небольшую чувствительность), выполняться тест с 5-ю подъемами со стула, проводиться динамометрия, измеряться скорость ходьбы [29].
Остеопороз (ОП) – метаболическое заболевание скелета, характеризующееся снижением костной массы, нарушением микроархитектоники костной ткани и, как следствие, переломами даже при минимальной травме [30, 31]. Риск развития ОП у пациентов с ХОБЛ существенно выше популяционного (ОР 2,83; 95% ДИ: 2,00–4,03) [32].
Выделяют отдельный фенотип ОП у больных ХОБЛ с эмфиземой, характеризующийся низким индексом массы тела, мальнутрицией, саркопенией, высоким риском переломов. Этот фенотип ОП ассоциирован с более высоким риском развития старческой астении и возрастанием риска фатального исхода [33].
Критериями диагностики ОП являются [31]:
- патологические переломы крупных костей скелета (бедренной кости, тел(а) позвонков(а), множественных переломов) в анамнезе или выявленные при обследовании, независимо от результатов рентгеноденситометрии или FRAX (при условии исключения других заболеваний скелета);
- высокая индивидуальная 10-летняя вероятность основных патологических переломов (результат оценки FRAX соответствует российскому порогу вмешательства и/или превышает его), независимо от показателя рентгеноденситометрии;
- снижение минеральной плотности костной ткани на 2,5 и более стандартных отклонений (SD) по Т-критерию в шейке бедренной кости и/или в целом в проксимальном отделе бедренной кости и/или в поясничных позвонках (L1–L4, L2–L4), измеренной двухэнергетической рентгеноденситометрией (DXA), у женщин в постменопаузе и мужчин старше 50 лет.
Падения – происшествия, при которых человек внезапно оказывается на земле или на другой низкой поверхности, за исключением случаев, становящихся следствием нанесенного удара, потери сознания, внезапного паралича или эпилептического припадка [34]. Падения в пожилом и старческом возрасте являются одним из главных гериатрических синдромов (ГС), определяющих прогноз жизни и автономности пациента независимо от последствий. Они тесно связанны с другими ГС. Поскольку падения предотвратимы, их профилактика – неотъемлемая часть ведения пациента пожилого и старческого возраста.
Среди всех хронических неинфекционных патологий ХОБЛ – одно из тех заболеваний, которое сопряжено с высокой частотой падений [35]. Главным фактором риска большего числа падений при ХОБЛ выступает нарушение баланса [36].
Выявление анамнеза падений и оценка их риска врачом общей практики, семейным врачом, врачом-пульмонологом, врачом-терапевтом может основываться на алгоритме, представленном на рисунке [34].

Депрессия и тревога у пациентов с ХОБЛ потенцируют друг друга, образуя «порочный круг». Тревожность и беспокойство у больных ХОБЛ наблюдаются в 13–46% случаев. Распространенность депрессии при ХОБЛ достигает 16,2 случая на 1000 пациенто/лет против 9,4 в контрольной группе без ХОБЛ [37].
Когнитивные расстройства (КР) – субъективное и/ или объективно выявляемое ухудшение когнитивных функций (внимания, памяти, речи, восприятия, праксиса, управляющих функций) по сравнению с исходным индивидуальным и/или средними возрастными и образовательными уровнями вследствие органической патологии головного мозга и нарушения его функции различной этиологии, влияющее на эффективность обучения, профессиональной, социальной и бытовой деятельности [38]. КР представляют собой гетерогенную группу состояний, возникающих при различных неврологических, соматических и психических заболеваниях. Основными причинами КР в старшем возрасте служат различные нейродегенеративные, цереброваскулярные заболевания (ЦВЗ) и дисметаболические нарушения. Гипоксические состояния у пациентов ХОБЛ опосредуют дисметаболические изменения, лежащие в основе развития КР у пациентов с этой болезнью.
Скорректированный ОР когнитивных нарушений на фоне ХОБЛ равен 1,21 (95% ДИ: 1,16─1,26; p <0,001) [39]. КР у пациентов с ХОБЛ повышают риск снижения базовой функциональной активности, снижают качество жизни и увеличивают риск инвалидизации [40, 41].
Скрининг и диагностика когнитивных расстройств основаны на сборе анамнеза и нейропсихологического тестирования. Наиболее простыми скрининговыми инструментами могут служить тест «Мини-Ког» (Mini-Cog), МОСА-тест или опросник MMSE [38].
Делирий – преходящее нейрокогнитивное расстройство, проявляющееся спутанностью сознания, нарушениями внимания, восприятия, мышления, эмоционально-аффективными и другими нервно-психическими симптомами. При этом отмечается высокая частота осложнений, среди которых важное значение имеют деменция и потеря функциональной активности. В период обострений ХОБЛ и/или госпитализации пожилых пациентов в 7–10% случаев может развиться гериатрический делирий [42].
Согласно Американскому руководству по диагностике и статистике психических расстройств V пересмотра (2013), делирий представляет собой острое расстройство внимания, уровня сознания и когнитивных функций, которое флуктуирует в течение дня и выступает следствием другого медицинского состояния. При этом в патологический процесс могут быть вовлечены различные высшие мозговые функции, включая восприятие, зрительно-пространственную ориентировку, память, речь. Оценка наличия делирия проводится с применением валидированной скрининговой шкалы «Шкала оценки спутанности сознания» (Confusion assessment method, CAM) [38].
ОСОБЕННОСТИ ВЕДЕНИЯ ПАЦИЕНТОВ С ХОБЛ ПОЖИЛОГО И СТАРЧЕСКОГО ВОЗРАСТА
Удовлетворительная компенсация проявлений ХОБЛ современными лекарственными средствами может не повлиять на качество и продолжительность жизни пожилого пациента в случае игнорирования гериатрических рисков. Индивидуальный план ведения пациентов пожилого и старческого возраста, разработанный междисциплинарной командой, и помощь пожилым больным ХОБЛ, включающая гериатрические интервенции, могут существенно увеличить продолжительность и качество их жизни.
Рекомендации гериатрических сообществ по ведению больных с ХОБЛ включают: [43, 44]:
- отказ от курения;
- обязательную вакцинацию (грипп, пневмококк, SARS-CoV-2 и др.);
- применение бронходилататоров;
- коррекцию гериатрических синдромов;
- лечение коморбидных состояний;
- реабилитацию и коррекцию расстройств сна;
- паллиативную помощь.
Отказ от курения – самая эффективная мера, оказывающая большое влияние на замедление прогрессирования ХОБЛ. Консультирование по методам отказа от курения, включая использование фармакологических средств, оправданно при ведении пациентов любого возраста.
Главной целью в борьбе с курением является именно отказ от этой привычки, а не сокращение числа выкуриваемых сигарет. Однако у пациентов старших возрастных групп не всегда удается сразу добиться полного прекращения курения. Повторные консультирования пациентов, разработка индивидуальных планов отказа от курения, по-видимому, являются эффективными интервенциями.
Использование фармакологических средств, содержащих никотин (таблетки, пластыри, спреи и пр.), варенеклин, также рассматриваются как допустимые интервенции на пути отказа от курения у пациентов пожилого и старческого возраста.
Одной из приемлемых технологий, позволяющих осуществить планомерный отказ от курения, является использование электронных систем нагрева табака. Использование таких систем позволяет более чем на 90% сократить токсичность табачного дыма [45], а применение у пациентов ХОБЛ на протяжении 3 лет приводит к снижению тяжести течения заболевания [46]. Кроме того, исследования демонстрируют, что переключение больных с легкой и умеренной ХОБЛ на электронные системы нагрева табака уже через 12 мес позволяет достичь положительных результатов, схожих с таковыми у пациентов, полностью отказавшихся от табококурения [47].
Вакцинация против гриппа может уменьшить осложнения, связанные с инфекциями нижних дыхательных путей, и смертность. Использование противогриппозных вакцин снижает частоту случаев гриппа в группе вакцинированных пациентов с ХОБЛ независимо от ее тяжести по сравнению с группой плацебо, но не предотвращает другие ОРВИ [48].
Streptococcus pneumoniae поражает большую часть пациентов ХОБЛ. Вакцинация против пневмококка снижает вероятность обострения ХОБЛ, а доказательства среднего качества свидетельствуют о преимуществах такой вакцинации у больных ХОБЛ. В настоящее время недостаточно доказательств для сравнения различных типов пневмококковых вакцин [49].
Назначение и использование фармакотерапии ХОБЛ должно проводиться в соответствии с клиническими рекомендациями Минздрава России «Хроническая обструктивная болезнь легких» (2021) [3]. В настоящее время симптоматическая терапия ХОБЛ включает:
- коротко действующие комбинированные бронхолитики (КДБА) + антихолинергики (КДАХ);
- ингаляционные глюкокортикостероиды (ИГКС).
Для длительной регулярной базисной терапии ХОБЛ применяются [50]:
- длительно действующий бронходилататор (ДДБА) или длительно действующий антихолинергик (ДДАХ);
- фиксированные комбинации ДДАХ/ДДБА;
- фиксированные комбинации ИГКС/ДДБА;
- фиксированные комбинации ДДБА/ДДАХ/ИГКС.
Выбор между монотерапией длительно действующим препаратом и длительно действующими фиксированными комбинациями осуществляется согласно алгоритму ведения пациента с установленным диагнозом ХОБЛ, представленным в клинических рекомендациях Минздрава России «Хроническая обструктивная болезнь легких» (2021) [3].
Следует помнить, что у пациентов ХОБЛ старших возрастных групп, особенно с КР, будут возникать существенные проблемы в процессе использования ингаляционных устройств по причине многократных «ошибок при ингаляции». Для многократного повышения эффективности терапии и приверженности к ней у пациентов с ХОБЛ старшей возрастной группы следует руководствоваться следующими правилами выбора ингаляционного устройства [51]:
- для активации ингаляционного устройства пациенту потребуется минимальное количество действий (≤3; принцип Click and Go – «открыл – нажал – закрыл»);
- для активации ингаляционного устройства пациенту не потребуется «быстрая синхронизация» вдоха (≤1,5 с) с моментом поступления аэрозоля;
- дозированные порошковые ингаляторы (турбохаллер, изихаллер, хандихаллер) следует использовать у пациентов с неизмененной «емкостью вдоха» и/или показателем ОФВ1 >50% (от должных показателей);
- жидкостные аэрозольные ингаляторы (респимат, рапихаллер) следует использовать у пациентов со сниженной «емкостью вдоха» и/или показателем ОФВ1 ≤ 50% (от должных показателей);
- максимальную выгоду от использования портативного ингаляционного устройства будут иметь пациенты, способные воспринимать «визуальную инструкцию», имеющие хорошую обучаемость и повторяемость «алгоритма ингаляции» в ходе 5-минутного тренинга.
Как порошковые, так и аэрозольные ингаляторы имеют свои преимущества и недостатки при назначении пациентам старших возрастных групп. Необходимо уделять особое внимание обучению пациентов и контролю за применением ими ингаляторов, в том числе в домашних условиях, используя ресурсы посторонней помощи (семья, близкие, специалисты по социальному уходу). При отсутствии у пациента ХОБЛ проблем с созданием инспираторного потока, стоит обдумать выбор дозированных порошковых ингаляторов, не требующих дополнительных усилий по координации вдоха с нажатием кнопки. Следует акцентировать внимание пациента на методы контроля правильности проведения ежедневной ингаляции.
КОРРЕКЦИЯ ГЕРИАТРИЧЕСКИХ СИНДРОМОВ
Коррекция гериатрических синдромов должна осуществляться согласно индивидуальному плану ведения пациента, разработанному врачом-гериатром. При составлении индивидуального, пациентоориентированного плана ведения больного врач, исходя из наличия тех или иных гериатрических синдромов, может придерживаться принципов, отраженных в таблице 2.

Гериатрические интервенции могут быть имплементированы в комплексную программу легочной реабилитации, традиционно включающую физический тренинг, диетологические интервенции, когнитивно-поведенческую терапию.
Основными субъективными ограничениями для выполнения упражнений у пожилых пациентов ХОБЛ становятся одышка и слабость, однако отказ от их выполнения может усугублять потерю автономности [42]. Следует постепенно увеличивать нагрузку пациентам, разрабатывать индивидуальные (переносимые для конкретного пациента) комплексы упражнений. В целом, в соответствии с рекомендациями Всемирной организации здравоохранения 2020 г. у пожилых людей в возрасте 65 лет и старше увеличение физической активности (частоты, продолжительности и/или объема) способствует повышению пользы лечения [52].
Обычно стандартная программа упражнений при ХОБЛ включает аэробные упражнения, которые задействуют нижние и верхние конечности и повышают мышечную силу и выносливость [53]. При использовании комбинации тренировок на выносливость и сопротивление мышц наблюдается положительный эффект в отношении общего состояния здоровья и увеличения мышечной силы [54]. Программы легочной реабилитации осуществимы и эффективны даже у пожилых пациентов ХОБЛ и старческой астенией, поскольку при их проведении можно ожидать значительного увеличения мышечной силы, скорости ходьбы и подъема по лестнице [55].
Индивидуальный комплексный план профилактики падений у лиц пожилого и старческого возраста состоит из коррекции соматических заболеваний, ассоциированных с падениями, и функционального статуса, консультирования пациентов по устранению дефектов безопасности окружающей среды и быта, подбора обуви и ассистивных приспособлений (трости, ходунки, протекторы и пр.).
Основное направление снижения риска падений у пациентов ХОБЛ – тренировка равновесия и баланса. Наиболее значимы при этом следующие упражнения: ходьба боком, ходьба со скрещиванием ног, ходьба с пятки на носок (приставной шаг), ходьба на ступеньку вверх и обратно, удержание равновесия на одной ноге (с использованием опоры и контролем за выполнением упражнения).
Ряду пациентов может потребоваться психотерапевтическая поддержка для преодоления страха движений (кинезиофобии). В этом случае целесообразно рассмотреть индивидуальные программы работы с психотерапевтом (или психологом), групповые тренинги, использование методов когнитивно-поведенческой терапии. Последние годы накапливаются доказательства эффективности методов, основанных на «виртуальной реальности», где пациенты могут выполнять определенный комплекс упражнений в игровой среде виртуальных изображений.
Кроме того, следует информировать пациентов по вопросам профилактики констипационного синдрома (увеличение потребления жидкости, растительной клетчатки, продолжительности ходьбы), ортостазма (избегание ситуаций с перепадом температур, резких движений, продолжительных статических нагрузок, мониторинг артериального давления и антигипертензивной терапии и пр.), рекомендовать коррекцию сенсорных дефицитов, консультации специалистов по устранению симптомов недержания мочи или учащенного мочеиспускания.
ЗАКЛЮЧЕНИЕ
ХОБЛ широко распространена среди пациентов старшей возрастной группы со стажем табакокурения ≥10 пачка/лет, при этом существуют реальные возможности ее профилактики и эффективного контроля в пожилом возрасте. Следует признать, что в настоящее время существуют проблемы ранней диагностики ХОБЛ у пожилых больных, обусловленные частой встречаемостью у них респираторных симптомов, «стоицизма» к своему болезненному состоянию, отсутствием стандартизованной рутинной спирометрии как основного метода функциональной диагностики ХОБЛ в первичном звене медико-санитарной помощи.
Коморбидные заболевания и разнообразные гериатрические синдромы негативно влияют на течение, прогноз и исходы у пациентов ХОБЛ. Несмотря на то что многие механизмы «физиологического старения» остаются малопонятными, роль «преждевременного старения» и фактора GET-номики в формировании этиопатогенетических звеньев ХОБЛ не вызывает сомнения. Более того, коморбидные патологии и множественные гериатрические синдромы многократно усиливают прогрессирование ХОБЛ, увеличивают число ежегодных тяжелых обострений и госпитализаций, смертность пациентов, прямые и косвенные затраты системы здравоохранения (бремя болезни). Системное воспаление, связанное со старением и накоплением сенесцентных клеток, негативно влияет на «естественную историю» пациентов ХОБЛ и вызывает прогрессирование таких коморбидных заболеваний, как хроническая сердечная недостаточность, остеопороз, диабет и заболевания периферических артерий.
Индивидуальный подход к терапии пожилых больных с ХОБЛ имеет важное значение, поскольку сопутствующие болезни, когнитивные и физические нарушения, низкая мобильность пациента и его плохая обучаемость принципиально влияют на выбор ингаляционного устройства для длительной регулярной терапии. Очевидно, что особенности ведения больных старшей возрастной группы, сложные коморбидные взаимодействия и множественные гериатрические синдромы потребуют междисциплинарного подхода в обеспечении максимально эффективной лекарственной и немедикаментозной терапии таких пациентов.



