Эпилепсия и нарушения сердечной функции являются тесно взаимосвязанными, влияющими и усугубляющими друг друга, причинными и сопутствующими патологическими состояниями. Если взять эпилепсию и нарушения сердечного ритма и проводимости, то они могут быть коморбидными патологиями, т.е. патогенетически связанными между собой, но не являющимися по отношению друг к другу причинными, фоновыми заболеваниями. Вместе с тем эпилепсия может выступать следствием кардиоэмболического инсульта, и в этой ситуации она рассматривается как осложнение перенесенной церебральной катастрофы. В связи с этим большое внимание следует уделять взаимодействию противоэпилептической, антиаритмической и антикоагулянтной терапии.
В настоящее время много исследований посвящено влиянию эпилептических приступов и противоэпилептической терапии на сердечную функцию у пациентов без сопутствующей кардиальной патологии. Сообщается о возникновении жизнеугрожающих аритмий в приступном (иктальном) и послеприступном (постиктальном) периодах. В данных условиях нарушения сердечного ритма и проводимости рассматриваются как осложнение эпилепсии и ее лечения.
Также немало работ посвящено дифференциальной диагностике эпилептических приступов и кардиогенных синкопальных состояний. Сообщается о возможном их сосуществовании, а также об ошибочной диагностике эпилепсии при кардиогенных пароксизмальных состояниях и необоснованной длительной противоэпилептической терапии в связи с этим.
Таким образом, эпилепсия и нарушения сердечного ритма могут быть независимыми, причинными, взаимовлияющими и взаимообусловливающими патологическими состояниями.
В данной статье мы остановимся на различных вариантах коморбидности эпилепсии и кардиальной патологии.
ЭПИЛЕПСИЯ КАК ОСЛОЖНЕНИЕ КАРДИОЭМБОЛИЧЕСКИХ ИНСУЛЬТОВ ВСЛЕДСТВИЕ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ
Цереброваскулярная патология, включая острые нарушения мозгового кровообращения (ОНМК), – одна из самых частых причин развития эпилепсии у пожилых людей. По разным сведениям, постинсультная эпилепсия составляет 30–50% случаев впервые диагностированных случаев эпилепсии в этой возрастной группе [1–3].
Большое количество эпидемиологических исследований показывает, что причиной инсульта и соответственно его патогенетическим вариантом могут служить атеросклероз крупных артерий (атеротромботический вариант инсульта), кардиоэмболия (кардиоэмболический подтип), болезнь мелких сосудов (лакунарный подтип) [4–6] и другие патологические состояния, такие как воспалительные заболевания [7], гиперкоагуляция [8] и расслоение артерий [9].
Во многих исследованиях описаны различные факторы риска, связанные с более высокой частотой возникновения постинсультной эпилепсии: подтипы инсульта, корковые поражения головного мозга, обширность инфаркта, тяжесть инсульта, состояние острой спутанности сознания, сосудистые факторы риска [10–15].
Острые симптоматические эпилептические приступы после инсульта обычно делятся на ранние и поздние в зависимости от времени появления после ОНМК, с условным временным интервалом в 14 дней. Приблизительно у 5–10% пациентов после инсульта возникают эпилептические приступы: в ряде случаев – с ранним началом в первые 2 нед [16– 18], у части больных – более чем через 2 нед после инсульта [19, 20]. Возникновение поздних симптоматических приступов часто является фактором риска постинсультной эпилепсии. По разным сведениям, у 3–30% пациентов после инсульта может развиться постинсультная эпилепсия, что отрицательно влияет на прогноз инсульта и качество жизни пациентов [10, 22, 23]. Мы остановимся на кардиоэмболическом варианте инсульта как причине развития эпилепсии, поскольку в этом случае нарушения сердечного ритма служат непосредственной причиной развития как ишемического инсульта, так и эпилепсии. На кардиоэмболический патогенетический вариант приходится 14–30% от всех ишемических инсультов [24].
Arboix A. и Alio J. [24] изучали частоту и клинико-нейровизуализационные характеристики пациентов с перенесенным кардиоэмболическим инсультом и постинсультной эпилепсией. Авторы включили в исследование 93 пациента с кардиоэмболическим подтипом ОНМК, разделив их на 2 подгруппы: с эпилепсией и без эпилепсии. Постинсультная эпилепсия была диагностирована у 43 (46,2%) из 93 больных. Среднее время (± стандартное отклонение) от начала инфаркта головного мозга до первого приступа в группе постинсультной эпилепсией составило 22,5±31,6 мес. В группе с постинсультной эпилепсией наблюдалась значительно более частая встречаемость фибрилляции предсердий (p=0,022) и более высокий уровень глюкозы (p <0,001) по сравнению с группой без эпилепсии. Наиболее частыми типами приступов при постинсульной эпилепсии были билатеральные тонико-клонические (61,0%). Хотя сравнительный анализ не выявил каких-либо существенных различий в объеме инфарктов головного мозга между двумя группами, участие теменной доли в инфаркте в группе с постинсультной эпилепсией (69,8%) было значительно выше (p=0,006), чем в группе без эпилепсии (40,0%). Множественный логистический регрессионный анализ позволил заключить, что вовлечение теменной доли в инфаркт (отношение шансов 4,95; 95% доверительный интервал 1,25–19,60; p=0,023) было значимым независимым предиктором постинсульной эпилепсии.
Фибрилляция предсердий (ФП) – один из наиболее значимых факторов риска развития кардиоэмболического инсульта. При этом для вторичной профилактики инсультов необходим прием антикоагулянтных препаратов. При коморбидности ФП с эпилепсией у пациентов, перенесших инсульт, особую значимость в клинической практике как кардиологов, так и неврологов приобретает проблема межлекарственных взаимодействий антикоагулянтных, противоаритмических и антиэпилептических средств.
Китайские коллеги в 2020 г. опубликовали исследование [25], целью которого было сравнение рисков серьезного кровотечения у пациентов с фибрилляцией предсердий (ФП), которые одновременно принимали новые оральные антикоагулянты (НОАК) и противоэпилептические препараты (ПЭП: карбамазепин, габапентин, ламотриджин, леветирацетам, окскарбазепин, фенобарбитал, фенитоин, прегабалин, топирамат, вальпроевая кислота и зонисамид), и у больных, получавших только НОАК. Из всех исследуемых одновременно ПЭП и НОАК получали 15,3%. Наиболее высокий риск кровотечения отмечался при совместном приеме с НОАК вальпроевой кислоты, далее по этому показателю шли фенитоин и леветирацетам. Одновременное использование антикоагулянтов с одним из этих трех антиэпилептических средств увеличивало скорректированную частоту серьезных кровотечений на 1000 человеко-лет более значительно, чем применение только НОАК (табл.).
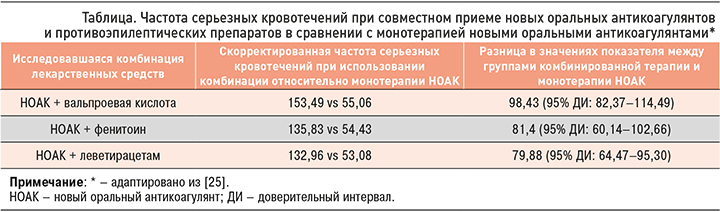
В обзоре Stollberger C. и Finsterer J. указывается на фармакокинетическое взаимодействие между ПЭП и НОАК [26]. Авторы констатируют, что карбамазепин, леветирацетам, фенобарбитал, фенитоин и вальпроевая кислота могут снижать эффект антикоагулянтов, индуцируя активность P-гликопротеина (P-gp). При этом карбамазепин, окскарбазепин, фенитоин, фенобарбитал и топирамат могут отрицательно сказываться на действии НОАК, индуцируя активность CYP3A4. В отношении вальпроевой кислоты были получены противоречивые данные: она может вызывать ингибирование, а также индукцию CYP3A4.
В обзоре американских коллег (2020) [27], также затрагивающем проблемы взаимодействия НОАК (дабигатрана этексилата, ривароксабана, апиксабана, эдоксабана или бетриксабана) c ПЭП, приводятся данные о потенциальных клинических последствиях при совместном приеме этих двух групп препаратов. Сообщается, что большинство фармакокинетических взаимодействий между НОАК и ПЭП первого поколения происходит через индукцию системы печеночных ферментов и конкуренцию за переносчик P-гликопротеина: это может приводить к снижению уровней антикоагулянтов в плазме и, как следствие, к тромботическим событиям.
Таким образом, кардиологам и неврологам необходимо с особым вниманием подходить к назначению препаратов больным ФП с перенесенными кардиоэмболическими инсультами и эпилепсией, принимая во внимания возможные межлекарственные взаимодействия и риски совместного приема антиконвульсантов и антикоагулянтнов, учитывая необходимость их одновременного назначения.
ЭПИЛЕПТОГЕННЫЕ НАРУШЕНИЯ СЕРДЕЧНОГО РИТМА И ПРОВОДИМОСТИ СЕРДЦА
Эпилепсия часто становится осложнением кардиоваскулярной патологии и инсульта. Вместе с тем сама эпилепсия или ее лечение эпилепсии может приводить к нарушению со стороны сердечного ритма и проводимости.
Эпилептогенным аритмиям посвящено множество исследований. По данным различных авторов, данные нарушения могут варьировать от неопасных до серьезных и жизнеугрожающих аритмий, в некоторых случаях приводящих к внезапной необъяснимой смерти при эпилепсии (SUDEP). Большинство исследователей связывает возникновение нарушений ритма сердца с появлением с эпилептическим приступом по времени (в предиктальном, чаще в постиктальном периоде).
В проведенном нами исследовании [28, 29] при помощи имплантации подкожного регистратора ЭКГ на длительное время (более чем на год) изучались изменения сердечного ритма и проводимости у пациентов во время судорожного приступа с фокальной эпилепсией (n=79) без сопутствующей кардиальной патологии. Было установлено, что в подавляющем большинстве случаев (n=70) во время эпилептического приступа возникают различные нарушения сердечного ритма и проводимости. Чаще всего – у 47 (59,49%) из 79 пациентов – во время эпилептического приступа регистрируется синусовая тахикардия с частотой сердечных сокращений (ЧСС) от 100 до 200 уд./мин.
У 23 (29,11%) из 79 пациентов в период эпилептических приступов были зафиксированы аритмии. У 3 из этих 23 больных наблюдались кратковременные эпизоды синусовой брадикардии с ЧСС 45–40 уд./ мин, возникающие вслед за синусовой тахикардией во время тонико-клонической фазы эпилептического приступа. У 2 пациентов были выявлены эпизоды асистолии как исход брадиаритмии длительностью более 6 с (максимум до 17,4 с), что было обусловлено синоатриальной блокадой III степени. Одному пациенту был имплантирован кардиостимулятор. У 4 человек отмечалась частая желудочковая экстрасистолия в приступном периоде. У 14 больных была обнаружена наджелудочковая эктопическая активность, при этом в 3 случаях в виде устойчивых эпизодов ФП, а в остальных 11 – пробежек наджелудочковой тахикардии и частой наджелудочковой экстрасистолии. У 9 (11,5%) участников исследования не было установлено изменений со стороны сердечного ритма и проводимости в период возникновения эпилептического приступа.
В результате проведенного нами исследования выявлены факторы риска развития сердечных аритмий в приступном периоде. Чаще нарушения сердечного ритма и проводимости возникали у мужчин, чем у женщин, при билатеральных тонико-клонических приступах, чем при фокальных, при частых и серийных приступах и при пароксизмах, возникающих во время сна («вокруг сна»).
В нашей работе не было выявлено зависимости со стороны сердечного ритма и проводимости в иктальном периоде от принимаемой противоэпилептической терапии, в том числе препаратов блокаторов натриевых каналов. Однако другие исследования сообщают об их возможном влиянии на сердечную функцию.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ПАРОКСИЗМАЛЬНЫХ СОСТОЯНИЙ, СВЯЗАННЫХ С КАРДИАЛЬНОЙ ДИСФУНКЦИЕЙ И ЭПИЛЕПТИЧЕСКИМИ ПРИСТУПАМИ
Дифференциальный диагноз между синкопальными состояниями и эпилепсией до сих пор зачастую вызывает большие трудности.
В многоцентровом проспективном исследовании итальянских коллег [30] проводилась оценка распространенности обмороков у пациентов с диагнозами «возможная» и «фармакорезистентная» эпилепсия в соответствии с рекомендациями Европейского общества кардиологов (ESC) по диагностике обмороков. Было обследовано 107 пациентов; возможная эпилепсия была диагностирована у 63 (58,9%), фармакорезистентная – у 44 (41,1%) пациентов. Окончательный диагноз изолированного обморока был поставлен 45 пациентам (42,1%), у всех них имела место возможная эпилепсия (45/63; 71,4%). Изолированная эпилепсия была обнаружена у 21 пациента (19,6%) и чаще встречалась в группе фармакорезистентной, чем в группе возможной эпилепсии (34,1 против 9,5%; p=0,002). Что еще более важно, обморок и эпилепсия сосуществовали у 37,4% всех пациентов, причем такое сосуществование чаще встречалось среди больных с лекарственно-устойчивой эпилепсией, чем с возможной (65,9 против 17,5%; p <0,001). Авторы сделали вывод, что изолированный обморок был диагностирован примерно у 70% пациентов с возможной эпилепсией. Обморок и эпилепсия сочетались примерно у 20% больных с возможной и примерно у 60% с лекарственно-устойчивой эпилепсией. Эти данные подчеркивают необходимость разработки рекомендаций ESC по методам лечения обмороков у пациентов с возможной фармакорезистентной эпилепсией.
В другом исследовании [31] оценивалась частота обмороков у пациентов с диагнозом лекарственно-устойчивая эпилепсия без явной болезни сердца, изучалась взаимосвязь между клиническими и электроэнцефалографическими (ЭЭГ) изменениями и проверялась роль теста наклона (IT). В исследовании участвовали 35 пациентов с диагнозом «эпилепсия» при больнице, у которых возникали синкопальные состояния без явных сердечных заболеваний. Частота обмороков составила 25,7% (n=9) со значительной распространенностью у женщин. Наиболее частым диагнозом был вазовагальный обморок (ВВС). Авторы обнаружили значительную связь между обмороком и наличием вегетативных симптомов (p=0,005). Тест с наклоном явился наиболее значимым исследованием в дифференциальной диагностике пациентов с синкопами с вегетативными симптомами независимо от результатов ЭЭГ и аномалий магнитно-резонансной томографии (МРТ) головного мозга.
Приведенные исследования подтверждают значимость правильной дифференциальной диагностики эпилепсии и пароксизмальных состояний неэпилептического (кардиального) генеза. С одной стороны, при отсутствии эпилептических приступов, но наличии изолированных синкоп, зачастую кинематически схожих с эпилептическими приступами, ошибочная диагностика эпилепсии может привести к необоснованной, длительной терапии антиконвульсантами. С другой стороны, при сосуществовании синкоп и эпилептических приступов ошибочная диагностика синкопальных состояний как эпилептических может привести к состоянию «мнимого ухудшения» (М.Б. Миронов, 2015), когда при адекватно подобранной противоэпилептической терапии пациент отмечает появление новых видов эпилептических приступов или учащение существующих пароксизмов, воспринимая любые пароксизмальные состояния неэпилептического генеза как эпилептические приступы. В таком случае недостаточный сбор анамнеза и неполное обследование может служить причиной необоснованной смены ПЭП или добавления в схему лечения дополнительного антиконвульсанта.
ЗАКЛЮЧЕНИЕ
Сопутствующие сердечно-сосудистые заболевания часто встречаются у больных эпилепсией. Многочисленные исследования указывают на влияние эпилептических приступов на сердечную функцию. Эпилепсия может быть следствием кардиоэмболического инсульта на фоне нарушений сердечного ритма и проводимости. Вместе с тем до настоящего момента в ряде случаев существуют сложности в дифференциальной диагностике эпилепсии и кардиоцеребральных синкоп.
В статье изложены несколько аспектов, освещающих сложную взаимосвязь между эпилепсией и кардиологическими заболеваниями. Этот обзор был нацелен на то, чтобы осветить основные открытия по коморбидности эпилепсии и нарушений сердечного ритма и проводимости за последнее время.
Важное значение при лечении коморбидных пациентов с эпилепсией и сердечными аритмиями имеют возможные межлекарственные взаимодействия противоэпилептических, антиаритмических и антикоагулянтных препаратов, которые должны учитываться как неврологами, так и терапевтами и кардиологами. Очевидно, что к таким пациентам необходим индивидуальный подход с подбором индивидуальной схемы терапии. В настоящее время все еще существует значительный разрыв между различными медицинскими специальностями, но, по мере того как мы начинаем обращать внимание на все сопутствующие синдромы и патологические состояния, неврологам-эпилептологам будет необходимо все больше и больше улучшать свои кардиологические навыки.



