ВВЕДЕНИЕ
Паращитовидные железы (ПЩЖ) контролируют внеклеточный кальциевый гомеостаз путем секреции паратиреоидного гормона (ПТГ). Повышение артериального давления (АД), аритмии, гипертрофия левого желудочка (ЛЖ) и застойная сердечная недостаточность (СН) нередко встречаются у пациентов с заболеваниями ПЩЖ.
Гипопаратиреоз – состояние, характеризующееся сниженной продукцией ПТГ паратиреоидными железами или резистентностью тканей к его действию, что сопровождается нарушениями фосфорно-кальциевого обмена. Отсутствию или недостаточности ПТГ при гипопаратиреозе неизбежно сопутствует развитие гипокальциемии. Недостаток кальция в организме вызывает частичную деполяризацию потенциала покоя на мембране нейронов, тем самым увеличивая вероятность запуска потенциала действия [1]. Вследствие этого повышаются нервно-мышечная возбудимость и общая вегетативная реактивность, что, в свою очередь, влечет за собой разнообразные клинические проявления, затрагивающие почти все системы организма. Гипокальциемия может приводить к нарушению ритма сердца, удлинению интервала Q–T, в редких случаях к СН и дилатационной кардиомиопатии. Гипопаратиреоз, вызванный хирургическим вмешательством, и первичный гипопаратиреоз вследствие генетических, аутоиммунных нарушений служат основными причинами гипокальциемической СН.
Целью нижеприведенного клинического наблюдения является помощь клиницистам, особенно смежных специальностей, в вопросах своевременной диагностики дилатационной гипокальциемической кардиомиопатии, обусловленной гипопаратиреозом, и назначения адекватной этиопатогенетической терапии. Гипокальциемия может вызывать тяжелую сократительную дисфункцию ЛЖ независимо от ее причины. Прямое действие ПТГ на сердце и изменения гомеостаза кальция, такие как гипокальциемия и гиперкальциемия, составляют основные патогенетические механизмы, посредством которых нарушения функции ПЩЖ влияют на сердечно-сосудистую систему [2].
В статье представлен клинический случай пациентки, поступившей в отделение кардиологии ГБУЗ «НИИ – Краевая клиническая больница № 1 им. проф. С.В. Очаповского» (г. Краснодар) с явлениями острой СН, но без предшествующего кардиологического анамнеза. Мы предположили, что гипокальциемия и гипопаратиреоз явились потенциальной причиной СН у этой пациентки. В результате детального анализа анамнестических, кинических данных, результатов комплексного лабораторно-инструментального обследования был установлен диагноз дилатационной гипокальциемической кардиомиопатии вследствие первичного гипопаратиреоза, а симптомы СН регрессировали по достижении нормокальциемии. Таким образом, мы рекомендуем включать гипокальциемию и гипопаратиреоз в перечень дифференциально-диагностического поиска у всех пациентов с сердечной дисфункцией без предшествующего анамнеза сердечно-сосудистых заболеваний.
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
Пациентка Т., 45 лет, 11.01.2023 поступила в НИИ – Краевую клиническую больницу № 1 г. Краснодара со следующими жалобами: слабость, осиплость голоса, отеки голеней, тупые боли в правом подреберье, эпизоды удушья в положении лежа, сопровождающиеся пробуждениями по 2–3 раза за ночь (спит на двух подушках), судороги различных групп мышц, одышка при ходьбе менее 30 м, падения без потери сознания из-за слабости в нижних конечностях.
Из данных анамнеза известно, что во время второй беременности (в 2010 г.) у пациентки были впервые выявлены протеинурия, отеки голеней, артериальная гипертензия, после чего ей был установлен диагноз «преэклампсия». Было произведено родоразрешение посредством кесарева сечения. Артериальная гипертензия сохранилась и в послеродовом периоде. В 2012 г. после острой респираторной инфекции вновь развилась олигурия (выделялось около 100 мл мочи в течение 3–4 дней). Пациентка обратилась к терапевту по месту жительства, где в результате дообследования у нее были обнаружены значительная протеинурия, нефротический синдром и установлен диагноз «хронический гломерулонефрит, отечная форма». Больная получала стационарное лечение в виде высоких доз глюкокортикостероидов (метилпреднизолон до 10 таблеток в сутки) и цитостатиков (циклофосфан). Была выписана в удовлетворительном состоянии, получив рекомендации по постепенной отмене глюкокортикостероидов.
Приблизительно в этот же период времени пациентка стала впервые отмечать мышечные подергивания, мелкие судороги в дистальных группах мышц, боли в мышцах, усиление этих явлений при значительных и высокоинтенсивных физических нагрузках, однако к врачу по этому поводу не обращалась в связи с транзиторным характером симптомов и их незначительной выраженностью.
В 2018 г. пациентка впервые отметила ухудшение зрения, головные боли. Была направлена к офтальмологу, где в результате обследования ей был установлен диагноз катаракты OU и выполнена операция по замене хрусталика обоих глаз. После операции зрение улучшилось, однако в последующем появились судороги в конечностях, одышка при подъеме более одного этажа.
С весны 2022 г. больную стали беспокоить нарастание слабости, судороги, одышка, невозможность подняться на второй этаж. С июля 2022 г. возникли боли в левой половине грудной клетки, тупые боли и тяжесть в правом подреберье, выраженные отеки нижних конечностей. Свое состояние пациентка расценила как обострение гломерулонефрита. Была госпитализирована в стационар по месту жительства в декабре 2022 г. в связи с выраженной одышкой и отеками нижних конечностей. В ходе обследования данных в пользу активности гломерулонефрита получено не было, однако выявлено снижение сократимости миокарда, и установлен диагноз «вторичная дилатационная кардиомиопатия (КМП) смешанного генеза (дисметаболическая, гипертоническая) со сниженной фракцией выброса (35%). Вероятно, инфекционный миокардит».
Пациентка получала назначенную ей терапию СН, наблюдалась у терапевта по месту жительства. В представленной медицинской документации в лабораторных исследованиях неоднократно выявлялось снижение уровня кальция в крови, по поводу которого больной назначались препараты кальция до 1 г/сут и нативный витамин D до 2000 МЕ/сут, однако причинно-следственные связи указанных состояний установлены не были, и к эндокринологу пациентку не направляли.
С начала января 2023 г. у пациентки началось ухудшение состояния в виде усиления слабости, одышки, судорожного и отечного синдромов. 11.01.2023 она была госпитализирована в кардиологическое отделение НИИ – Краевая клиническая больница № 1 г. Краснодара.
Физикальное обследование при поступлении выявило частоту дыхания 18 вдохов в минуту, частоту сердечных сокращений 60 уд/мин, АД 120/75 мм рт.ст., уровень насыщения кислородом крови 93%, температуру тела 36,8 °C. При аускультации легких – ослабление легочного звука в нижних отделах обоих легких и диффузные двусторонние мелкопузырчатые хрипы. Аускультация сердца показала нормальные тоны сердца и отсутствие патологических шумов. При осмотре – щитовидная железа 0 ст, мягкоэластичная, безболезненная; узлообразования не пальпировались. Симптомы Труссо и Хвостека положительные. Яремные вены напряжены, периферическая пульсация сохранена, нижние конечности симметрично отечны. Обращал на себя внимание карпопедальный спазм (тонически сокращенные мышцы кистей в виде положения «руки акушера»).
На рентгенограмме органов грудной клетки были обнаружены признаки легочного стаза с увеличением ворот легких за счет вовлечения сосудистых элементов и повышенным кардиоторакальным индексом (рис. 1).
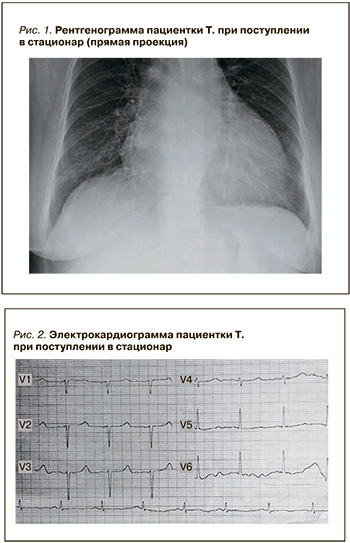
Электрокардиограмма (ЭКГ) в 12 отведениях показала удлинение интервала QT. При первом измерении ЭКГ скорректированный интервал QT (QTc) составлял 0,563 с (норма ≤0,44 с; рис. 2).
При эхокардиографическом исследовании были выявлены сниженная фракция выброса (ФВ) ЛЖ до 23%, митральная и трикуспидальная недостаточность и увеличение конечно-диастолического размера ЛЖ до 60 мм (рис. 3).
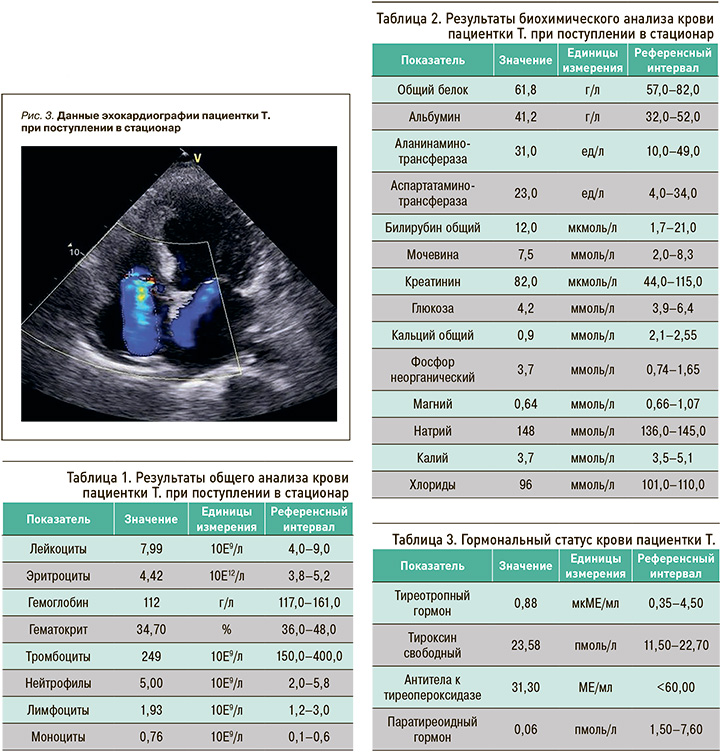
Результаты лабораторных исследований пациентки представлены в таблицах 1 и 2.
С учетом клинических проявлений гипокальциемии (ларингоспазм, стридор, парестезия, карпопедальный спазм, судороги), клинических и лабораторно-инструментальных проявлений СН (одышка, отечный синдром, слабость, повышение N-терминального фрагмента мозгового натрийуретического пептида до 11 899,0 пг/мл при норме <155,00, снижение ФВ ЛЖ до 23%), анамнестических данных (катаракта в молодом возрасте) и лабораторных показателей (умеренное снижение гемоглобина, выраженная гипокальциемия, гиперфосфатемия, гипомагнеземия) у пациентки был заподозрен первичный гипопаратиреоз как причина вторичной дилатационной кардиомиопатии. С целью подтверждения этой гипотезы был проведен анализ гормонального статуса пациентки (табл. 3).
В связи с уменьшением уровня ПТГ до 0,06 пг/ мл, стойким снижением общего и ионизированного кальция в крови пациентка была консультирована эндокринологом: сформулированный диагноз «гипопаратиреоз неуточненный. Гипокальциемия».
Пациентке было незамедлительно начато введение болюсно 2 ампул 10% глюконата кальция в 5% раствора декстрозы, а затем налажена инфузия десяти флаконов глюконата кальция в 1000 мл физиологического раствора, что способствовало минимизации судорог, повышению уровня кальция до 1,92 ммоль/л.
Кроме этого, была продолжена терапия СН. Поскольку петлевые диуретики могут усугубить потерю кальция с мочой, для облегчения синдрома СН пациентке были назначены гидрохлоротиазид (25 мг/сут) и спиронолактон (50 мг/ сут). Также в соответствии с рекомендациями по лечению СН применялась фиксированная комбинация валсартан + сакубитрил перорально с титрацией дозы до максимально переносимой (100 мг 2 раза/сут).
Пациентка была переведена в эндокринологическое отделение стационара, где ей проводилась терапия СН, мероприятия по купированию острой гипокальциемии с одновременным назначением пероральных препаратов карбоната кальция в суммарной суточной дозе 3000 мг и активных форм витамина D (альфакальцидол) 3 мкг/сут. С учетом гипомагнеземии пациентка также получала перорально калия магния аспаргинат (лекарственный препарат Панаспар, содержащий 316 мг магния аспарагината + 280 мг калия аспарагината, по 1 таб./ сут в течение всего периода пребывания в стационаре). Кроме того, согласно существующим национальным рекомендациям, был проведен комплекс диагностических мероприятий с целью исключения аутоиммунных полигландулярных синдромов (АПГС), одним из облигатных симптомов которых может выступать первичный гипопаратиреоз; данных в пользу АПГС получено не было.
На фоне коррекции гипокальциемии, гипомагниемии наблюдалась положительная клиническая динамика: судороги, спастические боли в животе не рецидивировали, приступы удушья и нехватки воздуха значительно уменьшились, отеки регрессировали. Лабораторно на фоне проводимой терапии произошли следующие изменения: положительная динамика уровня кальция крови (1,95–2,1 ммоль/л), магния (0,79 ммоль/л), снижение уровня фосфора крови до 2,18 ммоль/л, тенденция к снижению уровня N-терминального фрагмента мозгового натрийуретического пептида крови (8896,00 пг/мл).
Сформулирован клинический диагноз:
- первичный гипопаратиреоз с тяжелой гипокальциемией при поступлении (11.01.2023);
- осложнения: вторичная дилатационная дисметаболическая кардиомиопатия. Желудочковая экстрасистолия IV гр. по Lown. Удлинение интервала QT на фоне гипокальциемии. ХСН II Б ст. нФВ, функциональный класс (ФК) III по NYHA. Приступы острой левожелудочковой недостаточности;
- сопутствующие заболевания: хронический гломерулонефрит морфологически неверифицированный, рецидивирующего течения (нефротический синдром) леченный кортикостероидами и цитостатиками (циклофосфан, суммарная доза циклофосфамида?), ремиссия. Хроническая болезнь почек С1 (расчетная скорость клубочковой фильтрации по CKD-EPI 103 мл/мин/1,73 м2), данных в пользу рецидива нефротического синдрома нет (суточная протеинурия – 0,1 г/сут, общий белок крови – 66 г/л), показатели уровня азотемии в пределах нормы.
Пациентка была выписана через 11 дней от момента поступления в стационар в удовлетворительном состоянии с положительной клинической динамикой проявлений СН и прочих симптомов гипокальциемии с рекомендациями по коррекции доз препаратов кальция, магния, витамина D. Были определены терапевтические цели, пациентка получила направление на генетическое обследование, рекомендации провести рентгеновскую денситометрию, исследование уровня витамина D с последующей соответствующей коррекцией по показаниям.
Через 3 мес после выписки у пациентки отсутствовали жалобы со стороны сердечно-сосудистой системы, кроме того, не рецидивировал судорожный синдром. Гипокальциемия и гиперфосфатемия были скорректированы в соответствии с поставленными терапевтическими целями: кальций с поправкой на альбумин составил 2,21 ммоль/л, ионизированный кальций – 1,09 ммоль/л, сывороточный фосфат – 1,45 ммоль/л. На ЭКГ наблюдался синусовый ритм с нормализованным интервалом QTc до 430 мс. Эхокардиография выявила нормализацию диаметра ЛЖ до 45 мм, отсутствие митральной и трикуспидальной регургитации, улучшение ФВ ЛЖ (53%).
ОБСУЖДЕНИЕ
Первичный гипопаратиреоз описывается как аномально низкая секреция ПТГ, приводящая к стойкой гипокальциемии и соответствующим полиорганным проявлениям. Учитывая обратимость некоторых случаев гипокальциемической кардиомиопатии, жизненно важно своевременно верифицировать этот диагноз и определить оптимальную этиопатогенетическую терапию [3].
ПТГ играет существенную роль в сердечной функции не только потому, что поддерживает гомеостаз кальция, но и потому, что оказывает прямое положительное влияние на сердечную мышцу [4]. Хотя точные механизмы еще предстоит выяснить, гипокальциемия может приводить к сердечной дисфункции, в то время как сам ПТГ, по-видимому, непосредственно влияет на функцию кардиомиоцитов [5].
Гомеостаз кальция нарушается при гипопаратиреозе, что влечет за собой возможное развитие кардиомиопатии, СН и аритмий [6]. В группу повышенного риска развития сердечно-сосудистых заболеваний входят пациенты с нехирургическим гипопаратиреозом и нарушением гомеостаза кальция [7].
В исследовании Gosmanova E.O. et al. у пациентов с хроническим гипопаратиреозом частота сердечно-сосудистых заболеваний была значительно выше, чем у пациентов без этой патологии (19,4 против 9,5%). Кроме того, в сравнении с группой больных с перманентным гипопаратиреозом в группе пациентов с хроническим гипопаратиреозом были зарегистрированы более высокие показатели частоты фибрилляции предсердий (6,0 против 2,7%), тахиаритмии (0,7 против 0,4%), инфаркта миокарда (1,9 против 1,3%), ишемической болезни сердца (9,6 против 5,3%), СН (5,9 против 2,4%), инсульта (4,6 против 2,4%) и цереброваскулярных заболеваний (6,0 против 3,0%; во всех случаях р <0,001) [8].
В представленном клиническом случае 3 мес адекватной терапии до достижения терапевтических целей способствовали нивелированию клинических симптомов и, более того, полному восстановлению сократительной способности миокарда. Тем не менее в предыдущих исследованиях сообщалось, что восстановление функции ЛЖ может занять до 6 мес у пациентов с СН вследствие гипопаратиреоза. Например, в ранее описываемом случае у 40-летней женщины с историей тиреоидэктомии по поводу болезни Грейвса отмечались синкопальные состояния, симптомы СН, удлиненный интервал QT на ЭКГ и уровень кальция 3,6 мг/дл. Потребовался год лечения, чтобы улучшить ее симптомы и восстановить ФВ ЛЖ [3].
Гипокальциемия является редкой, но излечимой причиной кардиомиопатии и поэтому должна рассматриваться во всех необъяснимых случаях дисфункции ЛЖ [9]. Раннее введение кальция, обычно вместе с витамином D, может уменьшить и даже обратить вспять систолическую и диастолическую дисфункцию ЛЖ и восстановить нарушения проводимости [2].
ЗАКЛЮЧЕНИЕ
Дисметаболическая кардиомиопатия вследствие гипокальциемии – редкое осложнение гипопаратиреоза. Своевременная диагностика и ранняя коррекция гипокальциемии оказывает существенное влияние на терапию СН, при этом функция сердца способна к восстановлению при нормализации уровня кальция. Таким образом, приоритетным направлением должна быть оценка ведущего обратимого этиопатогенетического механизма у каждого пациента с СН, при этом крайне важно сохранить баланс кальция при гипопаратиреозе для снижения частоты развития СН и других осложнений. Реализация представленных задач осуществима при индивидуальном подходе к пациенту в каждой клинической ситуации и тесном взаимодействии профильных специалистов.



