В последние десятилетия наблюдается повышенный интерес к заболеваниям, входящим в группу спондилоартритов, в которую относятся псориатический артрит, реактивный артрит, артрит, ассоциированный с воспалительными заболеваниями кишечника, анкилозирующий спондилит (АС) [1]. АС – это хроническое системное воспалительное заболевание, которое характеризуется поражением аксиального скелета с частым вовлечением в патологический процесс периферических суставов и энтезисов [1, 2, 3].
Известно, что у воспалительных заболеваний кишечника (ВЗК) и АС есть единые клинико-патогенетические особенности. К ним относятся общие генетические мутации, хроническое воспаление неизвестной этиологии, сходные микро- и макроскопические признаки воспаления кишечника [4, 5, 6].
Еще с 80-х годов известно, что у 60% пациентов со спондилоартритом (СпА) выявляют признаки бессимптомного микроскопического воспаления в кишечнике, а у части пациентов развивается болезнь Крона (БК) [7]. Микроскопическое воспаление в кишечнике может являться важным прогностическим признаком СпА. Было показано, что воспаление в кишечнике при СпА приводит к прогрессированию до АС [7, 9]. Сообщается, что воспаление в кишечнике ассоциируется с бóльшими по размерам очагами отека костного мозга в крестцово-подвздошных суставах, высоким риском прогрессирования до АС и развития БК [8, 9]. Также было показано, что повышенный уровень фекального кальпротектина был выше у пациентов с признаками микроскопического воспаления в кишечнике [10]. Согласно последним литературным данным, до 70% пациентов со СпА и АС имеют признаки микроскопического воспаления в кишечнике без кишечной симптоматики, а у 5–10% пациентов возникает ВЗК [11].
Целью нашего исследования являлось изучение выраженности и частоты гастроинтестинальных симптомов у больных АС и их сравнение с пациентами, имеющими сочетание АС и ВЗК.
 МАТЕРИАЛ И МЕТОДЫ
МАТЕРИАЛ И МЕТОДЫ
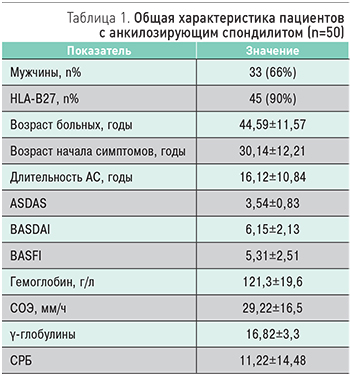
В одноцентровое поперечное исследование было включено 50 пациентов с АС (женщин 17 (34%), мужчин 33 (66%)), наблюдавшихся в Республиканской клинической больнице Минздрава Республики Татарстан (г. Казань). Средний возраст пациентов составил 44,59±11,57 лет, средний возраст начала симптомов – 30,14±12,21 лет, средняя длительность АС – 16,12±10,84 лет. У преобладающего большинства пациентов была HLA-B27-позитивность – 45 (90%). Вовлечение периферических суставов присутствовало у 39 пациентов (78%). У большинства пациентов была очень высокая активность заболевания согласно индексу активности ASDAS (3,54±0,83); высокая активность по индексу активности BASDAI (6,15±2,13). Оценку функциональных нарушений проводили согласно индексу BASFI (Bath AS Functional Index). Значение индекса BASFI было 5,31±2,51, т.е. выраженные нарушения. Все пациенты с АС, включенные в исследование, находились на терапии нестероидными противовоспалительными препаратами (НПВП). Общая характеристика пациентов представлена в табл. 1.
Диагноз АС устанавливался в соответствии с модифицированным Нью-Йоркским классификационным критериям, 1984 г.
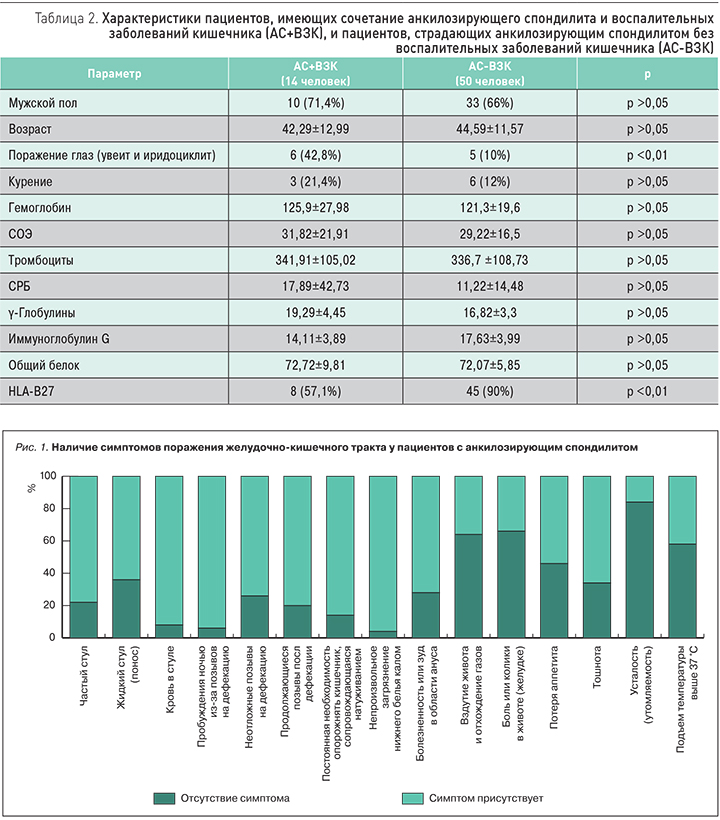
В качестве группы сопоставления в исследование были включены пациенты с сочетанием АС и ВЗК (14 человек). Мужчин было 10 человек (71,4%), средний возраст пациентов составил 42,29±12,99 лет, остальные характеристики представлены в табл. 2. Диагноз язвенного колита и БК устанавливался в соответствии с российскими клиническими рекомендациями по соответствующей нозологической форме – язвенный колит или болезнь Крона.
Все пациенты с АС заполнили опросник Dudley Inflammatory Bowel Symptom Questionnaire (DISQ) по выявлению и оценке выраженности гастроинтестинальных симптомов у пациентов со спондилоартритом [12]. Опросник состоит из 15 вопросов. Степень выраженности симптомов в течение прошедшей недели была описана по 5-балльной шкале, где «0» – отсутствие симптома, «1» – симптом слабо выражен, «2» – умеренно выражен (иногда), «3» – выражен (часто), «4» – симптом очень выражен (невыносимый, приводящий к потере трудоспособности). Оценивалась сумма баллов по результатам ответов каждого пациента. Сумма баллов менее 19 расценивалась как ремиссия со стороны желудочно-кишечного тракта (по данным оригинального исследования).
Проведение исследования было одобрено локальным этическим комитетом ГБОУ ВПО «Казанский государственный медицинский университет» Минздрава России.
Статистическую обработку полученных данных проводили с помощью статистической программы IBM SPSS 23.0. Использовали общепринятые методы описательной статистики, методы непараметрической статистики. При анализе данных использовали критерий Манна–Уитни, коэффициент корреляции Спирмена, критерий Фишера и χ2. Для всех методов считали достоверными при p <0,05.
РЕЗУЛЬТАТЫ
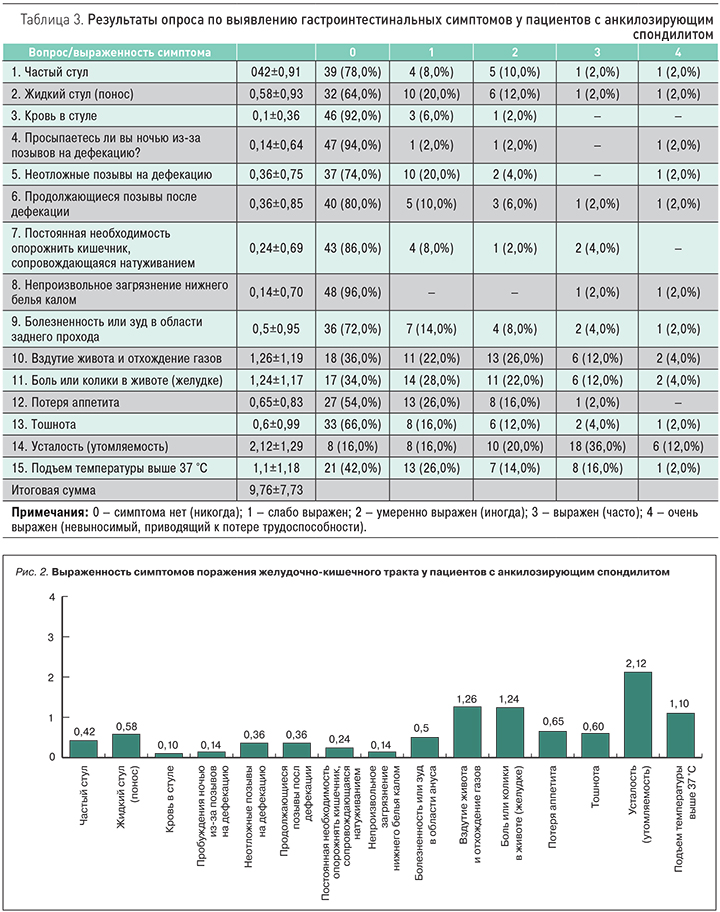
Анализ результатов опросника выявил очень гетерогенную частоту симптомов со стороны желудочно-кишечного тракта у пациентов с АС. К наиболее часто встречающимся симптомам относились усталость – 42 (84%) пациента, вздутие живота – 32 (64%), боли в животе (желудке) – 33 (66%), а также субфебрилитет – 29 (58%). Остальные симптомы присутствовали у пациентов реже и с разной степенью выраженности (рис. 1).
Нами была предпринята попытка сгруппировать вопросы на четыре блока по степени выраженности каждого признака: первый блок – связь с частотой стула; второй – отражение болевого синдрома; третий – диспепсия; четвертый – синдром астенизации и лихорадки. При подсчете среднего показателя выраженности каждого признака было выявлено, что преобладали жалобы на астению (2,12±1,29), вздутие живота (1,26±1,19) боли в животе (1,24±1,17), а также субфебрилитет. Средний балл по итоговому значению опросника составил 9,76±7,73 (рис. 2, табл. 3).
По данным нашего исследования, у 46 пациентов (92%) сумма баллов по результатам опросника была менее 19, что было расценено как ремиссия. У 4 пациентов значения превышали 19 баллов.
В дальнейшем мы проанализировали взаимосвязь суммарного показателя по данным опросника с клинико-лабораторными показателями АС. При проведении корреляции Спирмена не было выявлено связи между суммой результатов опросника и индексом активности BASDAI (r=0,12, p >0,05); ASDAS (r=0,40, p >0,05), длительностью АС (r=-0,13, p >0,05); возрастом пациентов (r=0,126, p >0,05), показателями лабораторной активности СРБ и СОЭ (r=-0,10, p >0,05 и r=-0,23, p >0,05).
В настоящем исследовании 27 (54,0%) пациентов принимали сульфасалазин. При сравнении больных АС в зависимости от приема этого лекарственного средства оказалось, что различий между группами по общему баллу опросника и приему сульфасалазина не было.
Следующий этап нашего исследования – сравнение пациентов с сочетанием АС и ВЗК (n=14) с больными АС без ВЗК (n=50). Не было выявлено различий по полу (71,4 против 66%, p >0,05) и возрасту пациентов (42,29±12,99 и 44,59±11,57, p >0,05). Сравнение данных групп пациентов по такому фактору риска АС, как курение (21,4 и 12%, p >0,05), не выявило различий.
 Между группами не было выявлено различий по показателям лабораторной активности: гемоглобин (125,9±27,98 против 121,3±19,6, p >0,05), СОЭ (31,82±21,91 против 29,22±16,5, p >0,05), тромбоциты (341,91±105,02 против 336,7±108,73, p >0,05), СРБ (17,89±42,73 против 11,22±14,48, p >0,05), γ-глобулины (19,29±4,45 против 16,82±3,3, p >0,05), иммуноглобулин G (14,11±3,89 против 17,63±3,99, p >0,05), общий белок (72,72±9,81 и 72,07±5,85, p >0,05).
Между группами не было выявлено различий по показателям лабораторной активности: гемоглобин (125,9±27,98 против 121,3±19,6, p >0,05), СОЭ (31,82±21,91 против 29,22±16,5, p >0,05), тромбоциты (341,91±105,02 против 336,7±108,73, p >0,05), СРБ (17,89±42,73 против 11,22±14,48, p >0,05), γ-глобулины (19,29±4,45 против 16,82±3,3, p >0,05), иммуноглобулин G (14,11±3,89 против 17,63±3,99, p >0,05), общий белок (72,72±9,81 и 72,07±5,85, p >0,05).
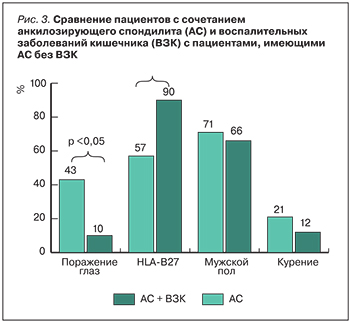
У пациентов, имеющих сочетание АС и ВЗК, частота поражения глаз (увеит и иридоциклит) была достоверно выше, чем у пациентов с АС без ВЗК (42,8 против 10%, р <0,01). Такой маркер АС, как HLA-B27, был выявлен достоверно чаще у пациентов с АС, чем с сочетанием АС и ВЗК (57,1 против 90%, р=0,01) (табл. 2, рис. 3).
ОБСУЖДЕНИЕ
Известно, что до 50–70% пациентов со спондилоартритами, имеют микроскопические признаки поражения кишечника [4]. Этим объясняется необходимость в более детальном обследовании пациентов с АС.
Первым шагом к детализации жалоб является грамотный сбор анамнеза с полной детализацией гастроинтестинальных жалоб. Одним из инструментов, который может использоваться в практике для выявления частоты и выраженности жалоб со стороны желудочно-кишечного тракта, служит опросник DISQ. Нами был проведен анализ симптомов со стороны желудочно-кишечного тракта, по результатам которого было выявлено, что наиболее часто встречались жалобы на астению, боли в животе (желудке), вздутие живота, субфебрилитет.
В опроснике присутствует вопрос о наличии болей в животе (желудке), однако не уточняются характеристики абдоминального болевого синдрома. Диагностический поиск при абдоминальном болевом синдроме представляет собой сложную задачу, у пациентов с АС боли в эпигастральной области часто обусловлены приемом НПВП. В нашем исследовании боли в животе (желудке) присутствовали у 66% пациентов, что в большинстве случаев было связано именно с применением НПВП.
В исследовании имелся ряд ограничений: пациенты с АС были включены в отделении ревматологии РКБ (исследование одноцентровое), куда госпитализируются пациенты с высокой активностью заболевания (что отражено и в нашем исследовании), а также с тяжелым и длительным течением АС. При длительном течении и на фоне использования сульфасалазина и НПВП клинические проявления могут существенно меняться.
Низкая частота выявления симптомов поражения кишечника может объясняться тем, что 54% пациентов принимали сульфасалазин.
Важно отметить, что у пациентов с сочетанием ВЗК и АС чаще было выявлено поражение глаз (иридоциклит и увеит), что может объясняться тем, что ВЗК, АС, увеит являются иммуноопосредованными заболеваниями [13], а наличие одного внекишечного проявления повышает вероятность развития другого внекишечного проявления [14]. У пациентов с АС достоверно чаще была выявлена HLA-B27- позитивность по сравнению с пациентами с сочетанием АС и ВЗК, что согласуется с данными литературы [15].
ЗАКЛЮЧЕНИЕ
В нашей группе больных АС по результатам опросника по выявлению гастроинтестинальных симптомов DISQ преобладали жалобы на астению, вздутие и боли в животе, субфебрилитет. При этом поражение желудочно-кишечного тракта протекало субклинически. Поражение глаз (увеит, иридоциклит) встречалось достоверно чаще у пациентов с сочетанием АС и ВЗК, чем у больных АС без ВЗК. HLA-B27 встречался чаще у больных АС без ВЗК, чем у пациентов с сочетанием АС и ВЗК.



