ВВЕДЕНИЕ
Инфаркт миокарда (ИМ) остается одной из ведущих причин заболеваемости и смертности во всем мире. Общепризнано, что его течение, особенности лечения и фоновые заболевания существенно варьируют в зависимости от возраста [1]. Несмотря на известный факт о пике заболеваемости у мужчин в возрасте 65 лет, а у женщин в возрасте 72 лет, последние тенденции отчетливо отражают «эпидемиологический сдвиг» в сторону среднего и молодого возраста с устойчиво сохраняющимся количеством госпитализаций с впервые возникшим ИМ в этих возрастных промежутках. Большинство пациентов (75%) – это молодые мужчины с модифицируемыми факторами риска, в частности курильщики, если речь идет о белой расе. При этом именно курение в данном случае ассоциируется с развитием ИМ с подъемом сегмента ST (ИМпST) на электрокардиограмме (ЭКГ). [2]. Кроме того, в отличие от пожилых, лица молодого возраста с ИМ характеризуются малоподвижным образом жизни, ожирением и гиперхолестеринемией, депрессией, злоупотреблением алкоголем, а значимые атеросклеротические бляшки у них обычно оказываются небольшими, эксцентричными, с признаками латентного воспаления [3, 4]. Также относительно высока доля пациентов с ИМ без обструкции коронарных артерий (ИМБОКА) – в среднем 1 из 7. ИМБОКА насчитывает несколько фенотипов в зависимости от патофизиологических механизмов, причем каждый из них характеризуется своим прогнозом и подразумевает особый подход к ведению пациента [2].
Факторы, которые влияют на риск развития повторных неблагоприятных событий у пациентов, перенесших ИМ, во всем многообразии успешно изучаются в крупномасштабных российских и зарубежных регистрах, однако их спектр продолжает расширяться по сей день [5, 6]. Особый интерес представляет поиск возможных различий при классической атеротромботической окклюзии коронарной артерии в сравнении с замедлением коронарного кровотока, включая изучение особенностей гормонального фона.
В связи с этим целью нашей работы стало определение факторов риска повторного ИМ у мужчин молодого возраста с нормальным и сниженным уровнем тестостерона с учетом ангиографической картины.
МАТЕРИАЛ И МЕТОДЫ
Работа была выполнена на базе кафедры госпитальной терапии и кардиологии ФГБОУ ВО «Пермский государственный медицинский университет имени академика Е.А. Вагнера» Минздрава России в период с 2019 по 2022 г. Объем наблюдений составил 99 человек. Исследование было простым, открытым, сравнительным, проспективным.
Критериями включения в исследования являлись возраст от 25 до 44 лет, мужской пол, наличие ИМ с подъемом сегмента ST на ЭКГ не позднее 12 ч до момента поступления в Региональный сосудистый центр, согласие пациента на проведение коронароангиографии (КАГ).
Критериями невключения были наличие сахарного диабета, любые формы острого коронарного синдрома в анамнезе, догоспитальная тромболитическая терапия, когнитивные нарушения, не позволяющие работать с опросниками и препятствующие контакту с пациентом в период наблюдения, врожденные и приобретенные пороки сердца, фибрилляция предсердий, полная блокада левой ножки пучка Гиса, индекс массы тела (ИМТ) ≥35 кг/м2, операции на органах малого таза и мошонки в анамнезе, прием стероидных препаратов до поступления в стационар, злокачественные новообразования предстательной железы, врожденные заболевания, сопровождающиеся гипогонадизмом, хронические заболевания почек и печени с нарушением их функций, отказ от участия в исследовании.
После оформления согласия на медицинское вмешательство обследуемые были разделены на две группы: 1-я группа – 60 пациентов с ИМпST на ЭКГ и феноменом замедленного коронарного кровотока (ФЗКК); 2-я группа – 39 пациентов с ИМпST на ЭКГ и обструктивным поражением коронарных артерий.
Диагноз ИМпST на ЭКГ устанавливался в соответствии с действующими клиническими рекомендациями Минздрава России (2020) [7]. Под ФЗКК (Y-феномен) понимали медленное антеградное прохождение контрастного вещества в коронарном артериальном дереве при отсутствии стеноза или спазма эпикардиальной коронарной артерии.
Определение уровня тестостерона выполнялось с применением набора реагентов «Вектор-Бест» (Россия), кортизола и секс-стероидсвязывающего глобулина (ССГ) – «Алкор Био» (Россия), свободного тестостерона –«ХЕМА» (Россия). Референсные значения, указанные производителем, составляли для тестостерона – 4,5–35,4 нмоль/л, ССГ – 12,4–78,4 нмоль/л, кортизола – 150–660 нмоль/л, свободного тестостерона – 4,5–42 пг/мл. Пороговым значением, позволяющим разграничить нормальное состояние и потенциальный дефицит тестостерона, считали 12,1 нмоль/л для общего тестостерона согласно Рекомендациям по диагностике и лечению дефицита тестостерона (гипогонадизма) у мужчин от 2016 г. [8].
Через 12 мес после индексируемого события по сведениям, внесенным в Единую информационную систему здравоохранения Пермского края, оценивалась выживаемость и количество повторных случаев ИМ.
Результаты, полученные в ходе исследования, обрабатывались с помощью методов вариативной статистики. Описательные данные для количественных признаков с нормальным распределением представлены как среднее и стандартное отклонение (М±σ), с ненормальным распределением – в виде медианы и интepквартильного интервала (Me [25; 75]); для качественных признаков приведены абсолютная частота проявления признака (количество обследованных), частота проявления признака в процентах (%). Сравнение качественных признаков проводилось с использованием точного критерия Фишера и вычислением χ2. Если p-уровень в любых вычислениях составлял менее 0,05, различия между группами считались значимыми. Для определения вероятности развития неблагоприятных событий использовалось многофакторное прогнозирование с построением логистических регрессионных моделей.
РЕЗУЛЬТАТЫ
Клинико-демографические характеристики пациентов, вошедших в исследование, отражены в таблице 1.
В зависимости от локализации, в 1-й группе чаще наблюдался передний (43,3%), во 2-й – нижний ИМ (38,5%). Во 2-й группе значимо чаще регистрировалась левожелудочковая недостаточность Killip 2-й степени, тогда как 3-й и 4-й степени в группах отмечено не было.
Через год контакт с частью пациентов был утерян, поэтому далее обсуждаются результаты для 57 и 29 человек из 1-й и 2-й групп исследования соответственно. Основные показатели лабораторно-инструментального обследования, а также данные однолетнего диспансерного наблюдения представлены в таблице 2.
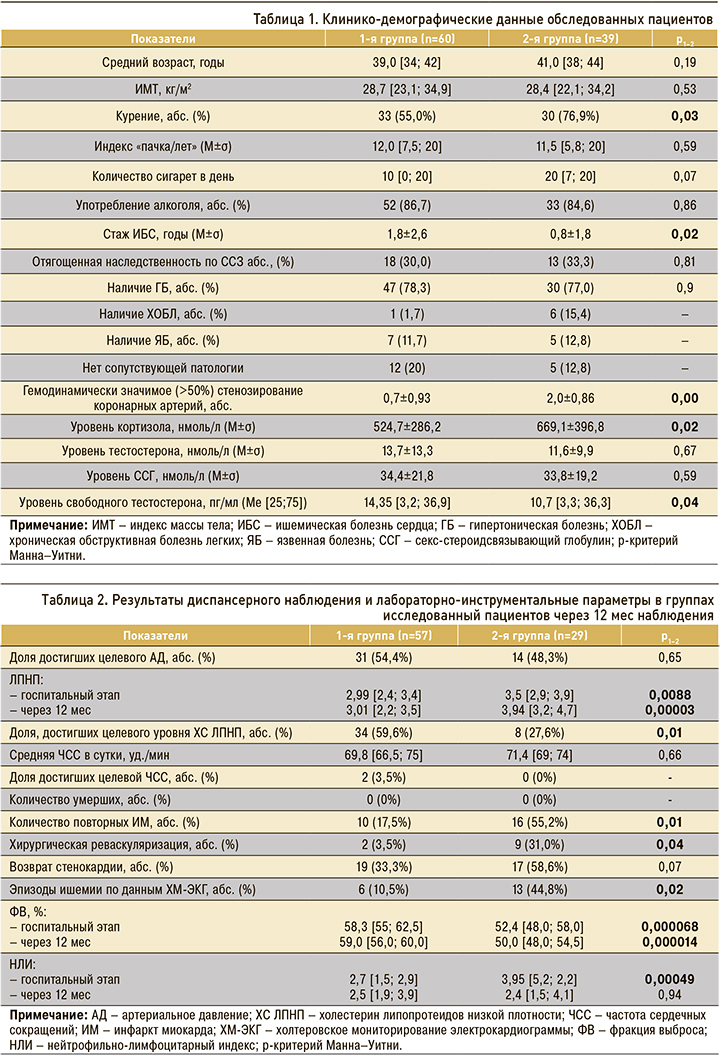
Учитывая необходимое для достижения статистической мощности результатов количество случаев, позволяющих строить модель прогнозирования, нами была предпринята попытка выявления предикторов повторного ИМ среди всех пациентов, вошедших в исследование и не имевших критериев андрогенодефицита. Сравнительный анализ данных в группах пациентов без андрогенодефицита с развившимся через год повторным ИМ и без него установил значимые межгрупповые различия по уровню кортизола, нейтрофильно-лимфоцитарного индекса (НЛИ) и количеству пораженных артерий. С помощью метода бинарной логистической регрессии было получено уравнение следующего вида: z=-1,01 + (-5,05) × X1 + 2,7 × X2 + 1,2 × X3, где -1,01 – константа; -5,05, 2,7, 1,2 – весовые коэффициенты соответствующих показателей; X1 – кортизол (X1 принимает значение, равное 1, при значении кортизола более 434,5 и равен 0 при значении кортизола менее 434,5); Х2 – НЛИ (Х2 имеет значение, равное 1, при НЛИ более 2,8 и равно 0 при НЛИ менее 2,8); Х3 – число пораженных коронарных артерий.
Исходя из полученных коэффициентов регрессии, риск развития повторного ИМ возрастает при снижении уровня кортизола и при увеличении значений НЛИ и количества пораженных артерий. При выбранном пороге отсечения модели процент правильной классификации прогнозирования повторного ИМ составил 86,7%, значение площади под ROC-кривой – 0,84±0,07 (95% доверительный интервал (ДИ) 0,69–0,94), чувствительность – 86,4%, специфичность – 87,5%. Соответствующие результаты графически суммированы на рисунке 1, модель является статистически значимой (р=0,004).
Массив данных, полученных для пациентов обеих групп со сниженным уровнем тестостерона, также позволил построить модель прогнозирования неблагоприятного исхода (повторного ИМ) через 12 мес наблюдения. Было получено следующее уравнение множественной регрессии: z = -0,981 + 5,8 × X1 + 0,072 × Х2 - 0,114 × X3, где -1,01 – константа; 5,8, 0,072, -0,114 – весовые коэффициенты соответствующих показателей; X1 – НЛИ (X1 принимает значение, равное 1, при НЛИ более 2,58 и равен 0 при значении кортизола менее 2,58); Х2 – холестерин липопротеидов низкой плотности (ХС ЛПНП); Х3 – фракция выброса левого желудочка (ФВ ЛЖ).
Согласно полученным коэффициентам регрессии, риск развития повторного ИМ возрастает при снижении значения ФВ ЛЖ и увеличении значений НЛИ и ХС ЛПНП. При выбранном пороге отсечения модели процент правильной классификации прогнозирования повторного ИМ составил 86,7%, значение площади под ROC-кривой – 0,68±0,078 (95% ДИ: 0,53–0,83), чувствительность – 67 %, специфичность – 38 %. Результаты графически представлены на рисунке 2, данная модель также является статистически значимой (р=0,001).

ОБСУЖДЕНИЕ
Предлагаемое проспективное наблюдение было попыткой выявить патофизиологические особенности возникновения и течения ИМ у мужчин молодого возраста с ФЗКК (вариант ИМБОКА) в сравнении с атеротромботической окклюзией коронарной артерии.
Анализ частоты встречаемости факторов риска ИМ с различной ангиографической картиной позволил установить некоторые межгрупповые отличия: так, пациенты с ФЗКК реже курили, а представители 2-й группы чаще имели отягощенную наследственность и более выраженную дислипидемию.
Анализируя годовой этап наблюдения, в первую очередь следует отметить высокую выживаемость пациентов в обеих группах, что в целом соотносится с мировыми данными, где однолетняя летальность в соответствующей возрастной когорте составляет около 2,4% [9]. Тем не менее вызывает озабоченность тот факт, что при ИМ 2-го типа риск нежелательных событий может быть выше, чем при ИМ 1-го типа; это отчасти связано с недооценкой его этиологии и недостаточной доказательной базой по использованию препаратов для вторичной профилактики [10]. С позиций повторного ИМ менее благополучно выглядит 2-я группа пациентов, однако благоприятные исходы к концу первого года наблюдения в 1-й группе не отменяют дальнейшего выполнения задач по предупреждению смерти и повторных сердечно-сосудистых событий.
Помимо анализа классических факторов риска, в основу сравнения нами была положена гипотеза о возможных влияниях гормонального статуса на тот или иной вариант поражения коронарного русла, а также на дальнейший однолетний прогноз. Однако, как следует из проведенного регрессионного анализа, уровень андрогенов в нашем исследовании существенно не повлиял на прогноз у мужчин с различными ангиографическими феноменами. И в том, и в другом случае в модели вошли показатели, характеризующие воспалительную активность клеток периферической крови, а также уровень ХС ЛПНП. В первом случае интересно, что риск повторного ИМ у мужчин без андрогенодефицита связан обратной зависимостью с концентрацией кортизола. Аналогичные результаты приводят Nijm J. et al., убедительно демонстрируя снижение и сглаживание надпочечникового ответа у пациентов с ишемической болезнью сердца, дизрегуляцию гипоталамо-гипофизарно-надпочечниковой оси, напрямую связанную с интенсивностью системного воспалительного ответа [11].
Вторая модель для пациентов со сниженным уровнем тестостерона подчеркивает значимость для прогноза уровня ХС ЛПНП и ФВ ЛЖ. Тем не менее, как следует из проведенного исследования, ни в одной из групп не было удовлетворительного контроля и достижения целевого уровня ХС ЛПНП через год, особенно низкой эта доля оставалась при классическом атеротромбозе (27,6%). Недостаточный ответ на назначение статинов в большей части может быть связан с низкой приверженностью терапии, хотя нельзя исключать и наличие у пациентов индивидуальных генетических особенностей метаболизма холестерина и лекарственных препаратов в печени. Мы полагаем, что в нашем случае ведущей проблемой остается плохая приверженность лечению, несмотря на то что гиполипидемическая фармакотерапия является обязательным компонентом лечения ИМпST, начиная с ранних сроков, и далее неопределенно долго. Более того, как убедительно было продемонстрировано в работе Л.И. Салямовой с соавт., достижение целевых значений ХС ЛПНП сопряжено с максимально благоприятной динамикой мозгового натрийуретического пептида и структурно-функциональных характеристик артериальной системы в постинфарктном периоде за счет плейотропных вазопротективных эффектов высокодозных статинов [12]. Учитывая остальные компоненты, вошедшие в модель прогнозирования, представляется, что дальнейшее совершенствование взаимодействия с пациентом по вопросу липидснижающей терапии становится стратегически важным аспектом его ведения.
НЛИ оказался общим компонентом обеих моделей прогноза. Этот расчетный показатель ассоциируется с эндотелиальной дисфункцией, острым и хроническим воспалением, причем нейтрофилы выступают в качестве продуцентов медиаторов, способствующих дегенерации сосудистой стенки, а лимфоциты играют антиатеросклеротическую роль путем координации иммунного ответа. НЛИ, являясь отражением активности воспаления и оксидативного стресса, считается общепризнанным предиктором кардиоваскулярных событий, инсульта, фибрилляции предсердий, сердечной недостаточности, а также неблагоприятных исходов у пациентов с острым коронарным синдромом. Кроме того, высокий НЛИ ассоциируется с риском инсулинорезистентности [13]. Последнее косвенно подтверждают и результаты нашего наблюдения, в котором через год в обеих группах пациентов были зарегистрированы новые случаи сахарного диабета (13 и 2 соответственно), хотя на этапе включения нарушения углеводного обмена отсутствовали. В том же исследовании [13] авторы констатируют отсутствие контроля артериальной гипертензии как причину, через которую высокая активность нейтрофилов вносит свой негативный вклад в возникновении неблагоприятных сердечно-сосудистых исходов. Эти данные вполне соотносятся с результатами нашего наблюдения, где через год доля пациентов, достигших целевого артериального давления (АД), составляла лишь 54,4 и 48,3% в группах. В связи с этим достижение целевого диапазона значений АД видится еще одним серьезным, потенциально модифицируемым фактором, с помощью которого можно влиять на прогноз.
Кроме полученных нами моделей прогноза, заслуживает внимания факт практически 100% недостижения через год целевых значений частоты сердечных сокращений (ЧСС) у обследованных пациентов по данным холтеровского мониторирования ЭКГ. Вопрос о роли ЧСС в развитии повторного ИМ, внезапной смерти, стенокардии по-прежнему остается дискуссионным, равно как и использование бета-блокаторов в реперфузионную эру [14]. Тем не менее, учитывая динамику показателя ФВ ЛЖ, мы полагаем, что коррекция этого фактора риска, особенно во 2-й группе, необходима с позиции хронической сердечной недостаточности с нейрогуморальной активацией.
ЗАКЛЮЧЕНИЕ
Таким образом, рутинное лабораторно-инструментальное обследование и анализ факторов риска не выявили существенных отличий между пациентами с различными ангиографическими феноменами. Проведенное проспективное однолетнее наблюдение позволило установить предикторы повторного ИМ у мужчин молодого возраста с ФЗКК и атеротромботической окклюзией коронарной артерии с учетом андрогенной функции. Как при сохраненном, так и сниженном уровне тестостерона предикторной ценностью обладают маркеры, характеризующие неблагоприятное сочетание атерогенной дислипидемии с активностью субклинического воспаления, что может приводить к повторной дестабилизации атеросклеротической бляшки. Результаты убедительно демонстрируют необходимость совершенствования дальнейшей работы по достижению целевых значений АД и ХС ЛПНП у пациентов, перенесших ИМпST.



