Тяжелый респираторный синдром, вызванный коронавирусом 2 типа (SARS-CoV-2), имеющий, по-видимому, зоонозное происхождение и названный новой коронавирусной инфекцией 2019 г. (COVID-19), впервые был диагностирован в Китае примерно полтора года назад. Большинство инфицированных лиц может не иметь клинической симптоматики, у значительной части пациентов эта инфекция протекает легко. Вместе с тем около 15% пациентов нуждаются в госпитализации, из них 5% имеют высокий риск развития критического состояния вследствие гипоксии, дыхательной и полиорганной недостаточности [1–4]. До настоящего времени не обнаружено эффективного антивирусного препарата против SARS-CoV-2, способного снизить летальность. Поэтому вопросы совершенствования патогенетической терапии госпитализированных пациентов и разработка средств специфической профилактики (вакцинации) остаются приоритетными.
Важнейшей особенностью инфекции, вызванной SARS-CoV-2, равно как и тяжелого острого респираторного синдрома (SARS), ближневосточного респираторного синдрома (MERS), высокопатогенного птичьего гриппа, является комбинация вирусного и аутоиммунного воспаления в легких, приходящегося на период формирования специфических антител. Морфологически этот процесс в легких представляет собой диффузное альвеолярное повреждение, которое клинически проявляется нарастающей дыхательной недостаточностью, снижением сатурации и концентрации кислорода в артериальной крови (SatO2) [5–8]. Воспалительный процесс первоначально запускается альвеолярными и капиллярными макрофагами легких, а затем принимает генерализованный характер и может представлять опасность для жизни. При этом отмечается характерное повышение концентрации маркеров воспаления: C-реактивного белка (СРБ), ферритина, интерлейкина-1 (ИЛ-1) и ИЛ-6 [4, 9, 10]. На следующем этапе развития инфекции – «цитокинового шторма» – провоспалительные цитокины сами могут становиться патогенетическими факторами развития тяжелого состояния, полиорганной недостаточности и летальных исходов. Поэтому контроль генерализованного воспаления – один из важнейших аспектов лечения пациентов, госпитализированных с COVID-19.
В рамках этой проблемы широко обсуждается роль применения кортикостероидов [11,12]. Имеются существенные противоречия в показаниях и противопоказаниях к использованию этой группы лекарственных средств, тем не менее они, как правило, назначаются пациентам в критическом состоянии [13, 14]. По литературным данным, кортикостероиды получают около 50% пациентов с различным течением COVID-19 [15, 16]. Однако большая группа больных на момент госпитализации не может быть отнесена к лицам в критическом состоянии; в то же время их состояние по данным динамического наблюдения остается нестабильным или ухудшается. Именно у этой группы пациентов эффективность применения кортикостероидов остается недостаточно изученной. Поэтому целью настоящего исследования стала ретроспективная оценка опыта практического применения кортикостероидов у пациентов со среднетяжелым и тяжелым, но не критическим течением COVID-19, клиническое описание целевых групп и оценка эффективности применения этой группы препаратов.
МАТЕРИАЛ И МЕТОДЫ
Проведено ретроспективное исследование 61 пациента, поступившего последовательно с 1 октября по 30 ноября 2020 г. в Инфекционный центр филиала № 1 3-го Центрального военного клинического госпиталя им. А.А. Вишневского. В исследование были включены пациенты с вероятным (клинически подтвержденным) и лабораторно подтвержденным случаем COVID-19 в сочетании с характерными изменениями в легких по данным компьютерной томографии (КТ). Обследование пациентов, диагностика основного заболевания, его осложнений, сопутствующих заболеваний проводились в соответствии с Временными методическими рекомендациями (ВМР): Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19); версия 8, актуальными на момент исследования [17].
Демографические показатели, сопутствующая патология, симптомы, клинические показатели, результаты лабораторных исследований и КТ были получены из базы электронных историй болезни. Для оценки тяжести состояния пациентов и порядка назначения кортикостероидов использовались положения, изложенные в актуальном для времени исследования варианте ВМР [17]. Согласно этой редакции ВМР, признаками среднетяжелого течения COVID-19 являются повышение температуры тела более 38 °C; частота дыхательных движений (ЧДД) >22/мин; одышка при физической нагрузке; изменения по данным КТ (рентгенографии) – минимальный или средний (КТ 1–2) объем поражения легких; SatO2 <95%; СРБ сыворотки крови >10 мг/л.
Порядок назначения кортикостероидов вне отделений реанимации и интенсивной терапии у пациентов COVID-19 определялся наличием признаков «цитокинового шторма» или нарастанием синдрома активации макрофагов. В настоящем исследовании основанием для назначения кортикостероидов были признаки нарастания синдрома активации макрофагов, которые включали возрастание уровня ферритина, СРБ сыворотки крови, развитие двух-, трехростковой цитопении. В этих случаях рекомендовалось применять метилпреднизолон по 120–125 мг внутривенно каждые 6–8 ч или дексаметазон 10 мг внутривенно через 12 ч в течение не менее 3 дней с последующим постепенным снижением дозы на 20–25% на введение каждые 1–2 сут в течение 3–4 сут и далее на 50% каждые 1–2 сут до полной отмены.
Статистический анализ выполнялся с помощью программы Statistica 10 для Windows. Анализ различий между группами проводили с помощью парного t-критерия Стьюдента, t-критерия Стьюдента, U-критерия Манна–Уитни, критерия Уилкоксона. Проверку принадлежности выборок к нормальному распределению осуществляли с помощью критериев Колмогорова–Смирнова, Шапиро–Уилка. Статистически значимыми считали различия при р <0,05.
РЕЗУЛЬТАТЫ
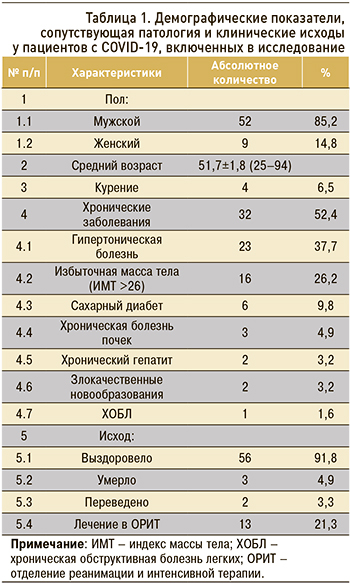 В исследование были включены все пациенты, госпитализированные в период с 1 октября по 30 ноября 2020 г. Показанием к госпитализации служила неэффективность амбулаторного этапа лечения пневмонии у пациентов COVID-19. Согласно данным, представленным в таблице 1, среди госпитализированных пациентов преобладали мужчины – 85,2%. Средний возраст участников составил 51,7±1,8 (25‒94) лет. Сопутствующую хроническую патологию, которая включала заболевания сердечно-сосудистой системы, эндокринной, дыхательной системы, злокачественные новообразования и болезни печени и почек, имели 32 (52,4%) пациента. Наиболее частыми сопутствующими заболеваниями были гипертоническая болезнь (37,7%), существенно реже наблюдался сахарный диабет (9,8%); повышенный индекс массы тела (ИМТ) имели 16 (26,2%) пациентов.
В исследование были включены все пациенты, госпитализированные в период с 1 октября по 30 ноября 2020 г. Показанием к госпитализации служила неэффективность амбулаторного этапа лечения пневмонии у пациентов COVID-19. Согласно данным, представленным в таблице 1, среди госпитализированных пациентов преобладали мужчины – 85,2%. Средний возраст участников составил 51,7±1,8 (25‒94) лет. Сопутствующую хроническую патологию, которая включала заболевания сердечно-сосудистой системы, эндокринной, дыхательной системы, злокачественные новообразования и болезни печени и почек, имели 32 (52,4%) пациента. Наиболее частыми сопутствующими заболеваниями были гипертоническая болезнь (37,7%), существенно реже наблюдался сахарный диабет (9,8%); повышенный индекс массы тела (ИМТ) имели 16 (26,2%) пациентов.
Пациенты были госпитализированы в стационар в среднем на 7,2±0,5 (1–17) день болезни. Продолжительность госпитализации составила в среднем 15,2±0,7 (2–32) сут. С полным выздоровлением были выписаны 56 человек (91,8%), 2 (3,3%) пациента были переведены в другие учреждения для проведения высокотехнологичных методов лечения (экстракорпоральной мембранной оксигенации крови и заместительной почечной терапии), из них один пациент погиб, а второй выписан с выздоровлением на 16 сут. Всего умерло 3 (4,9%) пациента, причиной смерти были острая дыхательная и сердечно-сосудистая недостаточность.
При поступлении у большинства пациентов наблюдались общая слабость (98,3%), сухой кашель (72,1%), повышение температуры тела (68,8%) (табл. 2). Примерно у четверти пациентов отмечалась одышка (24,5%) и аносмия (24,5%). Другие симптомы включали головную боль, выделение мокроты, тошноту/рвоту, боль в горле, диарею.
Респираторная поддержка с применением кислорода потребовалась 17 (27,8%) пациентам, 6 (9,8%) – неинвазивная и 4 (6,5%) – инвазивная вентиляция легких. С целью повышения оксигенации крови у 18 (29,5%) пациентов применялась прон-позиция со средней продолжительностью 3,0±0,8 (2–25) сут.
Антибактериальная терапия использовалась у 72,1% пациентов, противовирусная – у 60,6%. Противовирусная терапия не назначалась пациентам, получившим полный курс ее на амбулаторном этапе лечения, а также при госпитализации на поздних сроках от начала заболевания (> 8 сут).
Противовоспалительная терапия кортикостероидными гормонами (КСГ) была назначена 31 (51,7%) пациенту. Согласно ВМР, основанием для применения кортикостероидов было прогрессирование синдрома активации макрофагов (клинические признаки генерализованного воспаления, нарастание уровня СРБ сыворотки крови, развитие двух-, трехростковой цитопении): длительная (>5 сут) лихорадка, появление признаков дыхательной недостаточности (эпизоды снижения SpO2 <92%), нарастающее поражение легочной ткани по результатам КТ, повышение уровня СРБ в 4 и более раза.
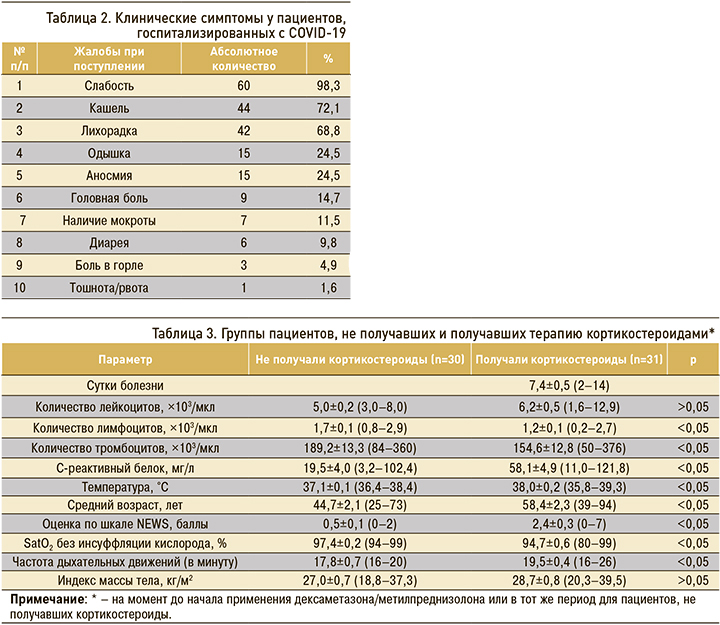
При ретроспективной оценке группы пациентов, не получавших и получавших кортикостероиды (табл. 3), до назначения этой терапии достоверно различались по всем изученным показателям, за исключением количества лейкоцитов и ИМТ. С учетом достоверных различий по клеточному составу крови (лимфопения, тромбоцитопения), по уровню СРБ (превышение более чем в 2,5 раза), оценки по шкале NEWS (превышение в 5 раз) пациенты, получавшие кортикостероидную терапию, относились к группе прогрессирования синдрома активации макрофагов.
Дексаметазон вводился 30 пациентам в средней курсовой дозе 113,3±5,9 (40–216) мг. Пульс-терапия метилпреднизолоном в курсовой дозе 3 г в течение 3 дней была назначена 1 больному. Начало лечения кортикостероидами в среднем пришлось на 7,4±0,5 (2–14) сут болезни или на 2,2±0,3 (1–9) сут госпитализации, продолжительность лечения составила в 7,4±0,4 (2–12) дней.
После завершения курса кортикостероидов (табл. 4) наблюдалось статистически значимое повышение лейкоцитов на 63%, лимфоцитов – на 83%, тромбоцитов – на 74%. Уровень СРБ у больных перед назначением кортикостероидов составлял 58,1±4,9 (11–121,8) мг/л, после завершения лечения отмечалось достоверное его снижение более чем в 2 раза – на 58%. Это свидетельствовало о снижении интенсивности воспалительной реакции, коррекции синдрома активации макрофагов, активации ростков костного мозга и позитивной клинической и лабораторной динамике COVID-19.
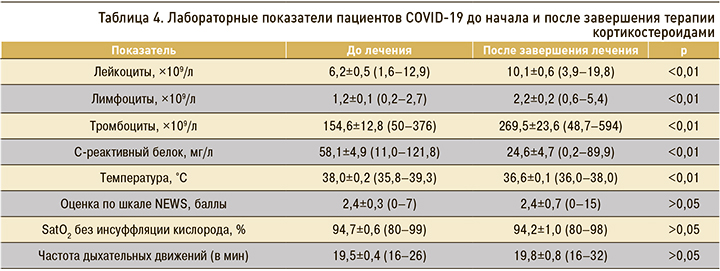
В то же время у 8 из 30 (27%) пациентов введение кортикостероидов не привело к стабилизации воспаления, и им потребовалось эскалация противовоспалительной терапии с применением моноклональных антител против ИЛ-6 или его рецептора.
Кортикостероиды получали 5 пациентов с сахарным диабетом, на фоне лечения у 4 из них была выявлена гипергликемия, требовавшая коррекции. У 26 пациентов без сахарного диабета применение кортикостероидов не сопровождалось повышением уровня сахара в крови. Частота развития нежелательных явлений (гипергликемии) при применении гормонов была достоверно выше у больных с сахарным диабетом (p <0,05).
ОБСУЖДЕНИЕ
Кортикостероиды участвуют в важных биологических процессах: метаболизме, репродукции, регуляции функциональной активности сердечно-сосудистой системы, водно-электролитного баланса, росте и развитии организма [18, 19]. Благодаря влиянию на иммунные реакции, они применяются для лечения инфекционно-аллергических и иммунологических заболеваний. Кортикостероиды применяли в комплексной терапии пациентов с инфекциями, вызванными MERS, SARS и вирусом гриппа [20, 21]. Уже на ранних этапах развития пандемии COVID-19 в Китае кортикостероиды достаточно широко использовались в качестве патогенетической терапии тяжелой COVID-19 с целью подавления воспаления в легких [14, 16].
В первых рекомендация ВОЗ по ведению пациентов с COVID-19, опубликованных в январе 2020 г., был обобщен предшествующий опыт лечения гриппа, SARS и MERS. В разделе, посвященном системным кортикостероидам, содержатся сильные рекомендации в пользу их применения у пациентов с тяжелым течением и в критическом состоянии и условные рекомендации против их использования у больных с нетяжелым COVID- 19 [22]. Это мнение было поддержано британскими экспертами в публикации от февраля 2020 г. (т.е. еще до появления COVID-19 в Европе) [12, 13], которые пошли дальше: по их мнению, кортикостероиды не должны применяться при поражении легких или развитии шока, вызванных SARS-CoV-2, вне проведения клинических исследований до тех пор, пока не появится более глубокое понимание роли этих лекарственных средств в лечении вирусной пневмонии. В своих комментариях к рекомендациям ВОЗ и экспертному мнению британцев китайские специалисты, имевшие к тому времени собственный опыт лечения пациентов с COVID-19, опубликовали свое видение перспектив лечения в виде согласованного заключения [14]. Основные положения его были следующими.
1. Польза и вред кортикостероидов должны быть внимательно взвешены перед началом их применения.
2. Применение кортикостероидов должны быть обдуманным у пациентов с пневмонией в критическом состоянии.
3. Для пациентов с гипоксемией, вызванной сопутствующими заболеваниями, или регулярно применяющих кортикостероиды для лечения хронических заболеваний необходимо внимательная оценка их применения.
4. Кортикостероиды должны вводиться в низкой или средней дозе (≤0,5–1 мг/кг метилпреднизолона/сут или эквивалентная доза других препаратов), продолжительность их применения должна быть короткой (≤7 дней).
В основу мнения британских экспертов легли факты, полученные при изучении предшествующих эпидемий. Так, в обсервационных исследованиях пациентов с инфекцией, вызванной SARS, не было обнаружено положительного влияния кортикостероидов на выживание, но имелась опасность развития тяжелых побочных эффектов (асептического некроза головки бедренной кости, психоза, сахарного диабета и задержки клиренса вирусов) [12, 23]. В систематическом обзоре обсервационных исследований пациентов с гриппом был выявлен высокий риск летальных исходов и развития вторичных инфекций, однако сила доказательности данных рассматривалась как очень низкая или низкая из-за различий между исследованиями в показаниях для назначения кортикостероидов. После коррекции статистических недостатков с учетом времени применения кортикостероидов было показано отсутствие их влияния на летальность пациентов гриппом. В исследовании по применению кортикостероидов при MERS не было выявлено их влияния на летальность, но была обнаружена задержка элиминации вирусов из нижних дыхательных путей; это и стало основным аргументом против использования кортикостероидов.
В связи с этим важным этапом исследований COVID-19 было получение доказательств отсутствия негативного влияния кортикостероидов на продолжительности клиренса вирусов [24]. Недавно были опубликованы результаты крупного рандомизированного клинического исследования (RECOVERY) по применению дексаметазона у пациентов в критическом состоянии. При введении этого препарата 28-дневная летальность была ниже (по сравнению с лечением без кортикостероидов) в группах пациентов, находившихся на ИВЛ (29,3 против 41,4%; относительный риск (ОР) 0,64; 95% доверительный интервал (ДИ) 0,5–0,81) или получавших кислород без ИВЛ (23,3 против 26,2%; ОР 0,82; 95% ДИ 0,72–0,94). При этом данный показатель не изменился в группе пациентов, не получавших респираторную поддержку на момент рандомизации (17,8 против 14,0%; ОР 1,19; 95% ДИ 0,91–1,55). На этом основании был сделан вывод об отсутствии влияния кортикостероидов на течение нетяжелой инфекции [25].
В другом исследовании было показано, что короткий курс дексаметазона достоверно снижал уровень СРБ и продолжительность госпитализации пациентов с COVID19 [26].
Таким образом, к началу описания нашего исследования уже были получены данные о положительном влиянии кортикостероидов на важные показатели пациентов COVID-19 в критическом состоянии. Однако данные об эффективности их применения у пациентов в тяжелом или среднетяжелом состоянии оставались немногочисленными и противоречивыми. Согласно этим данным, использование кортикостероидов не имело негативных последствий, но и не оказывало позитивного влияния на летальность и продолжительность госпитализации.
В нашем исследовании изучены все пациенты, поступившие в октябре–ноябре 2020 г. и пролеченные в соответствии с актуальными на тот момент ВМР по COVID-19. Существенной особенностью нашей когорты пациентов было преобладание мужчин (85%), поскольку в случае с данным заболевания мужской пол – фактор риска неблагоприятного исхода [27]. Клинические данные наблюдаемой когорты также отличались от аналогичных описаний тем, что наиболее частыми проявлениями инфекции были слабость и кашель, в то время как у авторов других исследований – лихорадка [16].
Разделение пациентов на получавших и не получавших кортикостероиды проводилось ретроспективно. Препараты этой группы получили 31 из 60 (52%) пациентов; после сравнения демографических, клинических и лабораторных показателей оказалось, что группа больных, получавших кортикостероиды, достоверно отличалась двухростковой супрессией костного мозга (лимфоциты, тромбоциты), показателями воспаления (температура тела выше на 1 градус, концентрация СРБ выше более чем в 2,5 раза), средним возрастом (старше на 14 лет) и степенью респираторных показателей. Достоверная разница этих показателей позволяет трактовать группу пациентов, которым вводились кортикостероиды, как более тяжелую.
Пациенты получили кортикостероиды на 7,4 сут болезни – эти сроки обычно рассматриваются как период синдрома активации макрофагов и усугубления респираторных нарушений [9]. При неблагоприятном течении COVID-19 следующими этапами нарастания тяжести пациентов COVID- 19 считается фаза респираторных расстройств с потребностью в кислородной поддержке (медиана – 8 сут), развитие острого респираторного дистресс-синдрома (на 9 сут), перевод в ОРИТ и начало ИВЛ (10,5 сут). Продолжительность применения кортикостероидов составила в среднем 7,4 сут. Известно, что в результате применения этих препаратов может происходить декомпенсация сахарного диабета. С учетом этих обстоятельств особое внимание было уделено оценке гликемического профиля 5 пациентов с диабетом, получавших кортикостероиды: у 4 из них возникла необходимость в дополнительном введении инсулина, у 1проводилось обычное лечение.
Результатом применения кортикостероидов было снижение активности воспаления и стабилизация клинического состояния у 22 из 30 (73%) участников исследования, так как именно у этих пациентов не потребовалась дальнейшая эскалация противовоспалительной терапии с использованием специфических антицитокиновых средств. Во всей группе больных после применения кортикостероидов нормализовалась температура и в 2 раза снизился уровень СРБ. При оценке лабораторных показателей до и после введения кортикостероидов было получено достоверное повышение количества лимфоцитов (на 83%) и тромбоцитов (на74%), а уровень СРБ после завершения лечения достоверно снизился более чем в 2 раза (на 58%), т.е. исчезли признаки двухростковой миелосупрессии. Указанные изменения особенно важны в отношении лимфоцитов (CD4+ и CD8+ T-клеток), так как именно эти клетки играют важнейшую роль в противовирусной защите. Показано, что подобно SARSCoV, SARSCoV-2 приводит к нарушению механизмов врожденного иммунитета и лимфопении [28, 29]. Лимфопения связана с несколькими причинами: перераспределением лимфоцитов из крови в органы мишени, истощением лимфоцитов, негативным соотношением лимфоцитов и сывороточным уровнем цитокинов ИЛ6, ИЛ10 и фактора некроза опухолиα (ФНО-α). При яжелой инфекции SARSCoV2 имеется высокий уровень этих цитокинов и снижение популяции T-клеток. У выздоравливающих пациентов наблюдается обратная тенденция: снижение уровня ИЛ6, ИЛ10 и ФНО-α и восстановление популяции T-клеток [30]. Согласно нашим данным, применение кортикостероидов вызывало существенное и достоверное увеличение количества лимфоцитов, что можно рассматривать в качестве позитивного эффекта, обусловленного снижением дезадаптационных реакций иммунной системы.
Оценивая и сопоставляя наши данные с результатами крупных проспективных исследований [25], необходимо отметить, что эти исследования имеют различные цели и изучают разные процессы. Для крупных проспективных исследований, изучающих в качестве основной группы пациентов в критическом состоянии, стратегической целью служит доказательство эффективности кортикостероидов в отношении основного конечного результата – снижения летальности. Исходя из этой цели и создается дизайн исследования – мощность, количество пациентов, конечные точки. В связи с этим на немногочисленную группу нетяжелых пациентов, которые не входят в основную популяцию в таких исследованиях, может не хватать запланированной мощности для получения обоснованных результатов. В нашем же исследовании мы преследовали тактическую цель: изучить эффекты кортикостероидов в подавлении воспаления как одного из патогенетических механизмов нарастания тяжести COVID-19. Учитывая сложность патогенеза COVID-19 (одновременная активация иммунной системы, генерализованного воспаления, систем свертывания и комплемента), повышение вероятности декомпенсации хронической патологии на фоне инфекции, подавление генерализованного воспаления – лишь один из факторов, способных повлиять на течение и исход заболевания. Нами получены достоверные результаты, которые свидетельствуют, что применение кортикостероидов в комплексной терапии COVID-19 у 73% пациентов со среднетяжелым течением привело к уменьшению признаков генерализованного воспаления и препятствовало дальнейшему развитию негативного сценария болезни. Введение кортикостероидов коротким курсом и в рекомендуемых дозах оказалось безопасным в плане развития гипергликемии для пациентов без сахарного диабета, а у больных с диабетом потребовало дополнительной коррекции гипергликемии в рутинном порядке.
ЗАКЛЮЧЕНИЕ
На основании ретроспективного сравнительного анализа клинических и лабораторных данных госпитализированных пациентов со среднетяжелым течением COVID-19 получены достоверные данные по снижению активности генерализованного воспаления после применения короткого курса кортикостероидов в рекомендуемых дозах (в соответствии с ВМР). Это привело к стагнации развития инфекции у 22 из 30 (73%) пациентов и прекращению эскалации дальнейшего лечения.



