Повседневная деятельность врача связана с постоянным поиском решений по выбору тактики лечения обратившегося к нему больного, назначению или коррекции ранее проводимой консервативной терапии, переходу к другим, более активным вмешательствам в течение патологического процесса. Такой выбор во многом зависит от правильной оценки состояния больного, определения вероятности риска неблагоприятного развития болезни, предвидения ее осложнений. И такой выбор бывает отнюдь не прост, поскольку необходимо учитывать влияние большого числа факторов, порой скрытых как от понимания больного, так и не находящихся «на поверхности» для пришедшего на помощь пациенту врача.
Врачи самых различных специальностей постоянно сталкиваются с разнообразными нарушениями процесса свертывания крови и тромбообразования, которые во многом определяют многоликость сосудистой патологии человека. Одним из важнейших направлений современной фармакотерапии сердечно-сосудистых заболеваний является антитромботическая терапия. Ее применение относится к стремительно развивающимся направлениям медицины.
ВЕНОЗНЫЙ ТРОМБОЗ И ТРОМБОЭМБОЛИЯ ЛЕГОЧНОЙ АРТЕРИИ
Тромбоэмболические венозные осложнения (тромбоз глубоких вен, тромбоэмболия легочной артерии, тромбозы подкожных вен) встречаются чрезвычайно часто, особенно у пожилых больных. Коварство этих заболеваний кроется в высокой потенциальной угрозе здоровью и жизни пациента, нередко с непредвиденным внезапным исходом. С этими заболеваниями сталкиваются врачи любой специальности, поскольку первая манифестация заболевания может быть неожиданной для больного, а его опасность останется недооцененной. По данным Минздрава России, в нашей стране ежегодно регистрируется около 80 тыс. новых случаев этого заболевания.
В течение месяца после выявления тромбоза глубоких вен (ТГВ) от тромбоэмболии легочной артерии (ТЭЛА) умирает до 6% больных. Пациенту, перенесшему массивную ТЭЛА, угрожает развитие вторичной легочной гипертонии, характеризующейся высоким риском смерти (до 15%) в течение ближайших 5 лет. Использование представленных ниже шкал риска, конечно, не должно заменять проведение визуализирующих методов диагностики. Они ставят своей целью еще раз обратить внимание на угрозы этого осложнения, часто возникающего внезапно для окружающих и уносящего жизни многих больных.
Шкала PESI (Pulmonary Embolism Severity Index) – шкала стратификации риска 30-дневной летальности при ТЭЛА (табл. 1). Она широко используется на практике и включает анализ 11 клинических показателей. На основании подсчета индексов пациента относят к одному из пяти классов (I–V), в которых 30-дневная летальность варьирует от 1 до 25% [1].
Можно использовать и упрощенный вариант этой шкалы, продемонстрировавший сопоставимую прогностическую точность (табл. 2). Обе шкалы обладают высоким отрицательным (97,5 и 99% соответственно) и весьма умеренным положительным прогностическим значением (10,9% в обоих случаях) [1].
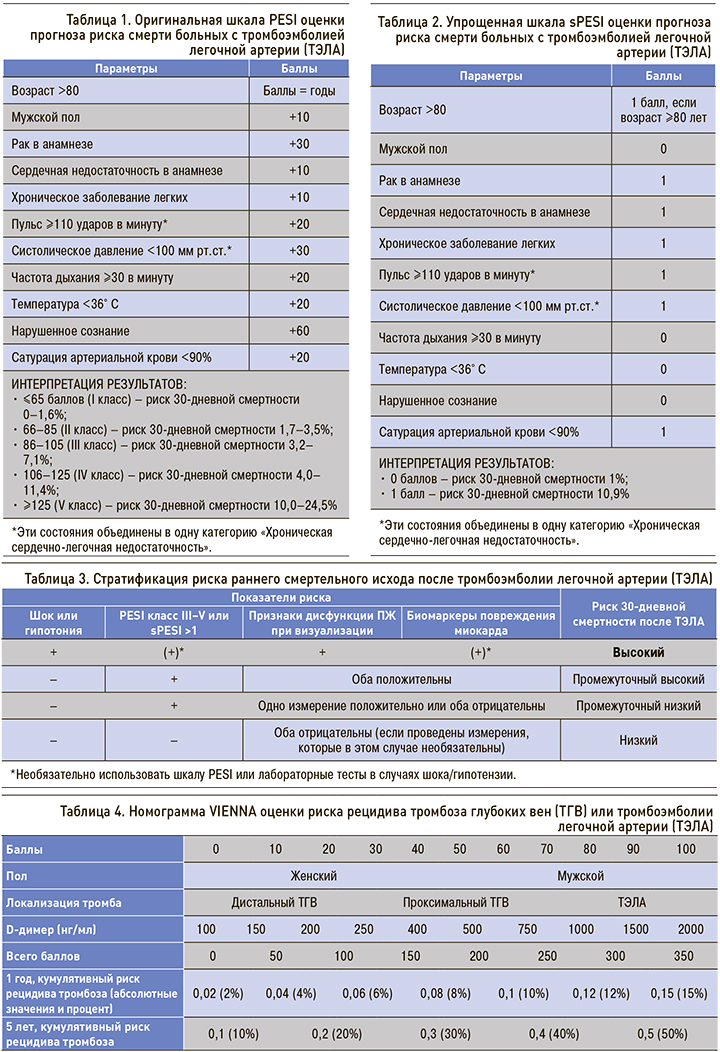
Стратификация риска раннего смертельного исхода после ТЭЛА отражена в табл. 3.
Номограмма VIENNA оценивает риск рецидива ТГВ или ТЭЛА (табл. 4). В ней учитываются клинические (тип тромбоза, пол) и аналитические (D-димер, определяемый после прекращения антикоагулянтной профилактики) данные [2].
Оценка результата. Должны быть построены перпендикулярные линии от каждого из параметров (пол, локализация тромба, уровень D-димера) к верхнему ряду (баллы). Сумма всех трех параметров откладывается на линии «всего баллов», и от нее строится перпендикуляр на линию, определяющую кумулятивный риск рецидива тромбоза [2].
Пример 1. Женщина с дистальным ТГВ и уровнем D-димера 237 мкг/Л получает 0 баллов за пол, 0 баллов за дистальный тромбоз и 28 баллов за уровень D-димера. Общее число баллов = 28, что соответствует кумулятивному риску рецидива тромбоза в первый год 1,5%, а 5-летний риск составляет 7,5%. У данной больной в течение 12 лет не наблюдалось повторных тромбозов [2].
Пример 2. Мужчина после ТЭЛА с уровнем D-димера 743 мкг/Л. Число набранных баллов составляет 217, что соответствует кумулятивному риску рецидива в первый год 7,9%. 5-летний риск составляет 28,5%. Рецидив у данного больного произошел через 14 мес [2].
Шкала WELLS определяет вероятность ТГВ нижних конечностей по совокупности клинических данных (табл. 5).

Оценка результатов. По сумме набранных баллов больных разделяют на группы с низкой, средней и высокой вероятностью наличия венозного тромбоза [3, 4].
Ограничения. Поскольку клинические данные не позволяют с уверенностью судить о наличии или отсутствии ТГВ, диагностический поиск должен включать последующее лабораторное и инструментальное обследование. В сочетании с нормальным уровнем D-димера и/или отрицательными результатами УЗИ сосудов «низкая вероятность» по шкале WELLS может безопасно исключать наличие у пациента ТГВ [3, 4].
Шкала PADUA служит прогностическим инструментом, созданным в Университете г. Падуя для выявления у нехирургических больных в условиях стационара риска ТГВ и/или ТЭЛА (табл. 6). Хотя возникновение ТГВ и ТЭЛА в стационаре часто связывают с проведением хирургических вмешательств и наличием травм, тем не менее более половины клинически выраженных случаев ТГВ нижних конечностей и ТЭЛА и до 80% смертей от ТЭЛА происходит у нехирургических больных [5].
Большинство больных, госпитализированных с острым нехирургическим заболеванием или обострением хронического нехирургического заболевания, имеют как минимум один из многочисленных признаков, наличие которых свидетельствует о повышенной вероятности венозной тромбоэмболии. Частота выявления ТГВ в нехирургическом стационаре составляет 10–26%, а у отдельных категорий больных она намного выше и может доходить до 80%. Поэтому первоначально необходимо определить, какова угроза возникновения ТГВ и ТЭЛА у конкретного больного и соответственно насколько он нуждается в профилактике [5].
Оценка результата. Эксперты Американской коллегии торакальных врачей предлагают для выявления угрозы возникновения ТГВ и ТЭЛА использовать индекс прогноза Padua и с его помощью разделять пациентов на группы низкого и высокого риска, что позволяет выявить лиц, нуждающихся в тромбопрофилактике. Среди пациентов с низким риском, не получавших тромбопрофилактику, частота ТГВ и ТЭЛА за 90-дневный период составила 0,3%. В то же время у больных с высоким риском (при наличии ≥4 баллов по шкале Padua) она достигла 11%. При принятии решения о медикаментозной профилактике ТГВ и ТЭЛА необходимо учитывать противопоказания, к которым прежде всего относится неприемлемо высокий риск кровотечений [5].
Шкала CAPRINI оценки опасности развития послеоперационных венозных тромбоэмболических осложнений (ВТЭО) разработана американским профессором J.A. Caprini для индивидуального прогнозирования вероятности развития тромбоза (табл. 7). Она была подтверждена ретроспективными регистровыми исследованиями более чем 16 тыс. пациентов общехирургического, сосудистого, урологического, оториноларингологического профиля, а также больных после пластических и реконструктивных операций и получающих интенсивную терапию [6, 7].

В зависимости от суммы баллов, полученной при сборе анамнеза и обследовании пациента, его относят к группе очень низкого, низкого, умеренного или высокого риска. Американской коллегией торакальных врачей (American College of Chest Physicians, ACCP) в рекомендациях 2012 г. предложено распределять пациентов по группам с учетом вида хирургического вмешательства (табл. 8) [6, 7].
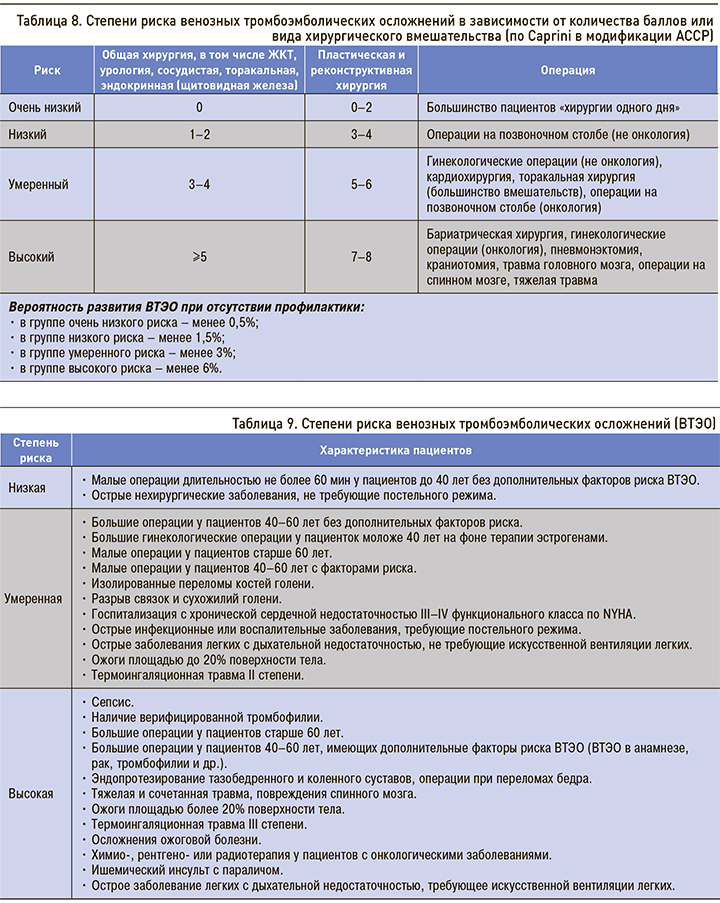
Наряду со шкалой Caprini большое практическое значение имеет система оценки риска с использованием в качестве основных факторов объема, продолжительности оперативного лечения и возраста пациента (табл. 9). Во всех случаях опасность ВТЭО увеличивается при наличии дополнительных факторов риска [4].
Малые операции
Общая хирургия: плановая холецистэктомия, аппендэктомия, грыжесечение.
Гинекология/акушерство: роды, аборт.
Травматология/ортопедия: вмешательство по поводу деформации стопы, артроскопия коленного сустава.
Урология: трансуретральная аденомэктомия.
Сосудистая хирургия: флебэктомия, стволовая лазерная или радиочастотная облитерация, кроссэктомия при восходящем тромбофлебите поверхностных вен.
Комбустиология: некрэктомия ожоговых ран на площади до 10% поверхности тела, аутодермопластика до 15% поверхности [4].
Большие операции
Общая хирургия: гастрэктомия, панкреатэктомия, колэктомия, резекция желудка или кишечника, осложненная аппендэктомия, холецистэктомия по экстренным показаниям, ампутация бедра, бариатрические операции.
Гинекология/акушерство: экстирпация матки, кесарево сечение, ампутация матки.
Травматология/ортопедия: остеосинтез бедра, протезирование суставов, остеосинтез костей голени, плановые операции на позвоночном столбе.
Урология: чреспузырная аденомэктомия, экстирпация мочевого пузыря, нефрэктомия с лимфаденэктомией и/или удалением опухолевого тромба из нижней полой вены.
Сердечно-сосудистая хирургия: артериальная реконструкция, аортокоронарное шунтирование.
Комбустиология: некрэктомия ожоговых ран на площади свыше 10% поверхности тела, аутодермопластика свыше 15% поверхности тела [4].
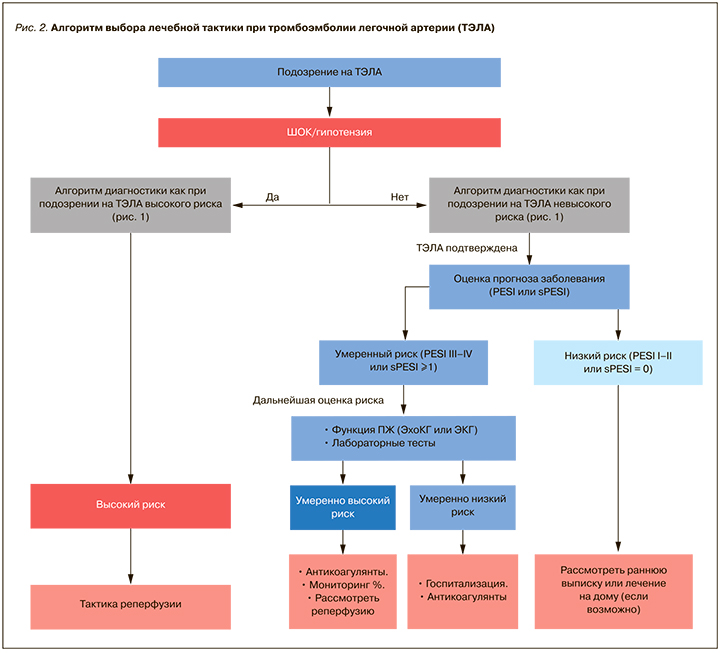
Алгоритм диагностики ТЭЛА предложен в рекомендациях ESC 2014 г. (рис. 1). Стратегии диагностики в случаях подозрения на ТЭЛА с высоким риском и ТЭЛА с невысоким риском различаются [1].

Главными клиническими критериями высокого риска являются шок и гипотензия. При наличии этих признаков у пациента с подозрением на ТЭЛА необходимо срочно выполнить компьютерную томографию (КТ), что позволяет при быстром обследовании сразу определить, к какой группе риска ранней смерти относится пациент. В случае положительного результата провести неотложное лечение, применив тромболизис или эмболэктомию. Если диагноз ТЭЛА не подтверждается, следует искать иную причину гемодинамических расстройств (кардиогенный шок, острая дисфункция клапанов сердца, разрыв миокарда с тампонадой полости перикарда, расслоение аорты). В случаях, когда срочное выполнение КТ невозможно и состояние пациента нестабильно, определение лечебной тактики основывается на результатах эхокардиографии (ЭхоКГ) [1].
Пациентов с подозрением на ТЭЛА без выраженных расстройств гемодинамики следует разделять на больных с высокой клинической вероятностью и невысокой клинической вероятностью (средней или низкой) ТЭЛА. У больных с высокой клинической вероятностью главным фактором, определяющим лечебную тактику, является результат многодетекторной спиральной КТ, которую рекомендуется выполнить сразу после установки предположительного диагноза ТЭЛА, без определения D-димера. При невысокой клинической вероятности первым шагом диагностики является тест на D-димер, который позволяет исключить ТЭЛА почти в 30% случаев. Если этот тест дал положительный результат, для подтверждения диагноза ТЭЛА следует выполнить многодетекторную спиральную КТ. Основанием для проведения тромболизиса или эмболэктомии у пациентов с невысокой клинической вероятностью ТЭЛА является подтверждение на КТ. Однако в этом случае точный выбор лечебной тактики основывается на других алгоритмах, представленных в данном руководстве [1].
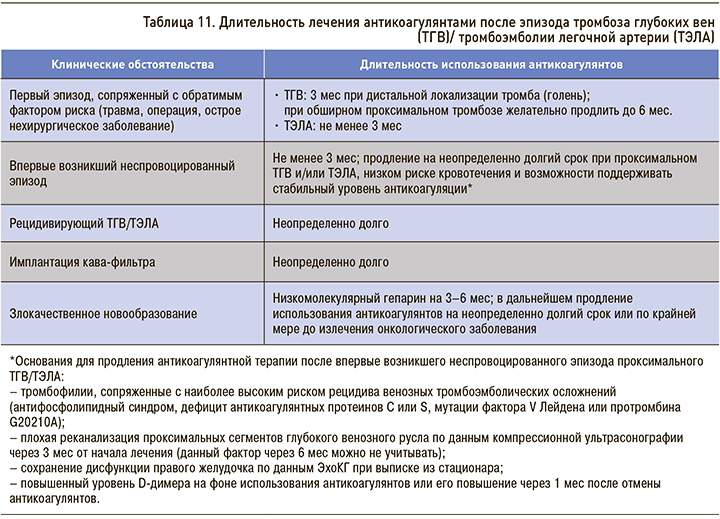
Алгоритм принятия решения о патогенетическом лечении ТЭЛА в зависимости от риска неблагоприятного течения заболевания с учетом клинических данных, результатов инструментального и лабораторного обследования представлен в рекомендациях ESC 2014 г. (рис. 2). Если тромболитическая терапия или эмболэктомия не планируются (например, из-за тяжелой сопутствующей патологии или сильно ограниченной ожидаемой продолжительности жизни), тогда уровень биомаркеров в крови можно не определять. Больные с классами I–II по индексу PESI или с нулевой суммой баллов по упрощенному индексу sPESI, но с повышенным уровнем сердечных биомаркеров или признаками дисфункции правого желудочка при его визуализации должны быть отнесены к группе промежуточного низкого риска. Из-за возможного утяжеления проявлений заболевания необходимо тщательное наблюдение за больными с промежуточно высоким риском летального исхода для своевременного выявления показаний к тромболитической терапии или эмболэктомии из легочных артерий (аналогичный подход может быть оправдан у больных с повышенным уровнем сердечного тропонина в крови, но без признаков дисфункции правого желудочка по данным ЭхоКГ или КТ) [1].
Выбор антикоагулянта и его дозы при лечении ТЭЛА представлен в рекомендациях ESC 2014 г. по диагностике и лечению венозного тромбоэмболизма (табл. 10). Стандартная длительность антикоагулянтного лечения при ТЭЛА должна продолжаться не менее 3 мес. В острой фазе заболевания применяется тромболитическая терапия, которая быстрее может восстановить кровоток, чем один нефракционированный гепарин [1].

Показания к использованию тромболитической терапии определяются по совокупности факторов, включая стратификацию риска по PESI. Применение таких антикоагулянтов, как нефракционированный гепарин, низкомолекулярные гепарины и фондапаринукс, должно продолжаться не менее 5–10 дней, а варфарина – до достижения международного нормализованного отношения (МНО) 2,0–3,0 с сохранением этой величины в течение последующих 2 дней. Использование нефракционированного гепарина должно быть приостановлено в случае применения стрептокиназы или урокиназы и может продолжаться на фоне инфузии алтеплазы. К парентеральным гепаринам необходимо добавлять антагонисты витамина K или один из прямых антикоагулянтов: дабигатрана этексилат, эдоксабан, ривароксабан или апиксабан [1].
В некоторых случаях терапия оральными антикоагулянтами может быть продолжена дольше 3 мес после взвешивания риска повторных тромбозов и кровотечений. Оральные антикоагулянты должны быть назначены как можно раньше и в идеале в тот же день, что и парентеральный гепарин. Низкомолекулярный гепарин и фондапаринукс натрия предпочтительнее по сравнению с нефракционированным гепарином, так как их использование ассоциировано с более низким риском развития больших кровотечений и гепарин-индуцированной тромбоцитопении. С другой стороны, нефракционированный гепарин обладает преимуществами при первичной реперфузионной стратегии, а также у пациентов с хронической болезнью почек (клиренс креатинина менее 30 мл/ мин) и ожирением. Кроме того, для нефракционированного гепарина разработаны широко доступные методы лабораторного мониторинга в виде активированного частичного тромбопластинового времени (АЧТВ) и активированного времени свертывания [1].
Антикоагулянтная терапия показана всем больным с ТГВ при отсутствии противопоказаний (табл. 11).
Лечение должно осуществляться терапевтическими дозами нефракционированного гепарина, низкомолекулярного гепарина, фондапаринукса натрия, антагонистами витамина K, новых оральных антикоагулянтов (апиксабана, дабигатрана этексилата, ривароксабана). Впоследствии для длительного лечения следует выбрать один из режимов антикоагуляции:
- переход с парентерального введения лечебных доз антикоагулянтов на антагонисты витамина K при целевом МНО 2,0–3,0. При этом длительность совместного применения антагонистов витамина K и парентеральных антикоагулянтов должна составлять как минимум 5 сут. Парентеральное введение лечебных доз антикоагулянтов может быть прекращено, когда при двух последовательных определениях с интервалом 1 сут МНО будет находиться как минимум на нижней границе терапевтического диапазона (не менее 2,0);
- переход на пероральный прием лечебной дозы дабигатрана этексилата (150 мг 2 раза/сут) как минимум после 5-дневного парентерального введения антикоагулянтов. Альтернативой служит пероральный прием лечебных доз апиксабана (10 мг 2 раза/сут 7 дней, затем 5 мг 2 раза/сут) или ривароксабана (15 мг 2 раза/сут в течение 3 нед с переходом на однократный прием 20 мг/сут) с первого дня лечения ТГВ или переход на эти лекарственные средства в первые 2 сут после начатого введения парентеральных антикоагулянтов;
- продленное использование низкомолекулярного гепарина (подкожное введение лечебной дозы в первый месяц с возможностью последующего снижения до 75% от лечебной) рекомендуется предпочесть у беременных, а также у больных со злокачественными новообразованиями (по крайней мере, в ближайшие 3–6 мес после развития тромбоза);
- общая продолжительность лечения антикоагулянтами зависит от наличия и характера факторов, предрасполагающих к рецидиву заболевания, наличия ВТЭО в анамнезе, распространенности тромбоза и ряда других обстоятельств. Она должна составлять не менее 3–6 мес [4].



