ВВЕДЕНИЕ
Доброкачественные метастазирующие новообразования представляют собой группу опухолей, которые, несмотря на гистологически доброкачественный характер, обладают способностью к метастазированию. К опухолям этого типа преимущественно относят менингиому [1], лейомиому матки [2], гигантоклеточные опухоли костей [3], слюнных желез и скопления невусовых клеток в шейных лимфатических узлах [4].
Доброкачественная метастазирующая лейомиома (ДМЛ) – редкое заболевание, характеризующееся разрастанием множественных гистологически доброкачественных метастазов лейомиомы матки в органах и тканях. Вместе с тем известны и другие варианты метастатического поражения доброкачественной метастазирующей лейомиомы, такие как внутривенный (морфологически доброкачественные опухоли в просвете и по ходу венозных сосудов органов малого таза) [5] и перитонеальный лейомиоматоз.
Способность к метастазированию традиционно рассматривается как критерий злокачественных новообразований. Однако ДМЛ включает качества как доброкачественных, так и злокачественных опухолей, занимая таким образом промежуточное положение между этими клиническими состояниями (табл. 1).

В доступной нам литературе было описано более 100 наблюдений ДЛМ, но истинная ее распространенность неизвестна в связи с трудностями диагностики, ошибочной трактовкой клинических данных и зачастую бессимптомным течением этого клинического состояния. В настоящее время возросло число публикаций об этой патологии, что связано с повышением интереса к этому заболеванию, а также улучшением рентгенологической диагностики с помощью компьютерной томографии (КТ) легких [4]. Наиболее часто ДМЛ встречается в популяции женщин репродуктивного возраста, а именно среди тех, у которых впервые выявили лейомиому и отдаленные метастазы одновременно, либо среди тех, у которых имеется лейомиоматоз матки в анамнезе (после гистерэктомии или операции по поводу лейомиомы) [6].
ИСТОРИЧЕСКАЯ СПРАВКА
Впервые заболевание описал Steiner P.E. в 1939 г. у больной 36 лет, у которой была диагностирована прогрессирующая фибролейомиома матки с метастазами в легкие (Metastazing fibroleiomyoma of uterus: Report of a case and review of literature). При гистологическом исследовании первичной опухоли матки и метастазов преобладали гладкомышечные клетки и волокна соединительной ткани при отсутствии анаплазии и митозов, что, по мнению автора, было критерием доброкачественного новообразования, несмотря на наличие метастатического потенциала. Steiner P.E. оказался первым, кто высказался о диссоциации между клиническими и гистологическими данными: морфологически опухоль соответствует критериям доброкачественного новообразования, но клинически проявляет свойства злокачественной опухоли. Позже данное клиническое состояние получило название «доброкачественная метастазирующая лейомиома» [2].
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Этиология рассматриваемого заболевания на настоящий момент до конца не изучена, однако были предложены гипотезы, объясняющие патогенез ДМЛ легкого.
1. Известно, что при цитогенетическом исследовании выявление терминальных делеций 19q и 22q имеет отношение к ДМЛ [7]. Также было обнаружено, что в подгруппе с делецией 1p транскрипционный профиль напоминал профиль лейомиосаркомы, а это позволяет сделать предположение о возможном существовании у общего патологического пути у указанных состояний [7, 8]. В связи с этим локусы 1p, 19q и 22q могут быть использованы в качестве маркеров лейомиомы матки с возможностью метастазирования, особенно в легкие [8, 9]. Таким образом, ДМЛ – генетически определяемое заболевание.
2. Также известно, что лейомиома матки является гормонально чувствительной опухолью. Выделяют теорию гормональной стимуляции: в части случаев ДМЛ в опухоли обнаруживались рецепторы не только эстрогенов, но также прогестерона и лютеинизирующего гормона [7, 10, 11]. Было показано увеличение распространенности ДМЛ при воздействии эстрогенов или повышенном их эндогенном уровне [12, 13]. Регрессия опухоли наблюдалась во время беременности [14], после оофорэктомии [10], в менопаузе [15], при терапии агонистами гонадотропин-рилизинг-гормона [16], мегестролом [15], ингибиторами ароматазы Р-450 и селективными модуляторами эстрогенных рецепторов [10]. Иными словами, рост опухоли стимулируется эстрогеном и подавляется прогестероном. В то же время теория гормональной стимуляции не может объяснить все случаи возникновения ДМЛ [17].
КЛИНИЧЕСКАЯ КАРТИНА
ДМЛ легкого в большинстве случаев протекает бессимптомно и становится случайной находкой при проведении рентгенографии, КТ органов грудной клетки [6, 18]. В случае прогрессирования роста новообразований, увеличении их числа и размеров могут возникнуть следующие симптомы: хрипы, обнаруживаемые при аускультации легких, боли в груди, развитие правожелудочковой недостаточности с соответствующими клиническими проявлениями в виде цианоза, одышки, периферических отеков, асцита, гепатомегалии [2, 6].
ГИСТОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА
Диагноз ДМЛ подтверждается при помощи биопсии. Гистологически опухоли состоят из множества гладкомышечных клеток, не имеющих признаков ядерного полиморфизма, некроза или значительной митотической активности.
Кроме того, опухолевые узлы обычно содержат захваченные доброкачественные элементы легочного эпителия, свидетельствующие о медленном росте, что согласуется с вялотекущим течением болезни [7].
При иммуногистохимическом исследовании выявляются маркеры гладкомышечных клеток – десмин, гладкомышечный актин, мышечно-специфический актин, кальдесмон, а также виментин, рецепторы эстрогенов, прогестерона и лютеинизирующего гормона. Кроме того, известно, что исследование индекса пролиферативной активности Ki-67 имеет низкий уровень экспрессии, что свидетельствует о наличии доброкачественного новообразования [11, 19, 20].
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
ДМЛ прежде всего необходимо дифференцировать с лейомиосаркомой. Основными критериями для постановки диагноза лейомиосаркомы матки служат высокая митотическая активность (не менее 6 митозов в 10 полях зрения), наличие очагов некроза, клеточная атипия. Вместе с тем эти показатели не являются достаточно специфичными [17, 21]. Помимо этого, существуют сложности в оценке характера процесса при «пограничном» числе митозов (4–5 в 10 полях зрения). Оценка пролиферативной активности опухоли (индекс Ki-67) может служить лишь вспомогательным диагностическим методом. Более точный способ, позволяющий достоверно дифференцировать лейомиому и лейомиосаркому, – молекулярно-генетическое исследование [17].
Также лейомиоматоз матки с доброкачественными метастазами в легкие следует дифференцировать с другими доброкачественными метастазирующими заболеваниями – лифангиолейомиоматозом (ЛАМ) и торакальным эндометриозом. [22]
Лифангиолейомиоматоз (ЛАМ) – редкое заболевание, которое клинически проявляется одышкой, пневмотораксом, накоплением хилезного выпота в полости плевры и эпизодами кровохаркания. [23] Важно подчеркнуть: несмотря на то что ДМЛ и ЛАМ могут быть на первый взгляд похожи, это два морфологически разных заболевания. При ЛАМ на КТ органов грудной клетки высокого разрешения будут выявляться характерные множественные кисты разного размера, распространяющиеся на всем протяжении легочной ткани. При гистологическом исследовании обнаруживаются множественные узелки из гладкомышечных клеток [24– 27]. Диагноз ЛАМ так же, как и ДМЛ, подтверждается при помощи биопсии (положительная реакция к актину гладких мышц, десмину и НМB45, рецептору эстрогена и/или прогестерона при иммуногистохимическом исследовании) [28, 29].
Торакальный эндометриоз (ТЭ) – это патологическое состояние, характеризующееся имплантацией ткани эндометрия в легочной паренхиме и клинически проявляющееся пневмотораксом, гемотораксом, кровохарканием, изолированной болью в груди и пневмомедиастинумом [30, 31]. Наиболее часто симптомы у пациенток проявляются во время менструации [32]. Большинство исследователей выделяет в основном четыре клинико-рентгенологических паттерна ТЭ: пневмоторакс, гемоторакс, кровохарканье и легочные узлы [34]. Некоторые авторы настаивают на том, что диагноз ТЭ выступает практически диагнозом исключения, так как ни КТ, ни эндоскопия для этого заболевания не являются специфичными.
Группы заболеваний, в отношении которых должна проводиться дифференциальная диагностика при подозрении на ДМЛ, отражены в таблице 2 [4].

ТАКТИКА ВЕДЕНИЯ ПАЦИЕНТОВ
В настоящий момент не существует клинических рекомендаций по лечению ДМЛ ввиду того, что это клиническое состояние изучено недостаточно. Наиболее эффективным методом лечения служит удаление опухолевого образования с экстирпацией матки и придатков (при возможности такой операции), так как в этом случае значительно снижается уровень эстрогена, способного повлиять на рост новообразований. Однако зарегистрированы случаи постоперационных рецидивов [35].
Помимо хирургического лечения, при ДМЛ возможно применение гормональной терапии. В настоящий момент известны случаи использования агонистов гонадотропин-рилизинг-гормона (ГнРГ), ингибиторов ароматазы, селективных модуляторов эстрогенных рецепторов.
Определенной эффективностью в этом плане обладает селективный модулятор эстрогенных рецепторов ралоксифен. Исследования показали, что это лекарственное средство может индуцировать апоптоз и снижать пролиферацию клеток у женщин в постменопаузе с лейомиомами, тогда как у женщин в пременопаузе оно оказывает смешанное действие [36, 37]. Тамоксифен, в отличие от своего аналога ралоксифена, способен стимулировать рост внематочной лейомиомы и редко способствовал регрессии заболевания [38].
Агонисты ГнРГ не только подавляют стероидогенез в яичниках, но и ингибируют ароматазу Р450 в клетках лейомиомы [39]. Рандомизированное контролируемое клиническое исследование, в котором сравнивалось влияние ингибитора ароматазы летрозола и агониста ГнРГ трипторелина на объем лейомиомы матки, показало уменьшение объема опухоли с преимуществом первого препарата.
Как отмечалось выше, часто ДМЛ имеет бессимптомное, медленно прогрессирующее течение. В клинической практике описаны случаи спонтанной регрессии новообразований [18, 40–43]. Поэтому тактика наблюдения за пациентом в динамике, когда нет активного роста новообразований, может быть вполне оправдана. В случае же прогрессирования, появления соответствующих симптомов необходимо пересмотреть терапевтический подход.
Таким образом, тактика лечения ДМЛ определяется в каждом отдельно взятом случае индивидуально, однако ряд авторов утверждает о наибольшей эффективности экстирпации матки с придатками и предлагает хирургический метод как основной вид лечения доброкачественной лейомиомы матки с возможным последующим применением гормональной терапии.
ОПИСАНИЕ КЛИНИЧЕСКОГО НАБЛЮДЕНИЯ
Пациентка Р., 53 лет, 08.12.2022 обратилась в клинику для проведения оперативного лечения миомы матки.
Данные анамнеза: миома матки диагностирована в 2012 г., в течение последних 2 лет отмечался рост миоматозных узлов.
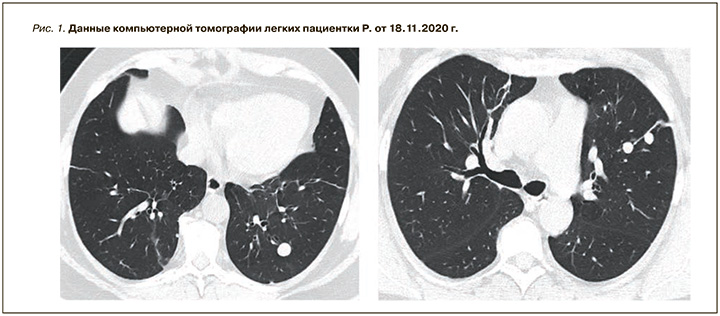
В ноябре 2020 г. при проведении КТ органов грудной клетки у пациентки были выявлены очаговые образования с четкими и ровными контурами (рис. 1). С целью верификации обнаруженных очаговых образований 29.01.2021 в Российском научном центре хирургии им. академика Б.В. Петровского больной была выполнена левосторонняя видеоассистированная торакальная полисегментарная резекция. Данные иммуногистохимического исследования от 15.02.2021: доброкачественная лейомиома? Динамическое исследование не проводилось, терапия не назначалась.
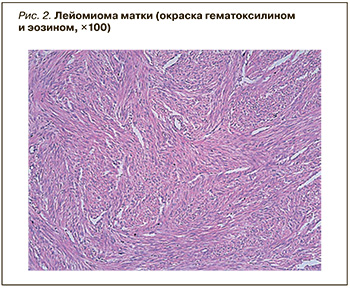
09.12.2022 пациентке была выполнена операция в следующем объеме: лапаротомия и экстирпация матки с придатками. В матке был обнаружен интрамуральный округлый узел серо-желтого цвета с четкими границами, плотноэластической консистенции размерами 11 × 9 × 8 см, который был представлен разнонаправленными переплетающимися пучками гладкомышечных волокон без некрозов и митозов, что позволило поставить диагноз лейомиомы матки (рис. 2).
Результаты ретроспективной оценки гистологического материала легкого от 15.02.2021:
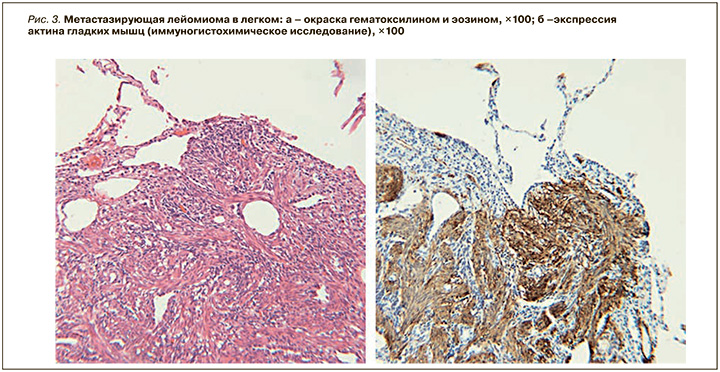
- гистологическое исследование: округлые образования представлены разнонаправленными пучками гладких мышц с наличием среди них зажатых бронхиол. Иммуногистохимическое исследование: выраженная цитоплазматическая экспрессия SMA, десмина, выраженная ядерная экспрессия PR, ER в большинстве клеток, слабая экспрессия р53 ~в 20% клеток, индекс пролиферации ki67 – 4%. Экспрессия CD34- в эндотелии сосудов. Отсутствует экспрессия HMB-45, MelanA (рис. 3);
- патологоанатомическое заключение: гистологическая картина и иммунофенотип соответствуют доброкачественной метастазирующей лейомиоме.
Окончательный диагноз: доброкачественная метастазирующая в легкие лейомиома.
На КТ органов грудной клетки от 12.12.2022 отмечалось увеличение в размере очаговых образований легких в сравнении с данными от февраля 2021 г.
Принимая во внимание проведенное оперативное лечение и наличие вероятности регресса метастазов на фоне отсутствия гормональной стимуляции, было принято решение проводить динамическое наблюдение за пациенткой с решением вопроса о назначении терапии при прогрессировании процесса.
ЗАКЛЮЧЕНИЕ
ДМЛ относится к редким и малоизученным клиническим состояниям, так как случаи этого заболевания выявляются редко, и на настоящий момент опубликованных данных недостаточно для составления единых клинических рекомендаций. Поэтому при обнаружении очаговых образований в легких с наличием миомы матки необходимо включать ДМЛ в диагностический поиск.



